ГОСТ 6689.5-92 Никель, сплавы никелевые и медно-никелевые. Методы определения железа, ГОСТ от 18 февраля 1992 года №6689.5-92
ГОСТ 6689.5-92
Группа В59
ОКСТУ 1709
Дата введения 1993-01-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством металлургии СССР
РАЗРАБОТЧИКИ
В.Н.Федоров, Б.П.Краснов, Ю.М.Лейбов, А.Н.Боганова, Л.В.Морейская, И.А.Воробьева
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета стандартизации и метрологии СССР от 18.02.92 N 167
3. ВЗАМЕН ГОСТ 6689.5-80
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Настоящий стандарт устанавливает фотометрический метод определения железа (при массовой доле железа от 0,001 до 0,1%), титриметрический (при массовой доле железа от 0,4 до 6,5%) и атомно-абсорбционный (при массовой доле железа от 0,004 до 6,5%) методы определения железа в никелевых и медно-никелевых сплавах по ГОСТ 492* и ГОСТ 19241.
______________
1. ОБЩИЕ ТРЕБОВАНИЯ
Общие требования к методам анализа — по ГОСТ 25086 с дополнением по разд.1 ГОСТ 6689.1.
2. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА С ПРИМЕНЕНИЕМ 1,10-ФЕНАНТРОЛИНА ИЛИ альфа, альфа’-ДИПИРИДИЛА
2.1. Сущность метода
Метод основан на измерении оптической плотности раствора, содержащего комплекс железа (II) с 1,10-фенантролином или -дипиридилом, в присутствии солянокислого гидроксиламина после предварительного выделения железа соосаждением с гидроокисью алюминия.
2.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461, разбавленная 1:1 и 2%-ный раствор.
Кислота соляная по ГОСТ 3118 и разбавленная 1:1 и 1:2.
Кислота серная по ГОСТ 4204 и разбавленная 1:1.
Кислота уксусная по ГОСТ 61.
Кислота фтористоводородная по ГОСТ 10484.
Аммиак водный по ГОСТ 3760 и разбавленный 1:100.
Аммоний хлористый по ГОСТ 3773.
Натрий уксуснокислый по ГОСТ 199.
Перекись водорода по ГОСТ 10929, 5%-ный раствор.
Аммоний-алюминий сернокислый (алюмоаммонийные квасцы) по ГОСТ 4238, 10 г/дм раствор: 10 г квасцов помещают в мерную колбу вместимостью 1 дм, растворяют в 150-200 см воды с добавлением 20 см серной кислоты (1:1) и доливают водой до метки.
Гидроксиламин солянокислый по ГОСТ 5456, раствор 10 г/дм, свежеприготовленный.
1,10-фенантролин солянокислый, раствор 1,5 г/дм: 1,5 г препарата помещают в стакан вместимостью 200 см и растворяют при нагревании в 50 см воды с добавлением нескольких капель концентрированной соляной кислоты; раствор помещают в мерную колбу вместимостью 1 дм и доливают водой до метки. Раствор хранят в темном сосуде.
-Дипиридил, раствор: 1,5 г препарата растворяют в 50 см воды при нагревании с добавлением нескольких капель концентрированной соляной кислоты, раствор помещают в мерную колбу вместимостью 1 дм и разбавляют водой до метки. Раствор хранят в темном сосуде.
Буферный раствор: 272 г уксуснокислого натрия растворяют в 500 см воды, добавляют 240 см уксусной кислоты, фильтруют и доливают водой до объема 1 дм.
Смесь реагентов свежеприготовленная: одну часть раствора солянокислого гидроксиламина смешивают с одной частью раствора 1,10-фенантролина солянокислого или одной частью раствора -дипиридина и тремя частями буферного раствора.
Железо металлическое.
Стандартные растворы железа
Раствор А: 1,0 г железа растворяют в 20 см азотной кислоты (1:1), раствор кипятят до удаления оксидов азота, охлаждают, помещают в мерную колбу вместимостью 1000 см, доливают до метки водой и перемешивают.
1 см раствора А содержит 0,001 г железа.
Раствор Б: 10 см раствора А помещают в мерную колбу вместимостью 1000 см и доливают до метки водой.
1 см раствора Б содержит 0
,00001 г железа.
2.3. Проведение анализа
2.3.1. Для сплавов, содержащих не менее 0,1% кремния и хрома и не содержащих вольфрама
Около 15 г сплава помещают в стакан вместимостью 300 см, добавляют 200 см соляной кислоты (1:1) и выдерживают при комнатной температуре примерно 3 мин, периодически перемешивая. Затем сливают соляную кислоту, стружку промывают несколько раз водой и сушат в сушильном шкафу при (110±10) °С. Из очищенной таким образом стружки берут навеску (см. табл.1), помещают ее в стакан вместимостью 250 см, добавляют азотную кислоту (1:1) (см. табл.1), накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. Стекло или пластинку и стенки стакана ополаскивают водой, добавляют воды до 150 см, 5 см раствора алюмоаммонийных квасцов, 5 г хлористого аммония и концентрированный раствор аммиака до образования растворимых аммиачных комплексов никеля и меди. Раствор выдерживают при 60 °С для коагуляции осадка гидроокиси железа и алюминия. Осадок отфильтровывают на фильтр средней плотности, стакан и осадок промывают 3-5 раз горячим раствором аммиака (1:100). Осадок растворяют в 10 см соляной кислоты (1:1) и фильтр 3-5 раз промывают горячей водой, собирая промывные воды в стакан, где проводилось осаждение. При анализе сплавов, содержащих марганец, при растворении осадка добавляют несколько капель раствора перекиси водорода. Осаждение, фильтрование, промывание и растворение осадка повторяют. Второй раз растворение осадка проводят на фильтре в присутствии 5 см раствора перекиси водорода.
Таблица 1
Массовая доля железа, г | Масса навески, г | Количество азотной кислоты (1:1), см | Аликвотная часть раствора, см | |||||
От | 0,001 | до | 0,002 | включ. | 5,0 | 50 | Весь раствор | |
Св. | 0,002 | « | 0,02 | « | 5,0 | 50 | 10 | |
« | 0,02 | « | 0,5 | « | 0,5 | 20 | 10 | |
« | 0,5 | 0,5 | 20 | 5 | ||||
При массовой доле железа в сплаве менее 0,002% раствор помещают в мерную колбу вместимостью 100 см, доливают водой до 50 см, добавляют 25 см смеси реагентов, разбавляют водой до метки и перемешивают. Через 30 мин измеряют оптическую плотность раствора на спектрофотометре в кювете с толщиной поглощающего света слоя 5 см при 510 нм или на фотоэлектроколориметре с зеленым светофильтром. Раствором сравнения служит раствор контрольного опыта.
При массовой доле железа свыше 0,002% раствор помещают в мерную колбу вместимостью 100 см, доливают водой до метки, перемешивают и отбирают аликвотную часть (см. табл.1) в другую мерную колбу вместимостью 100 см, разбавляют водой до 50 см и далее поступают, как указано выше.
2.3.2. Для сплавов, содержащих свыше 0,1% хрома или кремния
Навеску сплава (см. табл.1) помещают в платиновую чашку, добавляют 1 см фтористоводородной кислоты и 10 см азотной кислоты (1:1) и растворяют при нагревании. После охлаждения ополаскивают стенки чашки водой, добавляют 10 см серной кислоты (1:1) и раствор упаривают до появления белого дыма серной кислоты. Остаток охлаждают, добавляют 30-40 см воды, раствор помещают в стакан вместимостью 250 см, разбавляют водой до 150 см и далее поступают, как указано в п.2.3.1.
2.3.3. Для сплавов, содержащих вольфрам
Навеску сплава (см. табл.1) помещают в стакан вместимостью 300 см, добавляют азотную кислоту (1:1) (см. табл.1), накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. Стекло или пластинку и стенки стакана ополаскивают водой, раствор упаривают до сиропообразного состояния, разбавляют водой до 60 см и выдерживают в теплом месте для отстаивания и осветления раствора. Осадок вольфрамовой кислоты отфильтровывают на двойной плотный фильтр и промывают горячим 20%-ным раствором азотной кислоты. Осадок отбрасывают, а фильтрат разбавляют водой до 200 см, добавляют 5 см раствора алюмоаммонийных квасцов и далее поступают как указано в п.2.3.1.
2.3.4. Построение градуировочного графика
В мерные колбы вместимостью до 100 см помещают 0,5; 1,0; 3,0; 5,0; 7,0; 10,0; 20,0; 30,0 см стандартного раствора Б железа, разбавляют водой до 50 см и далее анализ проводят, как указано в п.2.3.1.
2.4. Обработка результатов
2.4.1. Массовую долю железа () в процентах вычисляют по формуле
,
где — масса железа, найденная по градуировочному графику, г;
— масса навески, соответствующая аликвотной части раствора, г.
2.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл. 2.
2.
Таблица 2
Массовая доля железа, % | Допускаемые расхождения, % | ||||||
От | 0,001 | до | 0,003 | включ. | 0,0008 | 0,001 | |
Св. | 0,003 | « | 0,005 | « | 0,001 | 0,001 | |
« | 0,005 | « | 0,01 | « | 0,002 | 0,003 | |
« | 0,01 | « | 0,03 | « | 0,003 | 0,004 | |
« | 0,03 | « | 0,05 | « | 0,005 | 0,007 | |
« | 0,05 | « | 0,10 | « | 0,008 | 0,01 | |
« | 0,10 | « | 0,2 | « | 0,015 | 0,02 | |
« | 0,2 | « | 0,4 | « | 0,020 | 0,03 | |
« | 0,4 | « | 1,0 | « | 0,030 | 0,04 | |
« | 1,0 | « | 3,0 | « | 0,050 | 0,07 | |
« | 3,0 | « | 5,0 | « | 0,10 | 0,1 | |
« | 5,0 | « | 6,5 | « | 0,15 | 0,2 | |
2. 4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО) или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденных по ГОСТ 8.315*, или методом добавок или сопоставлением результатов, полученных атомно-абсорбционным методом в соответствии с ГОСТ 25086.
4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО) или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденных по ГОСТ 8.315*, или методом добавок или сопоставлением результатов, полученных атомно-абсорбционным методом в соответствии с ГОСТ 25086.
______________
* На территории Российской Федерации действует ГОСТ 8.315-97, здесь и далее по тексту. — Примечание изготовителя базы данных.
3. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА
3.1. Сущность метода
Метод основан на титровании железа (II) раствором двухромовокислого калия после предварительного восстановления железа (III) до железа (II) двухлористым оловом с потенциометрической или визуальной индикацией конечной точки титрования по дифениламину в качестве индикатора.
3.2. Аппаратура, реактивы и растворы
Потенциометр с хлорсеребряным электродом сравнения и платиновым индикаторным электродом.
Кислота соляная по ГОСТ 3118 и разбавленная 1:1.
Кислота азотная по ГОСТ 4461.
Кислота серная по ГОСТ 4204 и разбавленная 1:1.
Кислота ортофосфорная по ГОСТ 6552.
Смесь кислот: 300 см серной кислоты (1:1) и 300 см фосфорной кислоты разбавляют водой до 1 дм.
Аммиак водный по ГОСТ 3760 и разбавленный 1:100.
Олово двухлористое, свежеприготовленный раствор 100 г/дм в соляной кислоте (1:1).
Ртуть двухлористая, раствор 40 г/дм.
Дифениламин по ГОСТ 5825, раствор 10 г/дм в концентрированной серной кислоте.
Калий двухромовокислый по ГОСТ 4220, 0,017 моль/дм раствор: 2,4519 г препарата, высушенного в течение 2 ч при (160±5) °С, растворяют в воде, помещают в мерную колбу вместимостью 1000 см и доливают до метки водой.
1 см раствора соответствует 0,002792 г железа.
Кислота фтористоводородная по ГОСТ 10484.
Аммоний хлористый по ГОСТ 3373.
Перекись водорода по ГОСТ 10929, 30%-ный раствор.
Натриевая соль дифениламиносульфоновой кислоты, раствор 2 г/
дм.
3.3. Проведение анализа
3.3.1. Навеску сплава массой 2 г (при массовой доле железа от 0,4 до 3,0%) или 1 г (при массовой доле железа свыше 3%) растворяют в 20 см соляной кислоты (1:1) и 10 см азотной кислоты в стакане вместимостью 600 см при нагревании. После растворения раствор разбавляют водой до 150 см. При анализе сплавов с массовой долей кремния свыше 0,05% навеску растворяют в платиновой чашке в 20 или 10 см азотной кислоты (1:1) и 1 см фтористоводородной кислоты при нагревании, добавляют 10 см серной кислоты (1:1), упаривают до белого дыма серной кислоты; остаток растворяют в 20-30 см воды и раствор переносят в стакан вместимостью 600 см, добавляют 5 см азотной кислоты (1:1) и раствор разбавляют водой до 150 см.
Добавляют 5 г хлористого аммония и аммиака до образования растворимого аммиачного комплекса никеля и меди.
Раствор выдерживают при 60 °С для коагуляции осадка гидроокиси железа. Осадок отфильтровывают на фильтр средней плотности, стакан и осадок промывают 3-5 раз горячим раствором аммиака (1:100). Осадок растворяют в 10 см соляной кислоты (1:1) с несколькими каплями перекиси водорода в стакане, в котором проводилось осаждение, и фильтр промывают горячей водой. Осаждение, фильтрование, промывание и растворение осадка повторяют. Раствор нагревают до кипения и восстанавливают трехвалентное железо до двухвалентного добавлением нескольких капель раствора двухлористого олова. Затем раствор охлаждают, добавляют 5 см раствора двухлористой ртути, 15 см смеси кислот, разбавляют водой до 200 см и титруют раствором двухромовокислого калия потенциометрически до скачка потенциала или добавляют несколько капель раствора дифениламина или раствора натриевой соли дифениламиносульфоновой кислоты и титруют до фиолетовой
окраски.
3.4. Обработка результатов
3.4.1. Массовую долю железа () в процентах вычисляют по формуле
,
где — объем раствора двухромовокислого калия, израсходованный на титрование, см;
0,002792 — массовая концентрация 0,017 моль/дм раствора двухромовокислого калия по железу, г;
— масса сплава, г.
3.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.2.
3.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденных по ГОСТ 8.315, или сопоставлением результатов, полученных атомно-абсорбционным методом, в соответствии с ГОСТ 25086.
4. АТОМНО-АБСОРБЦИОННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА
4.1. Сущность метода
Метод основан на измерении абсорбции атомами железа, образующимися при введении анализируемого раствора в пламя ацетилен-воздух.
4.2. Аппаратура, реактивы и растворы
Атомно-абсорбционный спектрометр с источником излучения для железа.
Кислота азотная по ГОСТ 4461 и разбавленная 1:1 и 1:100.
Кислота соляная по ГОСТ 3118 и 1 и 2 моль/дм растворы.
Смесь кислот: смешивают один объем азотной кислоты с тремя объемами соляной кислоты.
Кислота фтористоводородная по ГОСТ 10484.
Кислота серная по ГОСТ 4204, разбавленная 1:1.
Железо металлическое карбонильное или Государственный стандартный образец N 666-81 П типа 1.
Стандартный раствор железа: 0,1 г железа растворяют при нагревании в 10 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 1 дм и доливают водой до метки.

1 см раствора содержит 0,0001 г железа.
Медь по ГОСТ 859*.
______________
* На территории Российской Федерации действует ГОСТ 859-2001, здесь и далее по тексту. — Примечание изготовителя базы данных.
Стандартный раствор меди: 10 г меди растворяют при нагревании в 80 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки.
1 см раствора содержит 0,1 г меди.
Никель по ГОСТ 849*.
______________
* На территории Российской Федерации действует ГОСТ 849-2008. — Примечание изготовителя базы данных.
Стандартный раствор никеля: 10 г никеля растворяют при нагревании в 80 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки.
1 см раствора содержит 0,1 г никеля.
4.3. Проведение анализа
4.3.1. Для сплавов, не содержащих олова, кремния, хрома, вольфрама и титана
Навеску сплава массой, приведенной в табл.3, растворяют при нагревании в 10-20 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки. При массовой доле железа свыше 1,0% 10 см раствора пробы переносят в мерную колбу вместимостью 100 см, добавляют 10 см 2 моль/дм раствора соляной кислоты и доливают водой до метки. Одновременно проводят контрольный опыт. Измеряют атомную абсорбцию железа в пламени ацетилен-воздух при длине волны 248,3 нм параллельно с градуировочными растворами.
Таблица 3
Массовая доля железа, % | Масса навески, г | Объем стандартного раствора меди или никеля, см | |||||
От | 0,004 | до | 0,05 | включ. | 2 | 20 | |
Св. | 0,05 | до | 0,1 | « | 1 | 10 | |
« | 0,1 | « | 6,5 | « | 0,1 | — | |
4.3.2. Для сплавов с массовой долей олова свыше 0,05%
Навеску сплава (см. табл.3) растворяют при нагревании в 10 см смеси кислот. Раствор переносят в мерную колбу вместимостью 100 см и доливают до метки 1 моль/дм раствором соляной кислоты. При массовой доле железа свыше 1,0% 10 см раствора пробы переносят в мерную колбу вместимостью 100 см и доливают до метки 1 моль/дм раствором соляной кислоты. Одновременно проводят контрольный опыт. Измеряют атомную абсорбцию, как приведено в п.4.3.1.
4.3.3. Для сплавов, содержащих кремний, титан и хром
Навеску сплава (см. табл.3) помещают в платиновую чашку и растворяют при нагревании в 10-20 см азотной кислоты (1:1) и 2 см фтористоводородной кислоты. Затем добавляют 10 см серной кислоты (1:1) и упаривают до появления белого дыма серной кислоты. Чашку охлаждают и остаток растворяют в 50 см воды при нагревании. Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки. При массовой доле железа свыше 1,0% 10 см раствора пробы переносят в мерную колбу вместимостью 100 см, добавляют 10 см 2 моль/дм раствора соляной кислоты и доливают водой до метки.
4.3.4. Для сплавов, содержащих вольфрам
Навеску сплава (см. табл.3) растворяют при нагревании в 10-20 см азотной кислоты (1:1), затем добавляют 30 см горячей воды и выпавший осадок вольфрамовой кислоты отфильтровывают на плотный фильтр и промывают горячей азотной кислотой (1:100). Фильтрат переносят в мерную колбу вместимостью 100 см и доливают водой до метки. При массовой доле железа свыше 1,0% 10 см раствора пробы переносят в мерную колбу вместимостью 100 см, добавляют 10 см 2 моль/дм раствора соляной кислоты и доливают водой до метки. Одновременно проводят контрольный опыт. Измеряют атомную абсорбцию железа, как указано в п.4.3.1
4.3.5. Построение градуировочного графика
В шесть из семи мерных колб вместимостью по 100 см помещают 0,8; 2,0; 4,0; 6,0; 8,0 и 10,0 см стандартного раствора железа, что соответствует 0,08; 0,2; 0,4; 0,6; 0,8 и 1,0 мг железа. Во все колбы добавляют по 10 см 2 моль/дм раствора соляной кислоты.
При массовой доле железа менее 0,1% добавляют аликвотные объемы стандартных растворов (см. табл.3) меди (если медь является основой сплава) или никеля (если никель является основой сплава) и доливают водой до метки. Измеряют атомную абсорбцию железа, как указано в п.4.3.1. По полученным данным строят градуировочный график.
4.4. Обработка результатов
,
где — концентрация железа в анализируемом растворе сплава, найденная по градуировочному графику, г/см;
— концентрация железа в растворе контрольного опыта, найденная по градуировочному графику, г/см;
— объем раствора, см;
— масса навески пробы, г
.
4. 4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать допускаемых расхождений, приведенных в табл.2.
4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать допускаемых расхождений, приведенных в табл.2.
4.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденных по ГОСТ 8.315, или сопоставлением результатов, полученных фотометрическим или титриметрическим методами, в соответствии с ГОСТ 25086.
Электронный текст документа
подготовлен ЗАО «Кодекс» и сверен по:
официальное издание
М.: Издательство стандартов, 1992
Никель в крови
Определение концентрации никеля в сыворотке крови, используемое для диагностики острого и хронического отравления никелем.
Синонимы русские
Никель в сыворотке крови.
Синонимы английские
Nickel (Ni), Blood.
Метод исследования
Масс-спектрометрия с индуктивно-связанной плазмой.
Единицы измерения
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Никель – это тяжелый металл, соединения которого токсичны при их накоплении в организме. В норме он присутствует у человека в очень низких концентрациях, однако его физиологическая роль не установлена.
Основные пути попадания никеля в организм: с водой и пищей, в которых повышена концентрация этого металла. Он содержится в таких продуктах, как чай, кофе, шоколад, бобы, лесные орехи, капуста, шпинат и картофель. Ежедневно человек потребляет около 175 мкг никеля с пищей, что, однако, недостаточно для развития каких-либо симптомов интоксикации. Другой источник никеля – загрязненный воздух. За сутки некурящий человек вдыхает 0,1-0,25 мкг никеля (для рабочих металлургических предприятий эта цифра может превышать 1 мкг). Ингаляция является основным путем интоксикации на производстве. Курение увеличивает поступление никеля на 0,0004 мкг в сутки. Также имеет значение попадание этого элемента через кожу и слизистые оболочки при длительном контакте с никельсодержащими украшениями, монетами, предметами из нержавеющей стали. Элементарный никель не проникает через неповрежденную кожу, а вот абсорбция хлорида и сульфата никеля составляет 77 %.
Он содержится в таких продуктах, как чай, кофе, шоколад, бобы, лесные орехи, капуста, шпинат и картофель. Ежедневно человек потребляет около 175 мкг никеля с пищей, что, однако, недостаточно для развития каких-либо симптомов интоксикации. Другой источник никеля – загрязненный воздух. За сутки некурящий человек вдыхает 0,1-0,25 мкг никеля (для рабочих металлургических предприятий эта цифра может превышать 1 мкг). Ингаляция является основным путем интоксикации на производстве. Курение увеличивает поступление никеля на 0,0004 мкг в сутки. Также имеет значение попадание этого элемента через кожу и слизистые оболочки при длительном контакте с никельсодержащими украшениями, монетами, предметами из нержавеющей стали. Элементарный никель не проникает через неповрежденную кожу, а вот абсорбция хлорида и сульфата никеля составляет 77 %.
Чтобы диагностировать отравление никелем, измеряют его концентрацию в крови. Так как уровень никеля и других тяжелых металлов даже при превышении нормальных значений – это всего лишь нанограммы на миллилитр, для анализа используют сверхчувствительный метод атомно-адсорбционной спектрометрии. При этом точность исследования крови для диагностики отравления никелем уступает исследованию мочи. Кроме того, анализ не позволяет установить источник отравления (то есть не дифференцирует сульфиды, оксиды или элементарный никель).
Время появления симптомов и степень тяжести отравления никелем зависит от физиологического состояния организма, пути и скорости поступления никеля, наличия сопутствующих заболеваний и некоторых других причин. Повреждающее действие никеля основано на его способности связывать молекулы кислорода, препятствуя таким образом процессу окислительного фосфорилирования, и сульфгидрильные группы, снижая активность некоторых ферментов. Возникающий при этом дефицит АТФ сопровождается нарушением функции многих органов (легких, почек, кроветворной ткани), однако в первую очередь страдают ткани с высокой степенью метаболизма – печень и головной мозг. Острое отравление возникает при ингаляции карбонила никеля, одного из самых ядовитых для человека веществ. Карбонил никеля широко используется для очистки нефти, гидрогенизации масел, производства металлических сплавов и пластмассы. Симптомы отравления этим веществом включают одышку, кашель, головную боль, тошноту и рвоту, боль в области живота, кровотечение, отек легких, пневмонию, отек головного мозга, делирий, судороги и угнетение сознания вплоть до комы. Заболевание развивается в течение 12-120 часов после ингаляции паров карбонила никеля. Исследование концентрации никеля в крови дополняют другими лабораторными исследованиями для оценки функции жизненно важных органов.
Острое отравление возникает при ингаляции карбонила никеля, одного из самых ядовитых для человека веществ. Карбонил никеля широко используется для очистки нефти, гидрогенизации масел, производства металлических сплавов и пластмассы. Симптомы отравления этим веществом включают одышку, кашель, головную боль, тошноту и рвоту, боль в области живота, кровотечение, отек легких, пневмонию, отек головного мозга, делирий, судороги и угнетение сознания вплоть до комы. Заболевание развивается в течение 12-120 часов после ингаляции паров карбонила никеля. Исследование концентрации никеля в крови дополняют другими лабораторными исследованиями для оценки функции жизненно важных органов.
Большинство пациентов с хроническим отравлением никелем – это рабочие, контактирующие с сульфидами и оксидами никеля на производстве стекла, керамики и красок. Хроническая интоксикация никелем сопровождается симптомами раздражения верхних дыхательных путей (ощущение заложенности носа, кашель, ринорея) и может приводить к возникновению астмы. Кроме того, никель обладает канцерогенным эффектом и ассоциирован с развитием злокачественных опухолей носоглотки и легких. В этой группе пациентов также большое значение имеет перкутанный путь попадания никеля и развитие профессионального никелевого дерматита.
Следует отметить, что клиническая картина острого и хронического отравления никелем не является специфичной для данного тяжелого металла. Схожую симптоматику имеют интоксикации кадмием, хромом, кобальтом, медью, селеном и цинком. Поэтому диагностика отравления тяжелыми металлами у пациента с наличием профессиональных вредностей – это всегда комплексное обследование, включающее исследование концентрации всех необходимых элементов для установления конкретного источника отравления.
При интерпретации результата исследования следует обращать особое внимание на наличие в анамнезе контакта с соединениями никеля (в первую очередь, с карбонилом никеля). Так как клинически выраженное отравление никелем встречается очень редко в обычной популяции, повышение концентрации никеля у пациента без профессиональных вредностей требует повторной проверки. Повышение концентрации никеля в крови наблюдается у пациентов, находящихся на гемодиализе, что, однако, не сопровождается какими-либо признаками интоксикации и не имеет диагностического значения.
Повышение концентрации никеля в крови наблюдается у пациентов, находящихся на гемодиализе, что, однако, не сопровождается какими-либо признаками интоксикации и не имеет диагностического значения.
Для чего используется исследование?
Для диагностики острого и хронического отравления никелем у пациентов, работа которых предполагает определенный риск (очистка нефти, производство металлических сплавов, стекла, керамики).
Когда назначается исследование?
При симптомах:
- острого отравления никелем (карбонилом никеля): одышка, кашель, головная боль, тошнота и рвота, боли в области живота, кровотечения, отек легких, пневмония, отек головного мозга, делирий, судороги и угнетение сознания вплоть до комы;
- хронического отравления никелем: ощущение заложенности носа, насморк, кашель, приступы одышки или удушья, злокачественные новообразования носоглотки и легких.
Что означают результаты?
Референсные значения: 0,6 — 7,5 мкг/л.
Причины повышения уровня никеля в крови:
- острая или хроническая интоксикация никелем;
- гемодиализ.
Понижение уровня никеля в крови не имеет диагностического значения.
Что может влиять на результат?
- Концентрация никеля может повышаться при гемодиализе.
- После использования йод- или гадолинийсодержащих контрастных веществ исследование рекомендуется проводить не ранее чем через 4 суток.
Важные замечания
- При интерпретации результата следует обращать особое внимание на наличие в анамнезе контакта с соединениями никеля (карбонилом никеля).
- Положительный результат анализа у пациента без профессиональных вредностей скорее получен из-за загрязнения пробы.
Также рекомендуется
Кто назначает исследование?
Врач скорой помощи, анестезиолог-реаниматолог, профпатолог, токсиколог, врач общей практики.
Литература
- Ford et al. Clinical Toxicology/ M. D. Ford, K. A. Delaney, L. J. Ling, T. Erickson; 1st ed. — W.B. Saunders Company, 2001.
- Klaassen et al. Casarett and Doull’s Essentials of Toxicology/ C. D. Klaassen, J.B. Watkins III. 1st ed. – MCGraw-Hill, 2004.
- Cameron KS, Buchner V, Tchounwou PB. Exploring the molecular mechanisms of nickel-induced genotoxicity andcarcinogenicity: a literature review. Rev Environ Health. 2011;26(2):81-92.
- Tonelli M, Wiebe N, Hemmelgarn B, Klarenbach S, Field C, Manns B, Thadhani R, Gill J; Alberta Kidney Disease Network. Trace elements in hemodialysis patients: a systematic review and meta-analysis. BMC Med. 2009 May 19;7:25.
Определение никеля в присутствии железа и алюминия
Авторами проверена возможность определения кальция с хлоранилатом натрия в присутствии железа, алюминия, никеля. Установлено, что при содержании кальция менее 50 мкг осаждению его в виде хлоранилата не мешают алюминий, железо и никель, присутствующие в количествах до 100 мкг. При содержании кальция более 50 мкг железо и алюминий мешают во всех соотношениях с кальцием (начиная от 1 1). [c.150]Определение меди экстракционным методом. Примерно до 300 мкг меди можно избирательно определить в присутствии железа, алюминия, кобальта, никеля и марганца по следующему экстракционному методу. [c.123]
Отложения с наружной стороны низкотемпературных поверхностей нагрева мазутных парогенераторов, например с пластин регенеративных воздухоподогревателей, с трубок водяных экономайзеров, содержат сернокислые соли железа, никеля, ванадия, меди и свободную серную кислоту. Коррозионные образования в трубках пароперегревателей кроме окислов железа содержат хром, марганец, молибден и другие вещества. Эти материалы отличаются исключительной стойкостью, и обычно их удается перевести в раствор лишь нагреванием в смеси серной и фосфорной кислот. Сплавление с содой, едкими щелочами, пирофосфатом или гексаметафосфатом натрня практически не приводит к разложению этого материала. Отложения из парогенераторов высокого давления содержат в различных соотношениях окислы железа и алюминия, кремниевую кислоту, фосфаты железа, алюминия и кальция, металлическую медь, а иногда соединения цинка и магния. В качестве менее существенных примесей, а иногда и следов в накипи присутствуют марганец, хром, олово, свинец, никель, молибден, титан, вольфрам, стронций, барий, сурьма, бор, ванадий и некоторые другие элементы. При обычном анализе ограничиваются определением фосфатов, кремниевой кислоты, железа, меди, алюминия, натрия, кальция, магния и сульфатов. [c.411]
Сплавление с содой, едкими щелочами, пирофосфатом или гексаметафосфатом натрня практически не приводит к разложению этого материала. Отложения из парогенераторов высокого давления содержат в различных соотношениях окислы железа и алюминия, кремниевую кислоту, фосфаты железа, алюминия и кальция, металлическую медь, а иногда соединения цинка и магния. В качестве менее существенных примесей, а иногда и следов в накипи присутствуют марганец, хром, олово, свинец, никель, молибден, титан, вольфрам, стронций, барий, сурьма, бор, ванадий и некоторые другие элементы. При обычном анализе ограничиваются определением фосфатов, кремниевой кислоты, железа, меди, алюминия, натрия, кальция, магния и сульфатов. [c.411]
Влияние хрома, если его больше 0,02%, аналогично влиянию алюминия. Однако предварительным осаждением гидроокиси хрома из аммиачного раствора в присутствии железа в качестве носителя можно устранить воздействие хрома на результаты анализа. Ионы меди снижают оптическую плотность, но в присутствии цианида калия влияние меди (до 0,03%) не сказывается на результатах анализа. Марганец, никель, ванадий (при содержании каждого из этих злементов до 0,2%) и остаточный титан (до 0,1 %) не мешают определению. Влиянием небольших концентраций гидроокиси натрия можно пренебречь. [c.54]
Определению не мешают свинец, марганец, никель, кобальт, медь, цинк, кадмий, алюминий, щелочноземельные и лантаниды. Мешает определению присутствие железа. Ниже (см. стр. 204) приводится предлагаемый в этом случае ход определения. Мешают хлорид-ионы, если содержание их более чем в 20 раз превышает содержание комплексона. В этом случае рекомендуется проводить титрование с тиомочевиной в качестве индикатора (см. метод Б ). [c.203]
Титан можно осаждать в присутствии железа (II и III), алюминия, цинка, кобальта, никеля, бериллия, хрома (III), марганца (II), кальция, магния, таллия, церия (III), тория, натрия, калия, аммония, а также фосфатов, молибдатов, хроматов, ванадатов, перманганатов, уранила и ванадила. Мешают определению ионы циркония, церия (IV) и олова. Перекись водорода также должна отсутствовать. На осаждение циркония влияют церий (IV), олово, большие количества фосфата, а также титан при отсутствии в растворе перекиси водорода. [c.156]
Мешают определению ионы циркония, церия (IV) и олова. Перекись водорода также должна отсутствовать. На осаждение циркония влияют церий (IV), олово, большие количества фосфата, а также титан при отсутствии в растворе перекиси водорода. [c.156]
Наилучшие варианты бензидинового метода сводятся к осаждению сульфат-ионов солянокислым бензидином в нейтральной или слабокислой среде (pH = 4). Отфильтрованный осадок сернокислого бензидина промывают 5 раз водой, порциями по 3 мл, и титруют при 50° С раствором едкого натра по фенолфталеину Метод применим в присутствии железа (П), меди, кобальта, цинка, никеля, марганца и алюминия. Железо (III) мешает определению. [c.804]
Определению не мешают палладий, ртуть, кадмий, медь, олово, сурьма, алюминий, никель, кобальт, марганец, цинк, барий, кальций, натрий, калий. Железо (1П) образуете реактивом желтый комплекс, поэтому в присутствии железа добавляют фосфорную кислоту. [c.187]
Результаты определения 1 10 ° г алюминия в присутствии 1 10 г железа, никеля, кобальта, хрома, титана, меди приведены в табл. 43. [c.304]
В случае определения никеля в растворе, содержащем железо и алюминий при соотношении их 1 100, осаждение производят в присутствии тартрата натрия — калия. [c.77]
Определение никеля в гарных породах, почвах, животных и растительных организмах. Метод определения никеля в указанных объектах, разработанный Малюгой [198, 199], основан на его отделении от железа, титана, алюминия, марганца и других металлов рубеановодородной кислотой в присутствии лимонной кислоты с [c.135]
Определению не мешают соли кальция, магния и аммония. Присутствие в растворе алюминия, цинка, кадмия, бария и свинца вызывает получение несколько пониженных результатов. Присутствие железа, никеля и меди приводит к получению повышенных результатов. Двухвалентные олово, марганец и железо восстанавливают бихромат и поэтому мешают определению. [c.186]
[c.186]
Особенно выгодно маскирование при помощи триэтаноламина при проведении титрований в присутствии мурексида в качестве металлиндикатора [12]. Триэтаноламиновый комплекс с трехвалентным железом в растворе аммиака окрашен в слабо-желтый цвет, в растворе едкого натра комплексон бесцветен. В таком растворе можно очень точно определить содержание кальция по мурексиду в присутствии большого количества железа, что имеет большое значение при анализах цемента, силикатов и т. п. Можно проводить титрование в присутствии мурексида и в аммиачном растворе, одновременно маскируя железо и алюминий триэтаноламином. Это главным образом относится к определению никеля. Медь таким путем определить нельзя, поскольку она образует с триэтаноламином довольно прочный комплекс. В растворе ед- [c.420]
Определение никеля в присутствии железа и алюминия [12] [c.422]
Хсд определения. К слабокислому анализируемому раствору, свободному от аммонийных солей, прибавляют 10 мл 30%-ного раствора триэтаноламина и 10 жл 1 н. раствора едкого натра. Разбавляют до 100—150 мл и титруют в присутствии мурексида до перехода окраски из красно-оранжевой в фиолетовую. Хотя переход окраски не так резко выражен, как при определении никеля, тем не менее он достаточно четок. Этим способом можно определять также малые количества кальция в присутствии относительно больших количеств железа (50—60 мг). Алюминий определению не мешает, если присутствует в виде алюмината. Окраска комплекса марганца с триэтаноламином не мешает, если содержание марганца в растворе не превышает 5 лгг небольшие количества магния не мешают, так как в присутствии щелочи магний осаждается в виде гидроокиси. [c.422]
Муравьиная кислота — реактив для выделения платины и палладия, для отделения бериллия от алюминия и железа, для разделения вольфрама и молибдена уксусная кислота применяется для определения молекулярной массы веществ, для приготовления буферных растворов, как среда и ацетилирующее средство пропионовая кислота— для определения ароматических аминов антраниловая кислота — для обнаружения и гравиметрического определения кадмия, кобальта, меди, ртути, марганца, никеля, свинца и цинка бензойная кислота служит эталоном в колориметрии 2,4-диокси-бензойная кислота применяется для колориметрического определения железа, титана и других элементов лимонная кислота — в качестве сильного маскирующего комплексообразователя, для приготовления буферных смесей, определения белка в моче, как растворитель фосфатов при анализе удобрений молочная кислота — при полярографическом определении металлов, при электролитическом осаждении меди в присутствии железа, цинка и марганца нафтионовая кислота — для колориметрического определения нитрат иона, в качестве флуоресцирующего индикатора олеиновая кислота — для определения малых количеств кальция и магния, в титриметрическом анализе для определения жесткости воды пировиноградная кислота — для идентификации первичных и вторичных аминов, в микробиологии стеариновая кислота — для нефелометрического определения кальция, магния и лития сульфо-салициловая кислота — для колориметрического определения железа, в качестве комплексообразователя, для осаждения и нефелометрического определения белков трихлоруксусная кислота — как реактив на пигменты желчи и фиксатор в микроскопических исследованиях.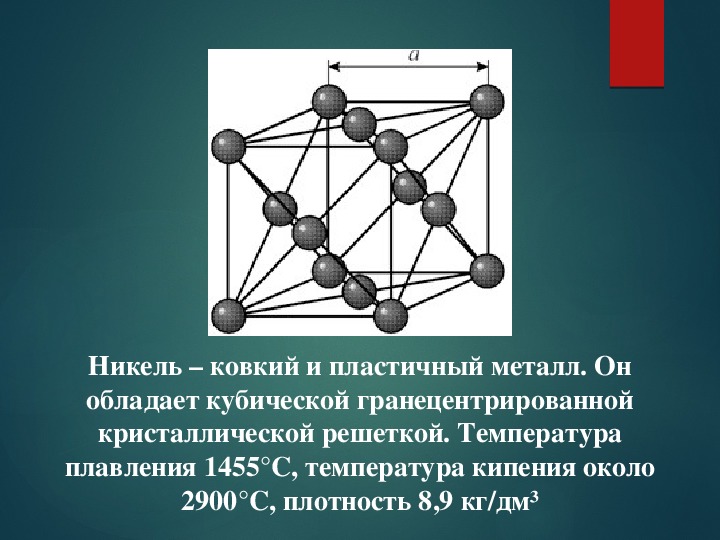 [c.44]
[c.44]
Измерения интенсивности люминесценции производят в прямоугольных кюветах емкостью 25 мл на флуориметре. Установку прибора на О производят по раствору, не содержащему хлорида алюминия и ионов фтора, на 100 — по раствору, не содержащему ионов фтора. Возможны измерения при содержании в 50 мл раствора от 0,2 до 100 мкг иона фтора. Ошибка колеблется в пределах 0,2—20% (в зависимости от содержания фтора в пробе). Мешают определению ионы хрома, железа, никеля, кобальта, бериллия, циркония, тория, кремния и фосфора. В их присутствии необходимо предварительно отогнать фтор в виде кремнефтористоводородной кислоты. [c.343]
Смешанные окислы осаждают из фильтрата после определения кремнезема добавлением аммиака к горячему раствору до щелочной реакции по индикатору метиловому красному или бромкрезоловому пурпуровому, т. е. при pH около 7. Железо, алюминий, фосфор, цирконий, ванадий и хром осаждаются вместе, одновременно с другими элементами, присутствующими лишь в подчиненных или следовых количествах, а именно бериллием, галлием, индием, торием, скандием и редкоземельными элементами. Очень малые количества никеля, кобальта и цинка, [c.45]
Определение по разности. В классическом методе определения алюминия в силикатных породах железо, алюминий и другие элементы группы аммония осаждают вместе и взвешивают в виде смешанных окислов . Присутствующие в этом осадке элементы, кроме алюминия, определяют отдельно, а содержание алюминия рассчитывают ио разности. Этот метод детально описан в гл. 4. Он включает точное определение железа, титана, ванадия, хрома, фосфатов и той части марганца (а также никеля, если он присутствует в количествах больших, чем следовые), которая осаждается с элементами группы аммония. [c.94]
Кинетический метод определения железа в солях основан на индикаторной реакции окисления стильбексона перекисью водорода. Определение 0,01—0,1 мкг железа в 5 мл раствора возможно в присутствии 10 —10 -кратных количеств ионов кобальта, хрома, никеля, марганца, меди, цинка, бериллия, щелочноземельных металлов и других. При концентрации солей щелочных металлов до 0,5 г в 5 мл и алюминия до 0,05 г в 5 мл раствора реакция несколько замедляется, однако определение железа можно проводить методом добавок, вводимых в анализируемые и холостые растворы. С применением реактивов и растворов указанной чистоты определяемый минимум составляет 0,005 мкг железа в 5 мл раствора. Метод добавок имеет то преимущество, что не требует приготовления эталонных растворов (т. е. растворов для построения калибровочного графика) и дает возможность выполнять определения в присутствии примесей, влияющих на скорость реакции. Сущность метода добавок [1, 2] заключается в том, что измеряют скорость индикаторной реакции в равных аликвотных частях анализируемого и холостого растворов с добавками определяемого иона и без них. При графическом определении концентрации иона по оси ординат откладывают соответствующую функцию ф измеряемого свойства, пропорциональную концентрации катализатора при постоянстве прочих условий , [c.39]
При концентрации солей щелочных металлов до 0,5 г в 5 мл и алюминия до 0,05 г в 5 мл раствора реакция несколько замедляется, однако определение железа можно проводить методом добавок, вводимых в анализируемые и холостые растворы. С применением реактивов и растворов указанной чистоты определяемый минимум составляет 0,005 мкг железа в 5 мл раствора. Метод добавок имеет то преимущество, что не требует приготовления эталонных растворов (т. е. растворов для построения калибровочного графика) и дает возможность выполнять определения в присутствии примесей, влияющих на скорость реакции. Сущность метода добавок [1, 2] заключается в том, что измеряют скорость индикаторной реакции в равных аликвотных частях анализируемого и холостого растворов с добавками определяемого иона и без них. При графическом определении концентрации иона по оси ординат откладывают соответствующую функцию ф измеряемого свойства, пропорциональную концентрации катализатора при постоянстве прочих условий , [c.39]
В работах [126] приводится комплексометрическое определение кальция, стронция и бария ) как отдельно, так и в присутствии магния в сильно щелочном растворе с помощью флуоресцентного комплексометрического индикатора бис [К, К-ди-(карбоксиметил) аминометил]-флуорес-цеина, названного авторами флуорексоном . Это соединение может быть применено также для флуоресцентного определения следов указанных металлов. В последнем случае можно количественно определять кальций при его содержании свыше 80у V. мл раствора, или же соответствующее количество стронция или бария. Титрование кальция, стронция или бария удается проводить в присутствии меди, цинка, кадмия, кобальта или никеля после добавления в титруемый раствор цианистого калия, а в присутствии железа, алюминия или марганца—после добавления триэта-ноламина. [c.168]
Это определение было одновременно исследовано несколькими авторами. Согласно Фрицу и Форду [130], торий можно непосредственно титровать комплексонсм, если pH испытуемого раствора поддерживать в интервалах 2,3—3,4. Наиболее четкий переход окраски индикатора наблюдается при pH 2,8. В более кислых растворах (pH ниже 2,1) окраска раствора тория с индикатором слабее, в более щелочных растворах (pH выше 3,5) происходит гидролиз соли тория. Поэтому авторы рекомендуют следующий ход определения к 100 мл раствора, содержаи],его 120—240 мг тория, прибавляют 4 капли 0,05%-ного водного раствора индикатора и добавлением аммиака уменьшают кислотность анализируемого раствора до появления розовой окраски (pH 2,5). Титруют 0,025 М раствором комплексона почти до исчезновения окраски раствора. Затем pH раствора доводят до 3 (при потенциометрическом контроле) и дотитровывают раствором комплексона. Полученный раствор имеет чисто желтый цвет. Целесообразно проводить перемешивание при помощи электромагнитной мешалки. Аналогичным способом определяют и меньшие количества тория (6—50 мг в 25 мл раствора). Определению мешает присутствие железа, висмута, циркония, церия, олова, ванадия, свинца, меди и никеля. Как отмечают авторы, комплексометрическое определение тория приобрело большое значение вследствие возможности удовлетворительного отделения тория от мешающих элементов экстракцией его окисью мезитила (метод разработан Левеном и Гримальди [131]). Экстракцию проводят следующим образом к 1,2 Ж раствору соли тория прибавляют на каждые 10 мл 19 г нитрата алюминия в качестве высаливающего агента и одной экстракцией окисью мезитила отделяют торий от редкоземельных катионов, фторидов и фосфатов. Вместе с торием извлекаются ванадий, уран, цирконий и небольшое количество алюминия. Титрованию тория раствором комплексона не мешают алюминий и уран перед экстракцией тория следует предварительно отделить цирконий и ванадий. [c.363]
Наиболее четкий переход окраски индикатора наблюдается при pH 2,8. В более кислых растворах (pH ниже 2,1) окраска раствора тория с индикатором слабее, в более щелочных растворах (pH выше 3,5) происходит гидролиз соли тория. Поэтому авторы рекомендуют следующий ход определения к 100 мл раствора, содержаи],его 120—240 мг тория, прибавляют 4 капли 0,05%-ного водного раствора индикатора и добавлением аммиака уменьшают кислотность анализируемого раствора до появления розовой окраски (pH 2,5). Титруют 0,025 М раствором комплексона почти до исчезновения окраски раствора. Затем pH раствора доводят до 3 (при потенциометрическом контроле) и дотитровывают раствором комплексона. Полученный раствор имеет чисто желтый цвет. Целесообразно проводить перемешивание при помощи электромагнитной мешалки. Аналогичным способом определяют и меньшие количества тория (6—50 мг в 25 мл раствора). Определению мешает присутствие железа, висмута, циркония, церия, олова, ванадия, свинца, меди и никеля. Как отмечают авторы, комплексометрическое определение тория приобрело большое значение вследствие возможности удовлетворительного отделения тория от мешающих элементов экстракцией его окисью мезитила (метод разработан Левеном и Гримальди [131]). Экстракцию проводят следующим образом к 1,2 Ж раствору соли тория прибавляют на каждые 10 мл 19 г нитрата алюминия в качестве высаливающего агента и одной экстракцией окисью мезитила отделяют торий от редкоземельных катионов, фторидов и фосфатов. Вместе с торием извлекаются ванадий, уран, цирконий и небольшое количество алюминия. Титрованию тория раствором комплексона не мешают алюминий и уран перед экстракцией тория следует предварительно отделить цирконий и ванадий. [c.363]
Следует иметь в виду, что кобальт тоже реагирует с диметилглиоксимом, и если он присутствует в количествах ббльших, чем 5% от количества никеля, то его нужно предварительно удалить, так как применение комплексообразователей, например цианида или пирофосфата, не дает удовлетворительных результатов . Железо (III), алюминий и хром (III) не мешают, если их немного, но если они начинают выпадать в аммиачной среде, то могут адсорбировать никель. Поэтому Г. А. Бутенко, Г. Е. Беклешова и Е. А. Со-рочинский и рекомендуют связывать железо (III) во фторидный комплекс алюминий также связывается фторидом и выпадает в осадок, а хром (П1) дает достаточно устойчивый растворимый комплекс, не мешающий определению никеля. Другие катионы, например цинк и кадмий, восстанавливаются при указанном выше потенциале, следовательно, все титрование будет проходить при большом начальном токе. Если содержание этих металлов не очень высоко (не выше 1%, по данным Кольтгофа и Лангера ), то они не мешают определению никеля. Катионы меди очень мешают, перед титрованием ее необходимо удалять. [c.272]
Железо (III), алюминий и хром (III) не мешают, если их немного, но если они начинают выпадать в аммиачной среде, то могут адсорбировать никель. Поэтому Г. А. Бутенко, Г. Е. Беклешова и Е. А. Со-рочинский и рекомендуют связывать железо (III) во фторидный комплекс алюминий также связывается фторидом и выпадает в осадок, а хром (П1) дает достаточно устойчивый растворимый комплекс, не мешающий определению никеля. Другие катионы, например цинк и кадмий, восстанавливаются при указанном выше потенциале, следовательно, все титрование будет проходить при большом начальном токе. Если содержание этих металлов не очень высоко (не выше 1%, по данным Кольтгофа и Лангера ), то они не мешают определению никеля. Катионы меди очень мешают, перед титрованием ее необходимо удалять. [c.272]
Некоторые органические реактивы применяют в гравиметрическом анализе в качестве маскирующих реагентов. Это применение основано на образовании растворимых комплексных соединений. Так, в пр1исутствии винной кислоты ионы Ре + и АР+ при действии раствора аммиака не образуют осадков Ре (ОН) а и А1(0Н)з. Это свойство винной кислоты используется при определении никеля 1В присутствии железа или алюминия по реакции с диметилглиоксимом. [c.86]
Конкурирующие реакции удобно исследовать измерениями поглощения с помощью или вспомогательной центральной группы S (гл. 4, разд. 3), или вспомогательного лиганда 21 (гл. 4, разд. 4). Интерпретация упрощается, если ни одна из исследуемых форм ВА (кроме формы 23А или В1 , содержащей вспомогательные центральную группу или лиганд) заметно не поглощает при данной длине волны. В частности, в качестве вспомогательной центральной группы удобно применять железо, так как его комплексы часто поглощают при более длинных волнах, чем комплексы других ионов металлов. Например, спектрофотометрическое определение з для системы о-фенантролин— железо(II) дало информацию о комплексах о-фенантролин—цинк [91], и Ирвинг и Меллор [78] использовали ту же систему для изучения комплексов цинка, никеля, кобальта и меди с фенантролином с помощью метода соответственных растворов [22]. Подобно этому, Бабко и Рычкова [11] вычислили константу устойчивости первого комплекса салицилата алюминия из измерений ai для системы салицилата железа(III) в присутствии ионов алюминия. Были использованы растворы с такой низкой концентрацией свободного лиганда, чтобы образовался только первый комплекс салицилата железа (III). [c.341]
Подобно этому, Бабко и Рычкова [11] вычислили константу устойчивости первого комплекса салицилата алюминия из измерений ai для системы салицилата железа(III) в присутствии ионов алюминия. Были использованы растворы с такой низкой концентрацией свободного лиганда, чтобы образовался только первый комплекс салицилата железа (III). [c.341]
При добавлении пиридина к слабокислому анализируемому раствору в нем, создается pH, приблизительно равный 6,5. В этих условиях осаждаются железо (III), алюминий, хром, уран, индий, галлий, титан,, цирконий, тОрий и скандий. В то же время марганец, кобальт, никель и цинк (а также и металлй сероводородной группы — медь и кадмий) образуют с пиридином ко мплексные ионы состава Me( 5HgN)2 , остающиеся в растворе. Для создания в растворе указанного значения pH при определении металлов, присутствующих в обычных аналитических концентрациях, требуется добавление пиридина в избытке около 8 эквивалентов. [c.111]
Установлено , что цирконий количественно осаждается также фтале-вон кислотой из раствора в 0,3 н. соляной кислоте. В этом случае однократным осаждением цирконий отделяют от большинства элементов, ъ частности от тория, железа, алюминия, бериллия, урана, марганца, никеля и редкоземельных металлов цериевой группы. В присутствии олова, титана, ванадия и хрома требуется двукратное осаждение. Основанный на этой реакции метод определения циркония заключается в следуюш,ем. К раствору хлорида циркония прибавляют 30 мл насыщенного раствора нитрата аммония, а затем вводят достаточное количество 2 н. соляной кислоты, чтобы при последующих операциях после разбавления раствора до 200 мл концентрация соляной кислоты в нем была 0,3 н. Разбавляют до 100 мл, нагревают до кипения и, непрерывно перемешивая, вводят 100 мл кипящего 4%-ного раствора фталевой кислоты. Осторожно кипятят [c.647]
Медь, цинк, олово, свинец, а также большинство других составляющих, присутствующих в небольших количествах в сплавах цветных металлов, определяют атомно-абсорбционным методом, хотя результаты публикуются довольно редко. Сплавы на основе меди анализировали на содержание цинка [53], свинца [319] и марганца [31]. Саттур [160] определял в таких сплавах марганец, никель и железо, а кроме того медь, присутствующую в качестве основного элемента в различных материалах NBS, и незначительные примеси меди в олове, цинке, алюминии и свинце. Погрешность при определении основного элемента методом атомной абсорбции составляла всего 0,7% от общего количества меди. [c.179]
Комплексоно-фосфатный метод отделения урана при его определении в минералах. Переведение урана в раствор осуществляется обработкой навески минерала нагреванием с соляной кислотой и перекисью водорода и последующим выпариванием со смесью серной и азотной кислот. Метод основан на выделении урана в виде фосфата уранила с применением в качестве сооса-дителя соли титана в присутствии комплексона III (натриевая соль ЭДТА) для удержания в растворе других элементов (железа, алюминия, хрома, меди, никеля, лантанидов, ванадия, молибдена и т. д.). Осадок переводится в раствор в виде комплексной соли раствором карбоната натрия. [c.318]
Относительная ошибка не более 2%. Хром не мешает определению никеля. Анализируемый образец, содержащий медь, следует растворять в Нг504 (1 4) и добавлять затем по каплям 4%-ный раствор КМПО4. Если выпадает двуокись марганца, прибавляют по каплям 0,5%-ный раствор соли Мора до просветления раствора. Затем приливают горячую воду, опускают в раствор несколько кусочков металлического алюминия или железа и нагревают 10 мин. После этого фильтруют раствор, осадок промывают 5 раз горячей водой и раствор титруют при потенциале— 1,85 в. Можно титровать никель в присутствии диметилдиоксима иодом [1159]. [c.94]
Из других диоксимов для амперометрического определения никеля применяется диоксим циклогександиона [254, 527, 781]. Сам реагент восстанавливается на ртутном капельном электроде на фоне 0,Ш ацетата натрия (Е = —1,40 в) [781]. Японские ученые используют фон 0,25 М ЫН4С1 + 0,2 М 1УН40Н при потенциале 1,8 в (pH 8,8) [781]. Преимущество этого реагента перед диметилдиоксимом заключается в том, что им можно титровать в аммиачной среде (следовательно, не мешает цинк), в тартратной и цитратной среде, что позволяет определять никель в присутствии 60—70-кратных количеств железа и алюминия. [c.94]
Для определения никеля применяют двунатриевую соль этилендиаминтетрауксусной кислоты. Оптическую плотность растворов никеля измеряют при X = 1000 ммк [4951. Соединения большинства металлов с комплексоном III не поглощают лучистой энергии в этой области. Таким образом, никель можно определять в присутствии алюминия, бериллия, кальция, кадмия, хрома, железа (III), ртути, марганца, свинца, стронция, тория и циркония. Только кобальт, медь и железо (II) мешают определению (их отделяют хроматографически на амберлите IRA-400). [c.131]
Применение 3,3 -диметилнафтидина в комплексометрии Флашка и Франшиц [112] распространили на косвенное определение некоторых других катионов. Анализ проводят следующим образом. К слабокислому раствору, содержащему определяемый катион, прибавляют в небольшом избытке раствор комплексона и оттитровывают этот избыток 0,1 М раствором хлорида цинка, используя приведенную выше окислительно-восстановительную систему индикатора. Указанным способом можно определить в присутствии цинка медь, никель, кадмий, свинец, железо, алюминий и сумму алюминия и железа. Для ознакомления читателя с указанными определениями ниже приводится один из методов Флашки. [c.352]
Прямые реакции с иодом. Стандартный раствор иода, который является слабым окислителем, можно применять для титрования сильных восстановителей. Широкие возможности его применения можно проиллюстрировать кратким перечислением некоторых примеров титрование As в гидрокарбонатном растворе в присутствии крахмала в качестве индикатора определение олова после восстановления его до Sn свинцом, сурьмой, алюминием, никелем или железом определение таллия (III) после восстановления его до таллия (I) определение сульфидов либо прямым титрованием раствором иода, либо косвенным способом, основанным на добавлении избытка иода и последующем обратном титровании определение тиоацетамида титрованием иодом как основа микроопределения ионов тяжелых металлов определение сульфитов обратным титрованием раздельное определение гипофосфита и фосфита в одной пробе титрованием при двух различных значениях pH определение цианидов по количественной реакции с иодом в щелочной среде определение титрованием иодом ряда органических соединений [78], например, полифенолов, аскорбиновой кислоты, меркаптанов, мочевой кислоты, гидразинов, фенолов, дитиогликолевой кислоты, металлорганических меркаптидов, алкильных соединений алюминия и др. Йодные числа применяют в качестве меры нена-сыщенности жиров и масел. Подробное описание многих методов анализа с использованием иода можно найти в руководстве Кольтгофа и Белчера [1]. [c.399]
Определению железа в присутствии ЭДТА не мешают барий, титан, алюминий, висмут, никель, марганец и кадмий. Определению никеля в присутствии тартрата калия-натрия не мешают железо и цинк. [c.61]
Подтверждением увеличения интенсивности линий всех изучаемых элементов в присутствии магнитного поля с носителем служат сравнительные градуировочные графики определения ряда примесей, полученные при съемке стандартов в магнитом поле и без него при одних и тех же условиях. Из рис. 7 видно, что чувствительность определения магния, хрома и алюминия, а также и других изученных в работе элементов (марганец, никель, кальций, железо) увеличивается на 0,5—1 порядок. При этом относительное стапдартпое от1 лоненпе метода тонкого слоя при паложепип магнитного поля улучшается и находится в пределах 0,1—0,12. [c.134]
Разработаны методы колориметрического определения бора и без отделения мешающих компонентов. Так, рекомендован метод определения бора в железе и низколегированных сталях в присутствии никеля (до 10 мг), марганца, меди, хрома, кобальта (до 2 мг), алюминия, ванадия, титана, молибдена,-циркония (до 1 мг), олова В..мышьяка (до Q.J лг). Железр в эхом случае восста.-. [c.49]
Проведенные исследования показали, что для колориметрического определения любых концентраций кремния наиболее пригодна кислотность 0,02—2 н. при этом следует и-збегать кипения раствора и, вообще, длительного нагревания. Растворение навески лучше проводить пр И комнатной температуре в азотной кислоте [116]. Чувствительность определения кремния в 50 мл- по желтому комплексу 0,025 мг, по синему — 0,005 мг [74]. В качестве восстановителей можно применять двухлористое олово [74, 121—124], соль Мора 50, 125—132], аскорбиновую кислоту [124, 131], тиомочевину [116, 133], 1-амино-2-наф-тол-4-сульфокислоту [134] и др. Присутствующие в боре примеси железа, алюминия, никеля определению кремния в виде желтого и синего комплексов не мешают . [c.155]
Как определяют содержание кристаллизационной воды в кристаллическом хлориде бария 2. На какой химической реакции основано определение содержания бария в хлориде бария 3. Почему при осансульфата бария в раствор добавляют соляную кислоту 4. Как проверяют полноту осаждения ионов бария 5. При какой температуре прокаливают осадок сульфата бария Почему нельзя прокаливать его при более высокой температуре 6. Почему осаждение ионов алюминия ведут в присутствии избытка 8-оксихинолина 7. Какое соединение является в этом анализе осаждаемой формой 8. В какое соединение превращается оксихинолят алюминия при прокаливании 9. Как проводят определение железа в стальной проволоке 10. Какие составные части стальной проволоки не растворяются в соляной кислоте 11. Как проводят определение никеля в виде диметилглиоксимата 12. Какая химическая реакция лежит в основе этого анализа [c.112]
Определению магния с феназо мешают железо, алюминий, медь, цинк, никель, марганец, титан. Присутствие растворимых карбонатов и силикатов оказывает незначительное влияние, что позволяет определить магний в карбонатсодержащих природных водах, а также применять реактив при анализе многих сплавов, требующих для своего растворения едкий натр, которой может содержать примеси карбонатов или силикатов. [c.35]
Реактив осаждает титан из минеральвокислых растворов (0,6 н. по соляной кислоте или 1,8 н. по серной кислоте). Определению титана не мешают алюминий, цинк, кобальт, никель, бериллий, хром (Ш), марганец, таллий, церий (Ш), торий, фосфаты, молибдаты, хроматы, ванадаты, уранил. Мешают определению цирконий, церий (1У), олово. Железо не мешает в присутствии роданида. [c.32]
История монет из никеля и медно-никелевых сплавов
Знакомство с никелевой рудой началось с разочарования. Немецким горнякам она попадалась задолго до того, как никель в качестве самостоятельного металла открыл в 1751 году шведский учёный Аксель Кронстедт. Внешне руда напоминала медную, однако все попытки получить из неё медь претерпевали неудачу, за что она получила обидное прозвище «Купферникель», самый мягкий перевод которого означает «чёртова медь» или «медный озорник». Знали бы металлурги тех лет, какой востребованный и ценный металл вызывает у них такую досаду!
Уже будучи идентифицированным как отдельный металл, никель поначалу добывался в довольно скромных объёмах. Однако уже во второй половине XIX века, когда люди изучили его химические и физические свойства и в полной мере оценили полезные качества, его востребованность сильно возросла, а объёмы добычи начали неуклонно увеличиваться.
На сегодняшний день лидерами по добыче никеля являются Индонезия, Канада, Россия, Куба, ЮАР, Греция, Украина. В России именем этого металла даже назван город, в котором происходит добыча никеля.
В наше время никель используют как компонент для многочисленных сплавов, в качестве покрытия изделий, в химической отрасли, при производстве аккумуляторов, в медицине.
Широко никель используется и в финансовой сфере – в производстве монет.
История монет из никеля
Для чеканки никель в основном используется в составе сплавов или покрытия, нанесённого с помощью гальваники: медно-никелевый сплав, мельхиор, нейзильбер, никелевая бронза, нержавеющая сталь, никелево-железный и никелево-цинковый сплавы. Однако никель используется для производства монет и в чистом виде.
Впервые сплав меди и никеля при производстве монет применила Швейцария в середине XIX века. Монеты же из чистого никеля первой произвела Австро-Венгрия в конце XIX века.
В XX веке производство монет из сплавов с никелем широко распространяется по всему миру. В Российской Империи в монетном деле также планировалось использование этого металла. Проекты по чеканке монет из никеля в России рассматривались ещё в XIX веке, всерьёз же об этом задумались в 1911 году, однако начавшаяся через 3 года Первая мировая война не позволила претворить эту идею в жизнь. Первые отечественные монеты с использованием никеля отчеканены уже в Советском Союзе.
Многие монеты, именуемые никелевыми, по факту же являются монетами, отчеканенными из сплавов с содержанием никеля. Так, к примеру, пятицентовые монеты США, которые имеют обиходное название «nickel» (никель), на самом деле производятся из медно-никелевого сплава, в котором меди содержится 75%, а никеля — всего 25%. Его свойства даже при ещё меньшей пропорции позволяют «замаскировать» цвет меди и заставить монеты сиять как серебро.
Интересным является факт, что никель, который внедряли в производство денег ради экономии драгоценных металлов, во время Второй мировой войны стал в некоторых странах более востребованным и дефицитным металлом, чем серебро. В 1942 году в США, описанные выше монеты стали производить из сплава меди, марганца и серебра – и всё ради экономии никеля, который использовался для военных нужд, в частности для производства брони.
Монеты из никелевых сплавов долговечны, хорошо сохраняют внешний вид, мало или совсем не подвержены окислению, не требуют тщательного ухода.
Монеты из чистого никеля встречаются в нумизматике сравнительно нечасто. Чаще всего никель является составной частью сплава, из которых изготавливаются монеты. Приведём несколько примеров монет, изготовленных из чистого никеля.
Примеры никелевых монет
Одной из первых никелевых монет стала монета номиналом 10 геллеров, изготовленная в Австро-Венгрии в период правления Франца Иосифа I. Геллер – это разменная монета, равная 1/100 кроны. На фото монета, выпущенная в 1895 году.
10 геллеров, Австро-Венгрия, 1895 год
10 геллеров, Австро-Венгрия, 1895 год
На одной стороне монеты изображён двуглавый орёл – герб Австро-Венгерской Империи. На другой указан номинал и год выпуска. Монета имеет рубчатый гурт, вес 3 г, диаметр 18,9 мм и толщину 1,25 мм.
В 1951 году Канада, являющаяся одной из ведущих стран мира по добыче никеля, в честь 200-летия открытия этого металла выпустила никелевые 5 центов.
5 центов, Канада, в честь 200-летия производства никеля, 1951 год
5 центов, Канада, в честь 200-летия производства никеля, 1951 год
На реверсе монеты изображено здание литейного завода, написано наименование страны, указан номинал, даты «1751-1951», означающие 200-летний юбилей использования этого металла. Под зданием завода – изображение трёх кленовых листьев – символов Канады. На аверсе – профиль короля Великобритании Георга VI и надпись на латыни «GEORGIVS VI DEI GRATIA REX» («Георг VI милостью божьей монарх»). Монета имеет гладкий гурт, вес 4,54 г, диаметр 21,2 мм и толщину 1,7 мм
500 филсов, выпущенные в 1973 Ираком в честь годовщины национализации нефтяной промышленности страны. Национализация этой отрасли в Ираке произошла в 1972 году.
500 филсов, Ирак, годовщина национализации нефтяной промышленности, 1973 год
500 филсов, Ирак, годовщина национализации нефтяной промышленности, 1973 год
На одной стороне монеты вдоль окружности размещены надписи на арабском языке о годовщине события, наименование страны, год выпуска монеты. В центре указан номинал монеты. На другой стороне – изображение части нефтедобывающей системы — цистерна и трубы, и год выпуска монеты. Монета имеет вес 22,9 г и диаметр 36 мм.
В 1980 году, в год коронации новой королевы Нидерландов Беатрикс, был выпущен никелевый гульден.
1 гульден, Нидерланды, коронация Беатрикс, 1980 год
1 гульден, Нидерланды, коронация Беатрикс, 1980 год
На аверсе монеты размещены профили королевы Беатрикс и предыдущего монарха этой страны, матери Беатрикс – Юлианы, которая отреклась от престола в пользу дочери. Вдоль окружности надпись на голландском языке «BEATRIX KONINGIN DER NEDERLANDEN», которая переводится как «Беатрикс королева Нидерландов», и дата коронации – 30 апреля 1980 года. На реверсе – герб Нидерландов, наименование страны, номинал и год выпуска. Монета имеет гурт с надписью «GOD ZIJ MET ONS» («Да прибудет с нами Бог»). Вес монеты 6,5 г, диаметр 25 мм и толщина 1,8 мм.
Монета из никеля, выпущенная ЮАР в 1988 году. На фото 1 ранд – национальная валюта ЮАР с 1961 года, когда, выйдя из Британского содружества, эта страна отказалась от прежней валюты – южноафриканского фунта.
1 ранд, ЮАР, 1988 год
1 ранд, ЮАР, 1988 год
На одной стороне размещено изображение антилопы и надпись на латыни «SOLI DEO GLORIA» — фраза, означающая одну из 5 основ протестантского богословия. В переводе эта фраза означает «только Богу слава». На другой стороне – герб ЮАР того периода, наименование страны на двух языках (английском и африкаанс) и год выпуска. Монета имеет рубчатый гурт, вес 12 г при диаметре 31 мм и толщине 2,2 мм.
В честь 200-летия со дня образования Первой республики в 1992 году Франция чеканит никелевый франк.
Никелевая монета 1 франк, Франция, в честь 200-летия Первой республики, 1992 год
Никелевая монета 1 франк, Франция, в честь 200-летия Первой республики, 1992 год
В центре одной стороны указан номинал в обрамлении лавровых ветвей. Вдоль канта надпись «LIBERTE EGALITE FRATERNITE» — революционный девиз, в переводе означающий «свобода, равенство, братство», и год выпуска. На обороте размещён символ французской революции – молодая девушка Марианна с фригийским колпаком на голове, а также наименование эмитента. Монета имеет рубчатый гурт, вес 6 г, диаметр 24 мм и толщину 1,8 мм.
Аргентина в 2002 году в память о 50-летии со дня смерти Эвы Перон (жены президента Хуана Перона) выпустила 2 песо. Эва Перон стала легендарной личностью, благодаря своей яркой политической деятельности, которую она начала вести, выйдя замуж. Личность Эвы Перон или «Эвиты», как ещё её называют, до сих пор остаётся популярной в Южной Америке.
Никелевая монета 2 песо, Аргентина, 50-летие со дня смерти Эвы Перон, 2002 год
Никелевая монета 2 песо, Аргентина, 50-летие со дня смерти Эвы Перон, 2002 год
На одной стороне размещён профиль Эвы Перон, вдоль окружности наименование страны на испанском языке и полное имя Эвиты — Мария Эва Дуарте де Перон. На другой стороне – демонстрация с транспарантом, на котором написано «Эвита», указан номинал и даты «1952-2002», означающие 50-летие со дня смерти Эвы Перон. Гурт монеты – рубчатый, её вес — 10,4 г, диаметр — 30 мм и толщина — 2 мм.
Никелевая монета Ливана номиналом 50 ливров выпущена в 2006 году.
Никелевая монета 50 ливров, Ливан, 2006 год
Никелевая монета 50 ливров, Ливан, 2006 год
На одной стороне изображён небольшой парусник – фелука, год выпуска монеты, её номинал и указание эмитента. Тип корабля «фелука» был широко распространён в Средиземноморье из-за универсальности применения: его любили и рыбаки, и перевозчики грузов, и военные, и пираты. Быстроходное, лёгкое, сравнительно простое в управлении судно. На другой стороне монеты на арабском языке продублирован номинал, наименование эмитента и год выпуска, а также размещено изображение ливанского кедра, являющегося национальным символом страны. Монета имеет гладкий гурт, вес 3 г, диаметр 21,5 мм и толщину 1,4 мм.
Автор статьи – Михаил Колесов
Идентификация металлолома
Этот материал поможет устранить путаницу в знаниях от том, как идентифицировать различные типы металлов! Во-первых, всегда имейте под рукой магнит. Лучше иметь несколько магнитов. Микроволновые печи, колонки, жесткие диски и другие электронные устройства, в каждом из них есть магнит, который можно вытащить. Другой отличный способ идентификации металла – тест на искру.
С помощью магнита вы сможете определить и рассортировать черные и цветные металлы.
Железо / сталь
- В 3 раза тяжелее алюминия
- Ржавеет
- Обладает магнитными свойствами
- Его много
- Прочное
Алюминий
- Светлый
- Не обладает магнитными свойствами
- Не отбрасывает искр от шлифовальной машины
- Не ржавеет
Медь
- В основном используется в проводке и электронике
- Из нее делают большие предметы посуды
- Когда медь чистая, она имеет красивый розовый цвет
- Когда потускнеет, как правило, красного или коричневого цвета. (Тоже красиво)
- Окисляясь, становится зеленой
- Плотнее, чем железо, примерно на 15%
- Чем ярче медь, тем она ценнее
- Медь № 1 чистая медь, в том числе трубы без паяных соединений
- Медь № 2 медь с паяными соединениями
Медный лом: двигатели, трансформаторы, дроссели, некоторые процессоры и так далее.
Латунь или бронза
- Обычно желтоватого цвета и стоит около половины стоимости меди № 1
- Можно назвать латунь или бронзу, «медный сплав», чтобы избежать путаницы
- Часто встречается в виде клапанов труб, украшений
- Может быть, легированной никелем, и в этом случае она называется «мельхиор» (см. ниже)
Классы медной проволоки
Есть много разных способов классификации медной проволоки, но все сводится к процентному содержанию меди.
- 85% Проволока: диаметром как у карандаша. Если у вас есть этот тип провода, Вы получите за нее максимальную цену
- 70% Проволока: провода без каких-либо изоляций
- 50% Проволока: Удлинители и шнуры приборов с удаленной изоляцией
- 30% Проволока: Тонкие проволочки в пучке с изоляцией
Как определить свинец
- В полтора раза плотнее, чем железо, на ощупь тяжелый
- Это атомный элемент 82 с химическим символом Pb, очень податливый, или мягкий, и может быть разрезан карманным ножом
- Плавится при низкой температуре
- Используется для изготовления пуль, и рентгеновских аппаратов
- Очень токсичен
Как определить 304 нержавеющую сталь
- 304 нержавеющая сталь является сплавом железа с 18% хрома 8% никеля
- Не обладает магнитными свойствами
- Используйте тест на искру
Как определить 316 нержавеющую сталь
- Не обладает магнитными свойствами
- Это сплав железа с 18% хрома и 10% никеля
- Выглядит точно так же, как и 304
- При использовании теста на искру, будет меньше «вилок» в конце потока
- Используйте переносной спектрометр для точного определения
Как определить 200 нержавеющую сталь
- Это сплав железа с 17% хрома, 4% никеля и 7% марганца
- Гораздо более устойчив к коррозии, что 300 класс
- Не обладает магнитными свойствами
- Труднее продать скупщикам металлолома, потому 200 сталь трудно накопить достаточно, чтобы найти покупателя
Как определить 400 нержавеющую сталь
- Это сплав железа с 11% хрома и ~ 1% марганца
- Не имеет никеля в составе, и, следовательно, обладает магнитными свойствами
- Из-за магнитных свойств многие скупщики не дадут большую цену за нее
Как определить мельхиор
- Это сплав медь/никель
- Стоит гораздо больше, чем медь 1
- Некоторые будут обманывать, и пытаться купить этот материал по цене меди или дешевле
- На самом деле, в мельхиоре от 30%, до 90% никеля, а он в 3 раза дороже, чем медь
- Часто используется в поддельных драгоценностях, посеребренной посуде, судовых запчастях, теплообменниках и конденсаторах, музыкальных инструментах и многом другом
Придется обойти много скупщиков лома, прежде вам дадут за мельхиор справедливую цену.
Электрические нагревательные элементы
- Нагревательные элементы из электрических плит, как правило, сделаны из никеля
- Используйте переносной спектрометр для точного определения цены
Как определить карбид (карбид вольфрама)
- Карбид это сокращение «карбид вольфрама»
- Он тяжелый, в 16 раз тяжелее воды!
- Две столовые ложки карбида весят более килограмма!
- Обычно встречается в виде наконечников фрез, пил
- При тесте на искру дает очень короткие, тусклые, темно-красные искры
- Очень прочный
Устойчивые к коррозии материалы | Руководство по выбору материалов
Связаться с экспертом Доступ к экспертным сервисам
Нержавеющая сталь 316
Нержавеющая сталь
Во всех марках нержавеющей стали главными компонентами, отвечающими за коррозионную стойкость и пластичность металла, являются хром и никель. Добавление > 10 % хрома делает сталь нержавеющей, создавая на поверхности слой, содержащий большое количество оксида хрома. Этот слой образуется в результате реакции содержащегося в сплаве хрома с кислородом из атмосферного воздуха. Он придает стали свойство, которое делает ее нержавеющей. Добавление никеля обеспечивает хорошую пластичность и улучшенные свойства формовки и сварки.
Однако не все прутковые заготовки одинаковы. Содержание никеля и хрома в трубных обжимных фитингах и инструментальных кранах Swagelok из нержавеющей стали 316/316L превышает минимальные требования стандартов ASTM для прутков и поковок.
Следует учитывать, что хотя нержавеющая сталь разных марок и не подвержена сплошной коррозии, на ней может возникать местная коррозия.
Для борьбы со:
сплошной коррозией; водородным охрупчиванием; межкристаллитной коррозией;
Материал имеет значение
Опасность коррозионного растрескивания под напряжением возрастает при высоких значениях концентрации хлоридов, температуры и растягивающих напряжений. Все марки нержавеющей стали подвержены коррозионному растрескиванию под напряжением. Мы провели испытания фитингов Swagelok для трубок под давлением на устойчивость к SCC и получили превосходные результаты.
Трубные обжимные фитинги и инструментальные краны Swagelok из нержавеющей стали 316 превышают минимальные требования стандартов ASTM.Cплавы 6Mo
Нержавеющая сталь
Сплавы 6-Moly (6Mo) представляют собой супераустенитную нержавеющую сталь, которая содержит не менее 6 % молибдена и имеет значение PREN (коэфф. устойчивости к точечной коррозии) не ниже 40. Сплав 6HN (UNS N08367) содержит на 6 весовых процентов больше никеля (Ni), чем сплав 254 (UNS S31254). Благодаря такому повышенному содержанию никеля сплав 6HN имеет повышенную стабильность с точки зрения формирования нежелательных интерметаллических фаз. Сплав 6HN проявил более высокую коррозионную стойкость в хлоридсодержащих средах по сравнению со сплавом 254.
- Устойчивость к точеной и щелевой коррозии под воздействием хлоридов.
- Устойчивость к коррозионному растрескиванию под напряжением (CSCC) под воздействием хлоридов.
- Предел текучести материала на 50 % выше, чем у аустенитных нержавеющих сталей серии 300.
- Ударная прочность, хорошая обрабатываемость и свариваемость.
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
- Изделия Swagelok из сплава 6-Moly предлагаются из прутков и поковок 6HN (UNS N08367), соответствующих требованиям стандарта NORSOK M-650, регламентирующего поставщиков стали.
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением
.Сплав cупердуплексной нержавеющей стали 2507
Нержавеющая сталь
Дуплексная нержавеющая сталь имеет двухфазную микроструктуру, состоящую из зерен аустенита и феррита. Такая структура придает этим материалам сочетание привлекательных свойств, включая прочность, пластичность и коррозионную стойкость.
Сплав супердуплексной феррито-аустенитной нержавеющей стали 2507 отлично подходит для работы в высококоррозионных условиях. В ее состав входят никель, молибден, хром, азот и марганец, что обеспечивает превосходную устойчивость к сплошной, точечной и щелевой коррозии, коррозионному, а также растрескиванию под напряжением при сохранении качества свариваемости.
- Повышенный предел текучести и прочности на разрыв при повышенных номинальных параметрах давления.
- По сравнению с трубками из стали 316/316L с таким же наружным диаметром и номинальным давлением меньшая толщина стенок способствует увеличению потока среды.
- Свариваемость.
- Области применения с температурами до 482 °F (250 °C).
- Более высокая теплопроводность / более низкий коэффициент температурного расширения в сравнении с нержавеющей сталью 316.
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
- Изделия Swagelok из сплава 2507 предлагаются из прутков и поковок, соответствующих требованиям стандарта NORSOK M-650, регламентирующего поставщиков стали.
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением
.Сплав 825
Никелевые сплавы
Назначение сплава 825 (Incoloy® 825), в состав которого входят никель, железо, хром и молибден, состоит в том, чтобы обеспечить устойчивость к сплошной, точечной и щелевой коррозии, а также коррозионному растрескиванию под напряжением (SCC) в широком диапазоне рабочих сред.
- Стойкость к межкристаллитной коррозии благодаря стабилизации титаном
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
- Стойкость при использовании в кислотных средах (в т. ч. в серной или фосфорной кислоте).
Для борьбы со:
General Corrosion; Localized Corrosion; Stress Corrosion Cracking; Sour Gas Cracking
Сплав 625
Никелевые сплавы
Назначение сплава 625 (Inconel® 625), в состав которого входят никель, хром и молибден с небольшой добавкой ниобия, состоит в том, чтобы снизить риск межкристаллитной коррозии в широком спектре крайне агрессивных сред.
- Стойкость к воздействию соляной и азотной кислот.
- Прочность и пластичность.
- Стойкость к щелевой и точечной коррозии при высоких температурах.
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением; Коррозия под воздействием высокосернистой среды
.Сплав C-276
Никелевые сплавы
Сплав C-276 (Hastelloy® C-276) содержит никель, молибден и хром. Высокое содержание молибдена делает этот сплав особо устойчивым к точечной и щелевой коррозии. Он относится к немногим материалам, которые обладают устойчивостью к коррозионным воздействиям влажного газообразного хлора, гипохлорита и диоксида хлора.
- Устойчивость к окислительным и кислотным рабочим средам.
- Пластичность, ударная вязкость и прочность при высоких температурах.
- Устойчивость к щелевой и точечной коррозии, сульфидной коррозии под напряжением (SSC) и межкристаллитной коррозии (IGC)
- Возможность использования в среде высокосернистого газа (NACE MR0175/ISO 15156)
Следует иметь в виду, что данный сплав НЕ рекомендуется использовать в средах с сильной окислительной способностью, таких как горячая и концентрированная азотная кислота.
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением; ; Коррозия под воздействием высокосернистой среды
.Сплав 400
Никелевые сплавы
Сплав 400 (Monel® 400) является медно-никелевым сплавом, который известен своей исключительной стойкостью к плавиковой кислоте, а также к коррозионному растрескиванию под напряжением и точечной коррозии в большинстве видов чистых и технических вод.
- Прочность и коррозионная стойкость в условиях широкого диапазона температур и рабочих сред.
- Сохранение механических свойств при температурах ниже нуля.
Следует иметь в виду, что стоячая морская вода по результатам экспериментов способствует возникновению щелевой и точечной коррозии у данного сплава.
Для борьбы со:
сплошной коррозией; местной коррозией; коррозионным растрескиванием под напряжением; Коррозия под воздействием высокосернистой среды
.Титановые сплавы
Стабильная оксидная пленка с надежной адгезией защищает титановые сплавы от коррозии. Эта пленка образуется мгновенно под воздействием воздуха или влаги на поверхность. Следует избегать безводных условий в отсутствие источника кислорода, поскольку в случае повреждения защитная пленка не восстановится.
Титан успешно применяется во многих системах благодаря превосходной коррозионной стойкости в следующих средах:
- хлоридсодержащие растворы и газ с содержанием влажного хлора;
- водные растворы хлоритов, гипохлоритов, перхлоратов и двуокиси хлора;
- естественная и хлорированная морская вода достаточно высокой температуры.
Титан и его сплавы:
- обладают исключительно высокой стойкостью к коррозии, вызванной микроорганизмами;
- высокоустойчивы к кислотам-окислителям различной концентрации и температуры (к распространенным кислотам этой категории относятся азотная, хромовая, хлорная и хлорноватистая кислота [влажный Cl]).
Ограничивающие факторы для применения титана и его сплавов:
- нелегированный титан иногда подвержен коррозии в водных хлоридсодержащих средах при условиях, не прогнозируемых с помощью скорости общей коррозии;
- сухой хлор может подвергнуть титан резкому окислению, вплоть до возгорания;
- титан не подходит для использования с фтористыми газами, чистым кислородом и водородом.
Сочетания компонентов из различных сплавов
В морских установках, в которых фитинги Swagelok из нержавеющей стали 316/316L проявили себя хорошо, а трубки из стали 316/316L подверглись щелевой коррозии в хомутах, возможно, будет экономически выгодно использовать фитинги из стали 316/316L в сочетании с трубками из более коррозионностойкого сплава. В сочетаниях компонентов из различных сплавов используются трубные обжимные фитинги Swagelok из стали 316/316L с трубками из сплавов 254, 904L, 825 или Tungum® (медный сплав UNS C69100).
Повышенное содержание хрома и никеля в стали 316/316L обеспечивает более высокую стойкость трубных обжимных фитингов Swagelok к местной коррозии. Превосходный обхват трубки обеспечивается за счет запатентованной компанией Swagelok конструкции заднего обжимного кольца и шарнирно-цангового способа обжима (hinging-colleting™), при котором достигается низкий крутящий момент и вращение гайки не передается на трубку. Процесс низкотемпературного науглероживания SAT 12, запатентованный компанией Swagelok, применяется для упрочения поверхности задних обжимных колец, что упрощает достижение превосходного обхвата трубок из вышеперечисленных сплавов.
Сочетания компонентов из различных сплавов могут стать экономически эффективным коррозионностойким решением, обеспечивающим следующие преимущества в морских установках:
- содержание никеля и хрома в стандартной нержавеющей стали Swagelok 316, превышающее минимальные требования стандарта ASTM A479, благодаря чему достигается более высокое значение PREN и повышенная стойкость к местной коррозии;
- высокая стойкость к точечной и щелевой коррозии трубок из специальных сплавов;
- низкий риск контактной коррозии за счет позиций 316, 254, 904L и 825 в таблице электродных потенциалов или с учетом длительной успешной эксплуатации фитингов из стали 316/316L с трубками из сплава Tungum.
Как и во всех узлах, в которых используются разные материалы, значения номинального давления для трубок и фитингов из разных сплавов определяются по материалу с самым низким значением номинального давления. Номинальные параметры давления см. в справочнике «Данные по трубкам — сочетания компонентов из различных сплавов», MS-06-117.
С помощью числового эквивалента стойкости к точечной коррозии (Pitting Resistance Equivalent Number, PREN) измеряется стойкость к местной точечной коррозии. Более высокие значения PREN показывают более высокую стойкость материала к точечной коррозии.
Связаться с экспертом Доступ к экспертным сервисам
Чтобы получить больше информации, ознакомьтесь с дополнительными полезными информационными материалами от Swagelok.
> Просмотреть и загрузить подготовленную к печати версию руководства по подбору материалов
ГОСТ 6689.19-92 Никель, сплавы никелевые и медно-никелевые. Методы определения фосфора, ГОСТ от 18 февраля 1992 года №6689.19-92
ГОСТ 6689.19-92
Группа В59
ОКСТУ 1709
Дата введения 1993-01-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством металлургии СССР
РАЗРАБОТЧИКИ
В.Н.Федоров, Ю.М.Лейбов, Б.П.Краснов, А.Н.Боганова, И.А.Воробьева
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета по стандартизации и метрологии СССР от 18.02.92 N 167
3. ВЗАМЕН ГОСТ 6689.19-80
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Настоящий стандарт устанавливает экстракционно-фотометрический (при массовой доле фосфора от 0,0005 до 0,05%) и фотометрический (при массовой доле фосфора от 0,005 до 0,05%) методы определения фосфора в никеле, никелевых и медно-никелевых сплавах по ГОСТ 492* и ГОСТ 19241.
_________________
* На территории Российской Федерации действует ГОСТ 492-2006. — Примечание изготовителя базы данных.
1. ОБЩИЕ ТРЕБОВАНИЯ
Общие требования к методам анализа — по ГОСТ 25086 с дополнением по разд.1 ГОСТ 6689.1.
2. ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФОСФОРА
2.1. Сущность метода
Метод основан на измерении оптической плотности экстракта молибдофосфата после экстракции его смесью -бутилового спирта и хлороформа и восстановлении молибдофосфата двухлористым оловом до фосфорно-молибденовой сини.
2.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461 и разбавленная 1:1 и 1:9.
Кислота соляная по ГОСТ 3118, разбавленная 1:1 и 1:9.
Кислота серная по ГОСТ 4204, раствор 0,5 моль/дм.
Кислота фтористоводородная по ГОСТ 10484.
Кислота хлорная, 57%-ный раствор и разбавленная 1:9.
Аммиак водный по ГОСТ 3760, разбавленный 1:50.
Натрий азотистокислый по ГОСТ 4197, раствор 50 г/дм.
Спирт этиловый ректификованный технический по ГОСТ 18300.
Квасцы железоаммонийные по ГОСТ 4205, раствор 100 г/дм.
10 г квасцов растворяют при нагревании в 70 см воды и 5 см азотной кислоты, раствор фильтруют и разбавляют водой до 100 см.
Кальций азотнокислый четырехводный по ГОСТ 4142, раствор 120 г/дм: 60 г соли растворяют в 100 см, отфильтровывают нерастворившийся остаток и разбавляют раствор водой до 500 см.
Калия гидроксид по ГОСТ 9285, раствор 30 и 100 г/дм.
Промывной раствор: к 1 дм раствора гидроксида калия (30 г/дм) прибавляют 20 см раствора азотнокислого кальция, энергично перемешивают, выдерживают 2 ч, добавляют еще 8 см раствора азотнокислого кальция и перемешивают. Спустя 20 мин фильтруют раствор через двойной фильтр средней плотности.
Аммоний молибденовокислый по ГОСТ 3765, перекристаллизованный, раствор 100 г/дм. Перекристаллизацию молибденовокислого аммония проводят по ГОСТ 6689.7.
Олово двухлористое по ГОСТ 36, свежеприготовленный раствор 40 г/дм в соляной кислоте (1:9).
Олово двухлористое, разбавленный раствор: 1 см раствора двухлористого олова (40 г/дм в соляной кислоте (1:9) разбавляют 50 см 0,5 моль/дм раствора серной кислоты. Раствор готовят перед применением.
Хлороформ по ГОСТ 20015*.
_________________
* На территории Российской Федерации действует ГОСТ 20015-88. — Примечание изготовителя базы данных.
-Бутиловый спирт по ГОСТ 6006.
Экстракционная смесь: три части хлороформа смешивают с одной частью -бутилового спирта.
Промывная жидкость для промывки экстракта: к 80 см воды добавляют 10 см 57%-ного раствора хлорной кислоты и 10 см раствора молибденовокислого аммония.
Натрий сернокислый по ГОСТ 4166.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Стандартные растворы фосфора
Раствор А: 0,4394 г однозамещенного фосфорнокислого калия растворяют в воде, переводят в мерную колбу вместимостью 1000 см и доливают до метки водой.
1 см раствора А содержит 0,0001 г фосфора.
Раствор Б: 10 см раствора А помещают в мерную колбу вместимостью 100 см, доливают до метки хлорной кислотой (1:9).
1 см раствора Б сод
ержит 0,00001 г фосфора.
2.3. Проведение анализа
2.3.1. Для сплавов, не содержащих хром и вольфрам
Навеску сплава (см. табл.1) помещают в платиновую чашку, добавляют 20-30 см азотной кислоты (1:1), 1-3 см фтористоводородной кислоты и растворяют при нагревании.
Таблица 1
Массовая доля фосфора, % | Масса навески, г |
От 0,0005 до 0,002 включ. | 2 |
Св. 0,002 » 0,005 « | 1 |
» 0,005 » 0,01 « | 0,5 |
» 0,01 » 0,05 « | 0,2 |
Стенки чашки ополаскивают водой, раствор выпаривают досуха, к сухому остатку добавляют 10 см азотной кислоты (1:1) и. снова выпаривают досуха.
К сухому остатку добавляют 20 см азотной кислоты (1:1) и нагревают до растворения солей. Раствор переносят в стакан вместимостью 250 см, ополаскивают чашку 10 см азотной кислоты (1:1) и небольшим количеством воды.
Для сплавов, содержащих марганец, в горячий раствор добавляют по каплям при перемешивании раствор азотистокислого натрия до растворения выпавшей двуокиси марганца. К раствору прибавляют 10 см 57%-ной хлорной кислоты, выпаривают до прекращения выделения густого белого дыма и охлаждают.
К остатку добавляют 30 см воды, стакан накрывают часовым стеклом, стеклянной или пластиковой пластинкой, нагревают до растворения солей (если соли полностью не растворяются, добавляют по каплям при перемешивании 57%-ную хлорную кислоту, кипятят 2 мин и охлаждают).
Полученный раствор помещают в делительную воронку вместимостью 150 см, ополаскивают стекло или пластинку и стакан 5 см хлорной кислоты (1:9), добавляют 3 см раствора молибденовокислого аммония и выдерживают 10 мин до образования молибдофосфата.
Добавляют 5 см-бутилового спирта, энергично встряхивают для насыщения водного раствора -бутиловым спиртом, добавляют 10 см экстракционной смеси, осторожно перемешивают в течение 1 мин, переворачивая воронку 20-25 раз и дают жидкостям расслоиться. Органический слой помещают во вторую делительную воронку вместимостью 150 см, а к водному слою добавляют 10 см экстракционной смеси и повторяют экстракцию. Экстракты объединяют во второй делительной воронке и промывают промывной жидкостью. После расслоения помещают органический слой в сухой стакан вместимостью 50 см, ополаскивают воронку 4-5 см экстракционной смеси. Нагревают раствор на водяной бане до полного удаления хлороформа, после охлаждения раствор помещают в делительную воронку вместимостью 100-150 см, добавляют 15 см-бутилового спирта и перемешивают. В воронку добавляют 5 см разбавленного раствора двухлористого олова, энергично перемешивают в течение 30 с и после расслаивания фаз удаляют водный слой, а органический слой переносят в сухую мерную колбу вместимостью 50 см, в которую предварительно помещают 0,2-0,3 г сернокислого натрия или фильтруют через сухой фильтр, ополаскивают делительную воронку -бутиловым спиртом, прибавляя его в ту же колбу, доливают до метки -бутиловым спиртом и измеряют оптическую плотность на фотоэлектроколориметре с красным светофильтром в кювете с толщиной поглощающего свет слоя 2 см или на спектрофотометре при 780 нм в кювете с толщиной поглощающего свет слоя 1 см.
Раствором сравнения служит раствор контрольного опыта, проведенный через весь ход анализа.
Содержание фосфора находят по первому градуи
ровочному графику.
2.3.2. Для сплавов, содержащих вольфрам
Навеску сплава (см. табл.1) помещают в стакан 250-300 см, добавляют 40-60 см азотной кислоты (1:1), накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. После растворения стекло или пластинку и стенки стакана ополаскивают водой, раствор упаривают до сиропообразного состояния, добавляют 10 см воды и раствор с осадком вольфрамовой кислоты выдерживают на горячей бане 5-10 мин. Осадок отфильтровывают на двойной плотный фильтр, стакан и осадок промывают 4-5 раз горячим раствором азотной кислоты (1:100). Фильтрат и промывной раствор собирают в стакан вместимостью 300 см и сохраняют, а остаток смывают с фильтра горячей водой в стакан, в котором проводили растворение сплава, растворяют в 70-75 см кипящего раствора гидроокиси калия (100 г/дм) и фильтр промывают горячей водой.
Раствор кипятят, разбавляют водой до 250 см и охлаждают до комнатной температуры. Добавляют 5 см раствора азотнокислого кальция, энергично перемешивают и оставляют на 2 ч. Добавляют еще 2 см раствора азотнокислого кальция и спустя 20 мин отфильтровывают осадок на плотный фильтр. Стакан, в котором проводили осаждение, и осадок на фильтре промывают 8-10 раз промывным раствором. Осадок на фильтре растворяют в 30 см горячей азотной кислоты (1:1) в стакан, в котором проводилось осаждение, фильтр промывают 2-3 раза горячей азотной кислотой (1:100) и водой.
Раствор упаривают до 20-25 см, присоединяют к фильтрату, полученному после отделения вольфрамовой кислоты, и упаривают до 20-25 см. После охлаждения к раствору добавляют 10 см 57%-ной хлорной кислоты и упаривают до прекращения выделения густого белого дыма. Остаток охлаждают, добавляют 50 см воды, 2 см 57%-ной хлорной кислоты, стакан накрывают часовым стеклом, стеклянной или пластиковой пластинкой, нагревают до растворения солей и кипятят 2 мин. После охлаждения раствор помещают в делительную воронку вместимостью 150 см, стакан ополаскивают 5 см хлорной кислоты (1:9) и далее анализ ведут, как указано
в п.2.3.1.
2.3.3. Для сплавов, содержащих хром
Навеску сплава (см. табл.1) помещают в платиновую чашку, добавляют 20-30 см азотной кислоты (1:1), 1-3 см фтористоводородной кислоты и растворяют при нагревании. Затем раствор выпаривают досуха, остаток охлаждают, добавляют 10 см азотной кислоты (1:1) и снова выпаривают досуха. Эту операцию повторяют еще три раза. К сухому остатку добавляют 20 см азотной кислоты (1:1) и нагревают до растворения солей. Раствор помещают в стакан вместимостью 250-300 см, ополаскивают чашку 10 см азотной кислоты (1:1) и водой. К полученному раствору добавляют 15-20 см 57%-ной хлорной кислоты, упаривают до прекращения выделения густого белого дыма и охлаждают. К остатку добавляют 30 см воды, стакан накрывают часовым стеклом, стеклянной или пластиковой пластинкой, нагревают до растворения солей (если соли полностью не растворяются, добавляют по каплям при перемешивании 57%-ную хлорную кислоту и кипятят 2 мин). После охлаждения раствор разбавляют водой до 150-180 см, добавляют 1 см раствора железоаммонийных квасцов, нагревают до 60-70 °С и осаждают гидроокись железа аммиаком, осторожно прибавляя последний до образования растворимого аммиачного комплекса никеля и сверх этого еще 5-6 см в избыток.
Раствор выдерживают 30 мин при 60-70 °С для коагуляции осадка гидроокиси железа. Осадок отфильтровывают на фильтр средней плотности. Стакан и осадок на фильтре промывают 6-8 раз горячим раствором аммиака (1:50) и растворяют осадок на фильтре в 20 см горячей соляной кислоты (1:1) в стакан, в котором проводилось осаждение, промывая фильтр 5-7 раз горячей водой. Осаждение, фильтрование и промывание осадка повторяют еще раз. Осадок гидроокиси железа на фильтре растворяют в 35 см горячей хлорной кислоты, разбавленной 1:9, в стакан, в котором производилось осаждение, и фильтр промывают 5-7 раз горячей водой. Полученный раствор упаривают до 25-30 см, после охлаждения помещают в делительную воронку вместимостью 150 см и ополаскивают стакан водой так, чтобы общий объем раствора был 35 см. Добавляют 3 см раствора молибденовокислого аммония, выдерживают 10 мин для образования молибдофосфата и далее анализ ведут, как указано в п.2.3.1.
Содержание фосфора находят по второму градуировочно
му графику.
2.3.4. Построение градуировочных графиков
2.3.4.1. Построение первого градуировочного графика
В делительные воронки вместимостью по 150 см помещают 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0 и 10,0 см стандартного раствора Б фосфора, разбавляют хлорной кислотой (1:9) до 35 см, добавляют 3 см раствора молибденовокислого аммония и далее анализ ведут, как указано в п.2.3.1.
2.3.4.2. Построение второго градуировочного графика
В стаканы вместимостью по 250 см помещают 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0 и 10,0 см стандартного раствора Б, добавляют по 10 см 57%-ной хлорной кислоты, разбавляют водой до 150-180 см, добавляют по 1 см раствора железоаммонийных квасцов, нагревают до 60-70 °С, осаждают гидроокись железа аммиаком и далее анализ ведут, как указано в п.2.3.3.
2.4. Обработка результатов
2.4.1. Массовую долю фосфора в процентах вычисляют по формуле
,
где — масса фосфора, найденная по градуировочному графику, г.
— масса навески, г.
2.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.2.
Таблица 2
Массовая доля фосфора, % | Допускаемые расхождения, % | |
От 0,0005 до 0,001 включ. | 0,0003 | 0,0004 |
Св. 0,001 » 0,005 « | 0,0005 | 0,0007 |
» 0,005 » 0,01 « | 0,001 | 0,001 |
» 0,01 » 0,05 « | 0,002 | 0,008 |
2.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденным по ГОСТ 8.315*, или методом добавок или сопоставлением результатов, полученных фотометрическим методом, в соответствии с ГОСТ 25086.
________________
* На территории Российской Федерации действует ГОСТ 8.315-97. Здесь и далее. — Примечание изготовителя базы данных.
3. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФОСФОРА
3.1. Сущность метода
Метод основан на образовании желтого фосфорнованадиевомолибденового комплекса и измерении его оптической плотности.
3.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461 и разбавленная 1:1 и 2:3.
Кислота соляная по ГОСТ 3118.
Смесь кислот для растворения: смешивают 120 см соляной кислоты, 320 см концентрированной азотной кислоты и 560 см воды.
Кислота фтористоводородная по ГОСТ 10484.
Кислота борная по ГОСТ 18704, раствор 40 г/дм.
Аммоний ванадиевокислый мета по ГОСТ 9336, раствор 2,5 г/дм: 2,5 г растворяют в 500-700 см горячей воды в мерной колбе вместимостью 1000 см, добавляют 10 см концентрированной азотной кислоты, доливают до метки водой, перемешивают и фильтруют.
Аммоний молибденовокислый по ГОСТ 3765, перекристаллизованный из спиртового раствора, свежеприготовленный раствор 100 г/дм. Перекристаллизацию молибденовокислого аммония проводят, как указано в п.3.2 ГОСТ 6689.7.
Калий марганцовокислый по ГОСТ 20490, раствор 10 г/дм.
Аммиак водный по ГОСТ 3760.
Спирт этиловый ректификованный технический по ГОСТ 18300.
Пероксид водорода по ГОСТ 10929, 3%-ный раствор.
Медь высокой чистоты с массовой долей фосфора не более 0,0002%.
Натрий фосфорнокислый двузамещенный по ГОСТ 4172.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Стандартный раствор фосфора: 0,4395 г однозамещенного фосфорнокислого калия или 0,4586 г двузамещенного фосфорнокислого натрия (предварительно высушенных при 105 °С до постоянной массы) помещают в мерную колбу вместимостью 1000 см, растворяют в воде, доливают водой до метки и перемешивают.
1 см раствора содержит 0,0001 г фо
сфора.
3.3. Проведение анализа
3.3.1. Для сплавов с массовой долей олова и кремния менее 0,05%
Навеску сплава массой 1 г помещают в стакан вместимостью 100 см, добавляют 10 см азотной кислоты (2:3). После растворения раствор кипятят 1 мин для удаления оксидов азота. Добавляют 1 см раствора марганцовокислого калия и нагревают почти до кипения. Добавляют 2 см раствора перекиси водорода и перемешивают раствор до разрушения избытка марганцовокислого калия и просветления раствора. Добавляют 5 см раствора ванадиевокислого аммония и осторожно кипятят 1 мин. Затем раствор охлаждают до комнатной температуры, переносят в колбу вместимостью 50 см, добавляют 5 см раствора молибденовокислого аммония, разбавляют водой до метки и перемешивают. Через 5 мин измеряют оптическую плотность на фотоэлектроколориметре с синим светофильтром или на спектрофотометре при 440 нм в кювете с толщиной поглощающего свет слоя 1 см. Раствором сравнения служит раствор, в который не добавлен раствор молибденовокислого аммония. Из полученного значения оптической плотности вычисляют значение оптической плотности контрольного опыта.
Раствор контрольного опыта приготавливают следующим образом: 10 см раствора азотной кислоты (2:3) помещают в стакан вместимостью 100 см и кипятят раствор 1 мин для удаления оксидов азота. Добавляют 1 см раствора марганцовокислого калия и далее поступают, как указано выше. Раствором сравнения служит раствор, в который не добавлен раствор молибденовокислого аммо
ния.
3.3.2. Для сплавов с массовой долей кремния свыше 0,05%
Навеску сплава массой 1 г помещают в платиновую чашку или фторопластовый стакан вместимостью 100 см и растворяют в смеси 15 см раствора борной кислоты, 1 см фтористоводородной кислоты и 10 см концентрированной азотной кислоты. После растворения раствор выдерживают 1 ч при температуре 90 °С. Раствор переносят в стеклянный стакан вместимостью 100 см, ополаскивают чашку или стакан 5 см воды, добавляют 1 см раствора марганцовокислого калия и нагревают до начала кипения, добавляют 2 см раствора перекиси водорода и перемешивают до разрушения избытка марганцовокислого калия и просветления раствора. Раствор нейтрализуют аммиаком до рН 3, добавляют 5 см азотной кислоты (1:1), 5 см раствора ванадиевокислого аммония и кипятят 1 мин. Далее анализ проводят, как указано в п.3.3.1. Раствор сравнения и раствор контрольного опыта приготавливают, как указано в п.3.
3.1.
3.3.3. Для сплавов, с массовой долей олова свыше 0,05%
Навеску сплава массой 1 г помещают в стакан вместимостью 100 см, добавляют точно 15 см смеси кислот для растворения и растворяют при умеренном нагревании. Добавляют 1 см раствора перекиси водорода и осторожно кипятят 3-5 мин, избегая бурного и продолжительного кипения. Затем в раствор добавляют 5 см раствора ванадиевокислого аммония, охлаждают до комнатной температуры и переносят в мерную колбу вместимостью 50 см. Добавляют 5 см раствора молибденовокислого аммония, разбавляют водой до метки и перемешивают. Далее анализ проводят, как указано в п.3.3.1. Раствор сравнения и раствор контрольного опыта приготавливают, как указано в п.3.3.1.
3.3.4. Построение градуировочного графика для сплавов с массовой долей олова и кремния менее 0,05%
В восемь стаканов вместимостью по 100 см помещают по 1 г меди, а в семь из них добавляют 0,5; 1,0; 2,5; 5,0; 7,5; 10,0 и 12,0 см стандартного раствора фосфора.
Во все стаканы добавляют по 10 см азотной кислоты (2:3) и далее поступают, как указано в п.3.3.1. Раствором сравнения служит раствор, не содержащий фосфора. По полученным данным строят градуировочный график.
3.3.5. Построение градуировочного графика для сплавов с массовой долей кремния свыше 0,05%.
В восемь платиновых чашек или фторопластовых стаканов вместимостью по 100 см помещают по 1 г меди, а в семь из них добавляют 0,5; 1,0; 2,5; 5,0; 7,5; 10,0 и 12,0 см стандартного раствора фосфора. Во все стаканы добавляют по 15 см раствора борной кислоты, по 1 см фтористоводородной кислоты и по 10 см концентрированной азотной кислоты, далее поступают, как указано в п.3.3.2. Раствором сравнения служит раствор, не содержащий фосфора.
По полученным данным строят градуировочный график.
3.3.6. Построение градуировочного графика для сплавов с массовой долей олова свыше 0,05%
В восемь стаканов вместимостью по 100 см помещают по 1 г меди, а в семь из них помещают 0,5; 1,0; 2,5; 5,0; 7,5; 10,0 и 12,0 см стандартного раствора фосфора. Во все стаканы помещают по 15,0 см смеси кислот для растворения, далее поступают, как указано в п.3.3.3. Раствором сравнения служит раствор, не содержащий фосфора. По полученным данным строят градуировочный график.
3.4. Обработка результатов
3.4.1. Массовую долю фосфора в процентах вычисляют по формуле
,
где — масса фосфора, найденная по градуировочному графику, г;
— масса навески сплава, г.
3.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.2.
3.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никеля, никелевых и медно-никелевых сплавов, утвержденным по ГОСТ 8.315, или методом добавок, или сопоставлением результатов, полученных экстракционно-фотометрическим методом, в соответствии с ГОСТ 25086.
Электронный текст документа
подготовлен ЗАО «Кодекс» и сверен по:
официальное издание
М.: Издательство стандартов, 1992
Как определить различные типы металлолома
Цветные металлы обычно более ценны, чем черные, поэтому важно знать разницу. После того, как вы применили магнитный тест для разделения черных и цветных металлов, можно выполнить дополнительные тесты. Принесите все это в Mid City Scrap Iron & Salvage в Вестпорте по лучшим ценам на металлолом на Кейп-Коде.
ИДЕНТИФИКАЦИЯ ПРИЗНАКА
Ниже приведены несколько советов, которые помогут вам быстро определить наиболее часто встречающиеся типы лома цветных металлов, с которыми вы, вероятно, столкнетесь дома или за пределами своей деятельности.Чем больше вы работаете с металлоломом, тем легче будет идентифицировать его наощупь или зрение.
Алюминий легко идентифицировать, поскольку мы регулярно видим его в банках с газировкой. Этот металл очень легкий, цветной и не ржавеет.
Латунь или бронза обычно используется в музыкальных инструментах, декоративных элементах, трубных клапанах и коллекторах. Это желтоватый цвет и обычно составляет около 50% от стоимости меди №1, так как это медный сплав.
Медь часто используется в кухонной посуде, электронике и проводке.Чистая медь имеет розовый цвет, но потускневшая медь обычно коричневого или красного цвета. При окислении медь становится зеленой, как мы видим в Статуе Свободы. Медная проводка, как правило, выполняется из «яркой» или чистой проволоки, поэтому она очень ценится. Медь также содержится в процессорах, катушках индуктивности, трансформаторах и двигателях, и в таких случаях обычно классифицируется как «медный обрыв».
- Медь # 1 — чистая медь (обычно наблюдается в трубах без паяных соединений)
- Медь № 2 — окрашенная медь (обычно встречается в меди, имеющей паяные соединения)
- Медь № 3 — листовая легкая медь
Медную проволоку сложно сортировать, поэтому вы увидите некоторые различия в сортировке на разных складах металлолома.В большинстве случаев процентное содержание меди в самой проволоке — это то, что используется для определения марки. Некоторые скребки любят очищать медь, чтобы получить полную цену, но это не обязательно.
- 85% медная проволока — Очень тонкая, диаметром примерно с карандаш
- 70% медная проволока — Проволока, обычно встречающаяся в оборудовании
- 50% медный провод — Обычно встречается в приборах или удлинителях
- 30% медный провод — Проволока тонкого сечения с большим количеством насадок
- 15% медная проволока — чаще всего встречается в рождественских огнях
Свинец очень тяжелый и очень токсичный.Его плотность на 150% больше, чем у железа, и он достаточно мягкий, чтобы вырезать из него резьбу перочинным ножом. Свинец используется в рентгеновских аппаратах и для изготовления пуль.
Нержавеющая сталь выпускается в нескольких вариантах:
- # 200 Нержавеющая сталь — немагнитный железный сплав, содержащий 4% никеля, 7% марганца и 17% хрома.
- # 304 Нержавеющая сталь , как мы упоминали ранее, не притягивает магнит, даже если это сплав железа и содержит 8% никеля.Он также содержит 18% хрома.
- # 316 Нержавеющая сталь также немагнитна, несмотря на то, что она является сплавом железа. Он содержит 10% никеля и 18% хрома. Она стоит больше, чем другие марки нержавеющей стали, и ее легко идентифицировать по штампу из нержавеющей стали 316 SS где-нибудь на изделии.
- # 400 Нержавеющая сталь не содержит никель и фактически является единственным типом нержавеющей стали, которая является магнитной. Он состоит из сплава, который содержит 1% марганца и 11% хрома.
ТЕСТ ИСКРЫ
Подобно магнитному тесту, искровой тест веками использовался для тестирования различных типов металлов. Для проведения этого теста вам понадобится кофемолка определенного типа, например, настольная шлифовальная машина, которая даст вам контроль во время теста. Также — убедитесь, что тестируемый кусок достаточно велик, чтобы он не растаял во время теста, иначе ваши усилия будут бесполезны.
Лучший способ определить тип металла — это точно знать, какой должна быть искра.Описания, которые мы приведем здесь, должны помочь, но наличие известного образца каждого типа металла будет еще более полезным для определения того, что у вас есть.
Идентификационные маркеры
- Цвет — Цвет искр помогает идентифицировать металл. Например, никель будет давать очень темные красные искры, невероятно белые искры могут означать титан, а кованое железо дает очень длинные желтые искры.
- Вилки и пружины — Количество вилок и ветвей, которые вы видите, будет показывать количество углерода, обнаруженного в образце металла.Чем выше процент углерода, тем больше вилок и веточек вы увидите в искрах.
- Отсутствие искр — Абсолютное отсутствие искр означает, что обнаруженный вами металл является цветным. Подходит для подтверждения магнитного теста и разделения предметов, которые могут выглядеть одинаково, например, алюминия и нержавеющей стали.
- Length — Длина потока тоже очень показательна. Например, из легированной стали образуется очень большой поток длиной до 50 или 60 дюймов, который имеет белый цвет и оканчивается вилками.Однако потоки карбида вольфрама обычно очень маленькие, редко превышают 3 дюйма в длину и имеют светло-оранжевый оттенок на всем протяжении.
Если вы не знаете, какой у вас металлолом, обученные сертифицированные операторы весов в Mid City Scrap Iron & Salvage проверит его, чтобы классифицировать материал для вас. В талоне весов, который вы получите от оператора весов, будет указан тип материала, который вы перерабатываете, и вам будет указано, где его разгрузить.Мид-Сити расположен на Стейт-роуд в Уэстпорте, Массачусетс, и обслуживает жителей, предприятия и промышленных клиентов по всему мысу, от Нью-Бедфорда до Баззардс-Бэй, Провинстаун и повсюду между ними.
удивительных способов понять это
Изображение предоставлено: Wikimedia Commons
Как идентифицировать металлыМеталлы — это податливые и плавкие материалы, которые можно превращать в различные предметы, от кухонной утвари до машин.
Если вы планируете работать в металлургической промышленности, хотите продавать металлолом или какой-то металлический предмет, который вам необходимо отремонтировать, вам, возможно, потребуется знать, как идентифицировать металлы.
Существуют различные тесты, которые могут вам в этом помочь. У металлов также есть свои особенности, поэтому ознакомление с ними позволит вам идентифицировать их.
Тесты различных металловРазличные тесты могут быть выполнены для определения типа металла, который у вас есть или который вам нужен.
Один из них — проверка внешнего вида. Их физические особенности могут помочь определить, кто они. Вы должны быть знакомы с тем, как они выглядят, и вы можете сделать это, проверив изображения различных металлов в книгах.
Однако есть металлы, которые внешне похожи друг на друга, поэтому другие тесты также должны быть выполнены, чтобы помочь определить правильный тип.
Например, золото и латунь часто путают друг с другом, потому что они одного цвета. Золото тяжелее, а у латуни будет колокольчик, похожий на вибрирующий звук, если по нему ударить.
Еще один магнитный тест.
Металлы бывают черные и цветные. Черные металлы содержат железо, что делает их магнитными. С другой стороны, цветные металлы немагнитны, и они также более ценны, чем черные металлы.
Используйте магнит для этого теста, чтобы определить, есть ли у вас черный или цветной металл.
Существует также тест на излом, который позволяет идентифицировать металл, анализируя его сломанную часть.
Другой распространенный тест — это искровой тест. У металлов есть свои искровые характеристики, и вы можете проверить это, прикоснувшись металлом к шлифовальной машине, чтобы получить искру.
Наблюдайте за образовавшимися искрами и обратите внимание на следующее:
- Цвет: Цвет искр, выделяемых этими металлами, отличается друг от друга.Например, желтые искры могут быть от кованого железа, титан может давать белые искры, а никель — темно-красные искры
- Длина: длина искры также может помочь вам определить тип металла. Например, у карбида вольфрама есть светло-оранжевые искры, которые обычно составляют всего около 3 дюймов, в то время как у легированной стали есть более длинные искры, которые обычно составляют около 60 дюймов.
- Веточки и вилки: они показывают содержание углерода в металле. Чем больше вилок и штифтов, тем выше содержание углерода.
Посмотрите это видео от TheProRancher, показывающее, как проводится искровое испытание для идентификации различных типов металлов:
Определение общих типов металловАлюминий. Этот металл серый и блестящий, но не блестит. Имеет плотность 2,70 г / см3. При контакте с воздухом образует прозрачный оксид. Он расплавится, когда достигнет температуры 1217 ° F или 658 °
Золото. Этот драгоценный металл мягкий, тяжелый и ярко-желтый.Он не ржавеет, поэтому его чаще всего используют для изготовления ювелирных изделий.
Это электрический проводник, который означает, что высокое электричество может проходить через объект, сделанный из него. Это цветной металл, и он может плавиться при воздействии температуры 1 947,52 ° F или 1064,18 ° C.
Латунь. Его часто путают с золотом, потому что они одного цвета. Однако вы могли отличить их, пытаясь ударить по объекту.
Если есть вибрация, как у колокола, то это латунь, а не золото.Тем не менее, оно также не содержит железа, как золото, хотя его температура плавления варьируется в зависимости от того, сколько латуни было использовано для изготовления объекта, но обычно она составляет от 1652 ° F до 1724 ° F или от 900 ° C до 940 ° C
Бронза. Этот металл темно-медного цвета, но через некоторое время может стать зеленоватым. Как и латунь, он также имеет колоколообразную вибрацию при ударе. Бронза — это сочетание олова и меди, а также немного свинца.
Медь. Светло-красный, при окислении становится зеленоватым.Его часто смешивают с другими металлами, чтобы получить другой тип металла, такой как бронза и латунь. Он цветной, его плотность 8,94 г / см3.
Свинец. Это тяжелый металл тускло-серого цвета, но при полировке он становится блестящим. Он мог плавиться при более низкой температуре, например, 621 ° F или 327 ° C.
Утюг. Как и свинец, его цвет тускло-серый. Когда он ржавеет, цвет ржавчины немного красный. Он магнитный и имеет плотность 7,87 г / см3. Он может расплавиться при достижении 2786 ° F или 1530 ° C.
Ссылки:http://www.smithy.com/machining-handbook/chapter-2/page/7
http://www.instructables.com/id/Identify-Metals/?ALLSTEPS
How to Identify Different Types of Scrap Metal
Как проверить на никель
Купон еще действителен! Смотрите и узнавайте больше!
Первым шагом в тестировании на никель является получение точного точечного теста на диметилглиоксим (dmg).NoNickel Nickel Alert® был представлен в 2003 году материнской компанией Athena Allergy в качестве первого коммерчески доступного набора для тестирования никеля. Это первый точечный тест на dmg с предварительным смешиванием и измерением, он известен простотой использования и точностью.
Nickel Alert достаточно чувствителен, чтобы обнаруживать присутствие свободного никеля на уровне всего 10 ppm (частей на миллион) — порогового значения, ниже которого только люди с наиболее выраженной чувствительностью к никелю будут испытывать реакцию.
Теперь, когда у вас есть соответствующий тест, все, что вам нужно, это ватный тампон и металлические предметы, которые вы хотите проверить. Nickel Alert безопасно использовать даже для деликатных предметов семейной реликвии.
Чтобы получить точный результат теста, выполните следующие простые шаги:
- Нанесите несколько капель Nickel Alert на ватный тампон
- Плотно потрите влажным тампоном исследуемый металлический предмет в течение нескольких секунд (15-30 секунд)
- Наблюдайте за тампоном, чтобы увидеть, стал ли смоченный участок розовым, красным или пурпурным — любой из этих цветов указывает на то, что никель IS присутствует в металле, и вы захотите принять меры защиты, чтобы избежать этого металлического предмета.
Если после выполнения вышеуказанных шагов вы не видите положительного результата теста, вы можете продолжать использовать влажный тампон для очистки других металлических предметов. Одна бутылка Nickel Alert обеспечит более 200 положительных тестов!
Если вы наблюдаете темно-серый или черный цвет без каких-либо намеков на розовый, красный или фиолетовый, это не положительный результат теста. Однако для целей наблюдения вы захотите использовать новый тампон для следующего теста.
Проверьте все свои металлические предметы на никель с помощью Nickel Alert и спасите свою кожу от неприятных симптомов аллергии на никель.Если никель обнаружен, используйте Nickel Guard ™ , чтобы создать барьер между никелем и кожей.
Copyright © 2003-2020 Athena Allergy Inc. Все права защищены.
нейзильбер | Факты, определения и области применения
Нейзильбер , ряд сплавов меди, никеля и цинка, которые имеют серебристый внешний вид, но не содержат серебра. Его состав варьируется от 7 до 30 процентов никеля, причем наиболее широко используемым сплавом является 18 процентов никелевого серебра (18 процентов никеля, 62 процента меди, 20 процентов цинка).Как правило, содержание цинка снижается по мере увеличения содержания никеля, при этом содержание меди колеблется от 53 до 63 процентов. Стерлинговое серебро, напротив, представляет собой сплав, в котором чистое серебро составляет не менее 92,5 процента содержания.
Этапы изготовления посеребренной ложки (А) Заготовка из нейзильберного сплава на одну ложку; (B) заготовка поперечно прокатана до нужной толщины и ширины, что также ее упрочняет; (C) поперечно перекатанный конец ложки тоньше ручки; (D) форма заготовки ложки; (E) пустая ручка с нанесенным рисунком; (F) сформированная чаша; (G) набор ложек и полировка; (H) тонкая полировка; (I) покрытие; (J) полировка.
Предоставлено Гранвильским колледжем дополнительного образования, Шеффилд, Англия.Подробнее по этой теме
Обработка никеля: История
… установлено, что пай-тун, ныне называемый никель-серебром, состоит из меди, никеля и цинка.
Важность этих сплавов заключается в их цвете, пластичности, хороших механических свойствах и пригодности для работы в самых разных формах литья, прокатки, прессования или вытяжки.Добавление 1-2% свинца улучшает механические свойства. Такие сплавы лучше сопротивляются коррозии, чем латунь, но медленно тускнеют под действием серы в воздухе. Их цвет варьируется от почти белого у 30-процентного сплава до бледно-желтого в сплавах с низким содержанием никеля.
Природный сплав, известный как пактонг (белая медь), выплавляемый китайцами из медно-никелевых руд, был одним из первых сплавов, используемых людьми. Позже он был улучшен за счет добавления цинковой руды и был импортирован в Европу Ост-Индской компанией.Только в 1840-х годах сплав был изготовлен в Европе путем смешивания трех металлов, и до 1914 года он был известен как немецкое серебро. После того, как в 1844 году в Бирмингеме был открыт завод по производству гальванических покрытий, немецкое серебро было признано очень подходящим в качестве основы для серебряного покрытия.
Нейзильбер широко используется для изготовления гальванических столовых и декоративных изделий из серебра, ювелирных изделий, архитектурных и декоративных металлоконструкций, некоторых пищевых продуктов и химического оборудования, а также арматуры для судов и сантехников. В виде жестко прокатанной ленты он используется в пружинных элементах, особенно в электрических и телекоммуникационных реле.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасфактов о никеле | Дартмутские токсичные металлы
Что такое никель?
Никель — серебристо-белый металл, который в природе встречается в земной коре. Никель, занимающий 24 место в мире по распространенности, является переходным металлом, что означает, что он занимает середину периодической таблицы элементов. Это указывает на его химические свойства, которые позволяют ему образовывать несколько химических соединений, некоторые из которых токсичны.Чистый никель твердый, но пластичный, и по этой причине он используется в качестве упрочняющего компонента в металлических сплавах. Это также отличный проводник как тепла, так и электричества.
Элемент был непреднамеренно обнаружен в 1751 году бароном Акселем Фредериком Кронштедтом, который извлек его из минерала под названием никколит. Намереваясь добыть медь, усилия барона дали белое вещество, а не красноватое вещество, которое он ожидал. Он назвал новый металл «купферникель», немецкое слово, которое примерно переводится как «дьявольская медь».”
Где найти никель?
Никель встречается повсюду в окружающей среде, но обычно только в следовых количествах. Например, концентрация никеля в питьевой воде на всей территории Соединенных Штатов составляет в среднем 2 части на миллиард (ppb), то есть на каждый миллиард частей воды (2 микрограмма на литр) приходится 2 части никеля.
Этот металл также повсеместно присутствует в почве и может быть обнаружен в более высоких концентрациях в ряде минеральных руд, включая сульфиды, оксиды и силикаты никеля.Большая часть никеля в почве настолько тесно связана с другими минералами, что сопротивляется прямому поглощению растениями и животными и не может легко повлиять на здоровье человека или экосистемы.
Никель, содержащийся в земной коре, имеет множество природных источников. Никель можно найти как в гидротермальных жилах — каналах, через которые проходит вода, нагретая в глубоких слоях земли, — так и в поверхностных отложениях, образованных эрозией и выветриванием горных пород. Вулканические извержения высвобождают большое количество никеля в потоках лавы, что позволяет предположить, что внутренние области земли содержат более высокие концентрации металла, чем кора.Было обнаружено, что метеориты содержат концентрированные отложения никеля, связанного с железом, а высокие концентрации никеля можно найти в морских конкрециях, которые представляют собой плотные минеральные отложения на дне океана.
Следы никеля также присутствуют в воздухе — наследство промышленных предприятий, таких как очистка металлов, нефтяные и угольные электростанции и мусоросжигательные заводы. Обследование 111 городов США в 1982 году показало, что концентрация никеля в атмосфере колеблется от 1 до 86 нанограммов (миллиардных долей грамма) на кубический метр (10 кубических футов).Чтобы представить это в перспективе, Агентство по охране окружающей среды США рекомендует людям избегать вдыхания воздуха, содержащего более 50 микрограммов (миллионных долей грамма) никеля на кубический метр, что более чем в пятьсот раз превышает самую высокую измеренную концентрацию в атмосфере. в городе США.
В процессе очистки и сжигания руд, содержащих никель, образуются летучие формы никеля, такие как карбонил никеля и никелевая пыль. Эти соединения могут быть токсичными при их непосредственном вдыхании в высоких концентрациях в течение длительного периода времени, и рабочие в этих отраслях должны быть защищены от воздействия этих соединений для защиты их здоровья.
Каковы виды использования никеля?
Никель был излюбленным компонентом монет, потому что он яркий и требует тонкой полировки, а также потому, что он легче меди, серебра и других металлов, обычно используемых в монетах. В 1850 году Швейцария стала первой современной страной, официально применившей никель в чеканке монет. США вскоре последовали их примеру в 1850-х и 60-х годах, когда они добавили никель в свои пенни и пятицентовые монеты, чтобы сделать их легче. Хотя пятицентовая монета США содержала только 25 процентов никеля, она быстро стала известна как «никель».«Первая монета из чистого никеля была выпущена в Швейцарии в 1881 году; Австрия и Венгрия последовали их примеру в 1893 году.
Поскольку никель нелегко окисляется или ржавеет, этот металл был адаптирован в качестве гальванического материала в 1850-х годах. Гальваника — это процесс, при котором ионы металлов в химическом растворе притягиваются к твердому металлическому электроду. Когда ионы связываются с поверхностью металла, они образуют однородное тонкое покрытие. Гальваника металлической поверхности никелем может образовывать слой, защищающий от коррозии.По мере того, как электрохимия никеля стала более понятной, он был адаптирован для использования в батареях. Сегодня соединения никеля и кадмия используются для производства никель-кадмиевых (Ni-Cd) аккумуляторов.
На сегодняшний день никель в наибольшей степени используется в сталелитейной промышленности, в которой используется примерно две трети мирового никеля, производимого ежегодно. Металл обладает необычными свойствами: твердый — прочный, способный противостоять разрушению под воздействием высоких сил — и пластичный — способность деформироваться или сгибаться перед разрушением или растрескиванием.Кроме того, никель химически подобен железу, но обладает особенно хорошей стойкостью к окислению. Из-за своего сходства с железом никель может легко заменить железо в стальных сплавах или смесях. Добавление никеля в сталь увеличивает ее прочность, пластичность, устойчивость к ржавчине и ее ценность.
Так называемые нержавеющие стали, содержащие хром и от 5 до 25 процентов никеля, используются во множестве областей применения. Устойчивые к коррозии свойства этой стали делают ее идеальной для использования в столовых приборах, смесителях, раковинах, уличном оборудовании, моторизованных транспортных средствах и кухонной посуде.Высокопрочные конструкционные стали, содержащие никель, используются в автомобильной, аэрокосмической и строительной отраслях. Практически любая тяжелая промышленность, производящая механические устройства, на определенном этапе производственного процесса использует конструкционную или нержавеющую сталь.
Другие сплавы цветных металлов включают никель-медные сплавы, обычно содержащие около 65 процентов никеля, и медно-никелевые сплавы, которые обычно содержат около 10 процентов никеля. Их использование включает судовое оборудование и оборудование для обработки неорганических кислот и щелочей.Никель-хромовые сплавы, содержащие от 40 до 70 процентов никеля, используются в агрессивных химических средах и при высоких температурах, таких как нагревательные элементы и детали реактивных двигателей, а также в столовых приборах из нержавеющей стали и кухонной утвари. Сплавы никель-медь-цинк, широко известные как нейзильбер, используются в декоративных целях, в том числе в ювелирных изделиях, из-за прекрасной полировки, которую они могут достичь.
Нужен ли никель для здоровья?
Было показано, что никель является важным микроэлементом для нескольких видов животных и, вероятно, необходим для человека.Однако у людей нет известных заболеваний, связанных с дефицитом никеля, и вполне вероятно, что мы получаем весь необходимый нам никель за счет его повсеместного присутствия в пище и воде.
Является ли никель проблемой для здоровья?
Хотя чистый никель может легко реагировать с другими элементами с образованием различных химических соединений, большинство форм никеля не представляют угрозы для здоровья человека. Люди неосознанно потребляют в среднем 170 микрограммов никеля в день, что на крошечное количество меньше массы одной песчинки.Незначительные количества никеля присутствуют в воздухе, которым мы дышим, и в бытовых товарах, от смесителей до шампуня. Эти количества не имеют известного влияния на здоровье человека или экосистемы.
Человеческие тела выработали механизмы метаболизма — выделения и удаления небольшого количества никеля. Водорастворимые формы никеля, вдыхаемые в виде частиц пыли в воздухе, растворяются в кровотоке, а никель также попадает в кровоток через кожу после контакта с никельсодержащими продуктами.Большая часть никеля в кровотоке удаляется почками и выводится из организма с мочой. Проглоченный никель проходит через желудочно-кишечный тракт, но не всасывается.
Было показано, что большие дозы никеля, такие как случайное проглатывание, имеют более неблагоприятные последствия для здоровья, начиная от болей в животе и заканчивая сердечной недостаточностью. Однако эти эффекты произошли после воздействия на уровни в 50 000–100 000 раз превышающие уровни, обычно встречающиеся в пище или питьевой воде, и являются определенно редкими случаями.Количества, обнаруженные в этих исследованиях, даже превышают количества, обнаруженные в твердых никелевых отходах на участках опасных отходов.
Другие исследования показали, что рабочие, вдыхающие никелевую пыль в металлообрабатывающей и нефтеперерабатывающей промышленности, а также рабочие, вдыхающие никельсодержащие пары от сварки нержавеющей стали, могут иметь более серьезные последствия для здоровья. Исследования 1960-х годов показали первые признаки того, что соединения никеля, такие как карбонил никеля, могут вызывать опухоли легких у лабораторных крыс. Более поздние исследования, проведенные в 1980-х годах Агентством по охране окружающей среды США (EPA), показали, что продолжительное воздействие никелевой пыли, карбонила никеля или субсульфида никеля — прямых побочных продуктов рафинирования никеля и обработки металлов — может вызвать рак.Это привело к федеральным постановлениям, ограничивающим воздействие определенных соединений никеля на рабочем месте и в окружающей среде. При вдыхании в определенных формах и в течение достаточно длительного периода времени никель действительно канцерогенен для человека. Современные методы промышленной гигиены помогли обуздать эти досадные осложнения для здоровья, вызванные никелем, за счет снижения содержания никелевой пыли в воздухе на рабочем месте и предоставления средств защиты, снижающих ее воздействие.
К счастью для большинства людей, такое хроническое воздействие никеля случается редко.Самая распространенная проблема со здоровьем, связанная с никелем, — это аллергическая реакция, возникающая в результате частого обращения с никельсодержащими продуктами. Доля населения, генетически предрасположенного к аллергическим кожным реакциям на никель (5-10 процентов), аналогична для других металлов.
Как у людей развивается аллергическая реакция на никель?
Самым распространенным заболеванием, с которым сталкиваются люди, контактирующие с никелем, является кожная сыпь, называемая контактным дерматитом.Это состояние может быть вызвано прямым обращением с никельсодержащими предметами, обычными для большинства домашних хозяйств. Монеты, сантехника, некоторые шампуни и моющие средства, пигменты и украшения могут содержать небольшое количество никеля, которое может абсорбироваться через кожу.
Со временем прямой контакт кожи с этими предметами может вызвать у человека сенсибилизацию к металлу и аллергическую реакцию на никель. Например, ношение серег из металла, содержащего никель, может вызвать у человека повышенную чувствительность к этому элементу.Ученые считают, что никель в украшениях растворяется в поте, впитанном кожей. Затем металл может связываться с одним из естественных белков организма. Этот никель-белковый комплекс может не распознаваться иммунной системой, и это может запускать сигналы защитным механизмам организма, чтобы они реагировали на комплекс, как если бы это был вторгающийся антиген.
Кожная сыпь в месте контакта — наиболее частый результат такой реакции. В более острых случаях не сообщалось о приступах астмы.Когда человек становится сенсибилизированным к этому веществу, даже никель, попавший в организм с пищей, может вызвать аллергические симптомы. По этой причине аллергологи рекомендуют лицам, страдающим тяжелой аллергией на никель, снизить потребление никеля с пищей, избегая определенных продуктов, указанных в рамке ниже.
Как никель вредит живым существам?
сельдь, ростки, спаржа, арахис, грибы, ревень, кукуруза, какао, помидоры, капуста, устрицы, фасоль, лук, шпинат, горох, груши, изюм, чай, разрыхлитель, цельнозерновая мука, продукты, приготовленные в никелевой посуде, все консервыКак и большинство агентов окружающей среды, токсическое действие любого металла связано со способом его попадания в организм или, говоря языком токсикологии, с путём его воздействия.У никеля есть три основных пути воздействия. Его можно вдохнуть, проглотить или впитать через кожу. Когда никель вдыхается, газообразные соединения никеля, такие как субсульфид никеля или мелкие частицы никелевой пыли (в частности, частицы PM-2,5 — менее 2,5 микрометра в диаметре), оседают глубоко в легких. В случае ингаляционного воздействия ученые обнаружили, что форма никеля и его растворимость является ключевым определяющим фактором в механизмах токсичности. Водорастворимые соединения никеля могут всасываться легкими в кровоток и в конечном итоге удаляться почками.Однако плохо растворимые соединения никеля могут со временем накапливаться в легких и вызывать такие осложнения, как фиброз легких, образование рубцовой ткани в легких, а также бронхит и рак легких. Механизм, который позволяет никелю вызывать рак или способствовать его развитию, все еще очень плохо изучен.
Может ли никель на рабочем месте представлять опасность для здоровья?
Определенные формы никеля являются канцерогенными или вызывают рак, но эти формы вряд ли можно встретить за пределами промышленных предприятий, таких как заводы, где перерабатываются металлы, особенно там, где перерабатывается никелевая руда и где производится нержавеющая сталь.Другие рабочие, которые могут подвергаться воздействию этих форм никеля, — это сварщики, гальваники, производители аккумуляторов, ювелиры, маляры-распылители, производители красок и лаков.
Было обнаружено, что рабочие металлургической промышленности, которые ежедневно подвергались воздействию никелевой пыли в виде карбонила или субсульфида никеля, чаще страдают раком носа, носовых пазух и легких. Вдыхание никелевой пыли может также вызвать хронический бронхит, острый респираторный дистресс-синдром и фиброз легких.Уровни никелевой пыли и соединений никеля в воздухе на промышленных предприятиях, перерабатывающих никелевые руды и сплавы, до 1980-х годов были в 100 000–1 миллион раз выше, чем типичные фоновые уровни, обнаруживаемые в воздухе на всей территории Соединенных Штатов. Агентство по охране окружающей среды США с тех пор определило, что пыль никелевого завода, субсульфид никеля и карбонил никеля являются канцерогенами для человека в этих профессиональных условиях.
Управление по безопасности и гигиене труда (OSHA) разрабатывает и обеспечивает соблюдение федеральных нормативных актов, касающихся никеля и других токсичных веществ, для защиты рабочих от подобных вредных воздействий.OSHA установила, что уровень никеля в воздухе на рабочем месте не может превышать 1 микрограмм на кубический метр. Эта политика помогла снизить воздействие никелевой пыли на рабочих в металлургической промышленности.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 причины, почему вы должны носить только украшения без никеля — ДЖУЛЬЕТТА И ОЛИВЕР
Определение и применение никеля
Прежде всего давайте разберемся, что такое никель. Согласно определению Википедии, никель — это серебристо-белый металл с легким золотистым оттенком, который требует полировки. Никель — жизненно важный металл для множества отраслей промышленности.
Это универсальный металл, который легко сплавится с большинством других металлов, что облегчает работу с ним.
Его высокая универсальность и исключительная термостойкость и устойчивость к коррозии привели к его использованию в широком спектре приложений; такие как авиационные газовые турбины, паровые турбины на электростанциях и его широкое использование на рынках энергии и ядерной энергии.
И, конечно же, не будем забывать о никелированных украшениях и даже о никелированных смесителях, посуде из никелево-стального сплава, никелево-пигментированной посуде и многих других предметах домашнего обихода, о которых мы никогда не думали, что они содержат никель.
3 веских причины, почему вы должны выбрать украшения без никеля:
1. Никель повсюду — наше повседневное воздействие никеля
Знаете ли вы, что никель содержится и в пище, и в воде? Фактически, основным источником воздействия никеля является пероральное потребление, которое может быть еще выше из-за загрязнения человеком. Мы сталкиваемся с никелем каждый день —
- Пока мы готовим, используя посуду, окрашенную никелем, которая выделяет никель в нашу пищу;
- Пока мы пьем воду, которая раньше была загрязнена из никелированных кранов;
- Те из нас, кто курит, поглощают никель непосредственно из табачного дыма, потому что атмосфера загрязнена очисткой металлического никеля и сжиганием ископаемого топлива;
- И, конечно же, не будем забывать о контакте кожи с никелевыми украшениями;
2.У каждого может развиться аллергия на никель и даже рак
Каким-то образом наши почки могут удалить большую часть никеля, поглощенного нами в течение дня, но большие дозы никеля или постоянное воздействие никеля могут вызвать аллергию на никель.
Неважно, сколько вам лет, 4 или 60 — у каждого в любом возрасте может развиться аллергия на никель, а в худших случаях даже рак. Да рак! Почему? Потому что соединения никеля, как группа, являются канцерогенными и вызывают рак легких и носа.
3.Вы можете предотвратить аллергию на никель — носите только украшения без никеля
Вы можете предотвратить это!
Итак, хотя мы не можем контролировать загрязнение атмосферы и другое потребление никеля, мы можем избежать контакта с никелем, нося только ювелирные изделия, не содержащие никель.
Лучшее решение — профилактика. Вы можете предотвратить развитие аллергии на никель, избегая украшений, содержащих никель, а в наши дни это довольно просто.
Есть много красивых колец, серег, браслетов и других украшений без никеля, так как осознание вреда никеля возросло.
Кстати, у мужчин аллергия на металлы встречается реже — только 6 процентов мужчин страдают контактным дерматитом и нуждаются в гипоаллергенных альтернативах.
Но, как я уже говорил ранее, постоянное воздействие чего-то, что содержит никель, может вызвать аллергию на никель.
Проверьте, действительно ли у вас аллергия на никель
Как узнать, что у вас аллергия на никель?
- Если вы носите украшения из никеля и у вас раздражение кожи или сыпь, велика вероятность, что у вас аллергия на никель или другой грязный металл, который содержится в ваших украшениях.
- Вы также можете обратиться к врачу, который сможет диагностировать аллергию на никель, посмотрев на вашу кожу. Он, вероятно, также спросит, прикасались ли вы к любому металлу, который может содержать никель.
- Есть еще кожный тест. Врач нанес на пластыри небольшое количество никеля и других аллергенов и положил их на верхнюю часть спины на 48 часов, пока не появится реакция.
Иногда мы путаем сыпь и раздражение кожи с аллергией на никель.
Например, однажды один из наших клиентов был уверен, что у него аллергия на никель, который украшает его обручальное кольцо.Он провел тест на никель и понял, что это не аллергия на никель.
Смена мыла, которую он использовал, в сочетании с влагой, скопившейся под его кольцом, вызвала проблему.
Решение этой «аллергии» довольно просто — хорошо высушить руки после мытья и нанесения крема для рук или других косметических средств, которые могут вызвать сыпь и раздражение кожи в сочетании с металлом украшений, которые вы носите.
Почему производители ювелирных изделий используют никель?
Если никелевый сплав довольно токсичен для нас, и мы действительно получаем его из пищи, воды и даже воздуха.Почему так много производителей ювелирных изделий используют никель?
Ответ на этот вопрос довольно прост: конечно, снизить производственные затраты! Они хотят сэкономить.


