Изготовление концентрированной серной кислоты. В домашних условиях | Андрей Ухватов
Как вы знаете, я увлекся добычей золота и других драгметаллов из разной электроники. А для этого помимо самих золотосодержащих компонентов потребуются некоторые химические реактивы. На начальном этапе я решил не тратиться на их покупку, а постараюсь их синтезировать самостоятельно.
Причем хотелось бы обойтись без специальных химреактивов и химической посуды, чтобы все, что я делаю мог повторить любой человек. Ранее я уже писал, как я изготовил свой первый реактив, это был железный купорос:
- Добываю железный купорос. Вещество способное осадить золото из раствора царской водки
А сегодня я расскажу, как можно в домашних условиях приготовить концентрированную серную кислоту, которая понадобиться мне для изготовления других двух кислот, соляной и азотной. А из этих двух кислот, как вы знаете готовиться царская водка.
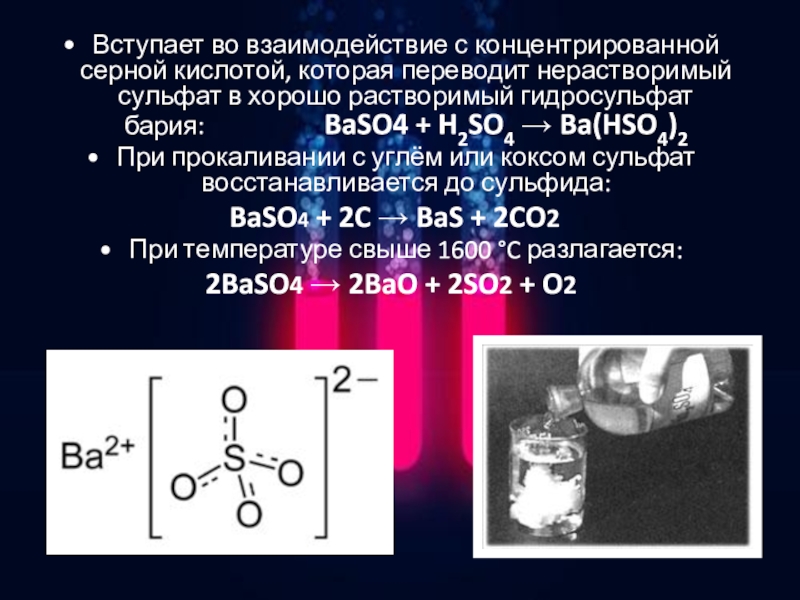
Пятилитровая банка аккумуляторного электролитаДля нашего опыта нам потребуется аккумуляторной электролит, который продается в любом автомобильном магазине. Я купил сразу банку на 5 литров с плотностью 1,28 г/см3 (что соответствует примерно концентрации 36% ). Как наверное все знают, электролит представляет собой разбавленную серную кислоту.
Я купил сразу банку на 5 литров с плотностью 1,28 г/см3 (что соответствует примерно концентрации 36% ). Как наверное все знают, электролит представляет собой разбавленную серную кислоту.
И для того, чтобы получить более концентрированную кислоту, нам нужно постараться выпарить из нее всю воду. А зная ее начальную концентрацию в 36%, понятно, что нужно упарить электролит примерно в 3 раза.
Далее, нам потребуется стеклянная банка для выпаривания воды из электролита. Я взял пустую баночку из под растворимого кофе. Затем, необходимо нанести разметку на эту баночку используя какой-нибудь мерный стаканчик.
Я наклеил белые стикеры на банку и сделал отметки, указывающие на объем жидкостиЯ наклеил белые стикеры на банку и сделал отметки, указывающие на объем жидкостиТак как нам нужно будет упарить раствор примерно в три раза, я нанес 3 отметки с шагом в 200 мл (см3). Далее я налил 600 мл (см3) нашего электролита.
Набрал в баночку 600 мл электролитаНабрал в баночку 600 мл электролитаПодготовил электроплитку. Вынес ее на балкон, чтобы не заниматься химией в квартире. Поставил на плитку ненужную кастрюлю, на тот случай если банка от нагрева лопнет, так банка сделана из обычного стекла и не предназначена для сильного нагревания, в отличии от специальной химической посуды.
Вынес ее на балкон, чтобы не заниматься химией в квартире. Поставил на плитку ненужную кастрюлю, на тот случай если банка от нагрева лопнет, так банка сделана из обычного стекла и не предназначена для сильного нагревания, в отличии от специальной химической посуды.
Внутрь кастрюли насыпал небольшой слой обычного речного песка для того, чтобы нагрев происходил как можно медленнее и равномернее.
Поместил внутрь кастрюли свою баночку с электролитом и включил плитку на максимум.
Само выпаривание длиться достаточно долго. Я точно не засекал, но это порядка 4-6 часов. И после того, как наша кислота выпарилась примерно до 200 мл (см3), выключаем плитку и даем нашей баночке остыть. После чего, можно перелить нашу концентрированную серную кислоту в подходящую стеклянную бутылочку.
Переливаю концентрированную серную кислоту в бутылочкуЧтобы проверить какая же реально концентрация серной кислоты получилась в нашем опыте, я взял кухонные весы и взвесил 100 мл (см3) нашей кислоты, отмеряя ее объем 60 кубовым шприцем. У меня получилось, что 100 мл (см3) жидкости весит 167 гр. Это означает, что плотность нашей кислоты составила 1,67 гр/см3, что соответствует примерно 76% концентрации, что довольно не плохо.
У меня получилось, что 100 мл (см3) жидкости весит 167 гр. Это означает, что плотность нашей кислоты составила 1,67 гр/см3, что соответствует примерно 76% концентрации, что довольно не плохо.
Выпарить кислоту большей концентрации было бы гораздо сложнее, т.к. чем концентрированней кислота, тем сложнее она отдает воду. Но для наших дальнейших опытов такая кислота вполне подходит, поэтому закроем нашу бутылочку и уберем ее на хранение.
Бутылочка с нашей концентрированной кислотой
Бутылочка для хранения нашей концентрированной кислотыБутылочка для хранения нашей концентрированной кислотыА на этом пока все. Всем спасибо за внимание. Кому понравилось, не ленитесь, поставьте лайк. И подпишитесь на мой канал, если по какой-то причине вы еще не подписаны. Дальше я буду изготавливать соляную и азотную кислоты. Приготовлю царскую водку и растворять в ней золото. Я думаю все это будет крайне интересно. До встречи в следующей статье.
До встречи в следующей статье.
А вот небольшой видеоролик, о том как происходил весь процесс подготовки и выпаривания кислоты.
Какую кислоту заливают в аккумулятор
Большинство водителей никогда в жизни не задумывались, какую кислоту добавляют в аккумулятор авто и зачастую высказывают неправильные догадки. Одни скажут, что там вода, другие назовут соляную кислоту, поэтому мы расставим все точки над «и». В аккумуляторах применяется смесь серной кислоты и дист. воды. Знакомьтесь, это электролит.
На практике встречаются устройства, где в роли электролита выступает щелочь (никель-кадмиевые аккумуляторы). Также есть несколько гелевых устройств, но по факту гель – это та же самая кислота, находящаяся в другом состоянии или пропитывающий стекловолоконные частицы.
Она применяется в промышленном изготовлении АКБ для авто. Обычно, электролит — это 35% серной кислоты и 65% дист. воды. Заливать любую другую воду категорически запрещается, поскольку она содержит соли, которые существенно сократят срок работы АКБ.
Обычно, электролит — это 35% серной кислоты и 65% дист. воды. Заливать любую другую воду категорически запрещается, поскольку она содержит соли, которые существенно сократят срок работы АКБ.
Концентрированная серная кислота производится в 2 стадии. В первой её концентрацию доводят до 65-70%, а во второй – до 98%. Это необходимо для того, чтобы увеличить срок хранения кислоты. Вероятно даже повышение концентрации до 99%, но из-за потерь SO3 значение все равно будет снижено до 98 процентов.
Как сделать электролит в домашних условиях?
Рекомендуем купить его в магазине, но его можно сделать и своими руками.
Нам потребуются:
- Дистиллированная вода;
- Серная кислота;
- Емкость из стекла, керамики или свинца, устойчивая к кислотам;
- Эбонитовая палочка.
Чтобы сделать электролит надо залить воду в специальную емкость и добавить туда серную кислоту в пропорции 3:1.
Необходимо сказать, что превышения в допустимой концентрации электролита может привести к самым неприятным последствиям. От чрезмерно концентрированного вещества пластины аккумулятора очень быстро «разъест», что в кратчайшие сроки вызовет выход аккумулятора из рабочего состояния.
В дист вода добавляем кислоту, а не наоборотА вот слишком низкий уровень плотности вещества может очень быстро вызывать сульфатацию. Наверняка вы знаете, что это такое. Нет? Это процесс оседания кристаллических осадков на пластинах, в результате чего аккумулятор теряет свои свойства и просто оказывается неспособным держать заряд долгое время.
Зачем нужен электролит?
Суть работы АКБ базируется на реакциях, проходящих только при помощи этого вещества. Батарея состоит из плюсовых и минусовых пластинок, погружаемых в кислотный раствор. Эти пластины оснащены токоотводными решетками, сделанными из свинца.
Эти пластины оснащены токоотводными решетками, сделанными из свинца.
Как проконтролировать состояние электролита?
Держать под контролем состояние электролита нужно. Для контроля сгодится пластмассовый корпус от обычной пластиковой ручки. Открываем пробки и погружаем его к пластинам, после чего зажимаем сверху и вынуть. Идеальный уровень – 10-12 мм. Если надо, дольем электролит.
Очень важно следить за временем года и параметрами раствора в соответствии с ним. Можно существенно продлить жизнь батареи, если использовать растворы с разными параметрами в разное время. К примеру, слишком концентрированное вещество в летнее время деструктивно воздействует на АКБ. Высокая плотность увеличивает энергопотери, а серный ангидрид может полностью разрушить электроды устройства.
Срок эксплуатации электролита
У такого электролита нет срока эксплуатации. Данный критерий может быть определен только по способности выполнения своих функций на 100%.
- Плотность;
- Температуру работы аккумулятора;
- Заряд.
Если все показатели в норме, то и электролит не будет тревожить Вас годами.
Как увеличить плотность вещества?
Увеличить плотность можно при повышении температуры и гидролиза. Также важно постоянно добавлять дистиллят для поддержания показателей на нормальном уровне. Если же концентрация кислоты ниже 1,275 грамм на сантиметр кубический, её нужно поднять.
Повысить такой уровень можно 2-мя способами: сменой содержимого или доливом концентрированной кислоты.
Если разбавлять жидкость, то необходимо совершить определенные действия для всех банок:
- Откачать максимум электролита при помощи шприца;
- Внести в банку половину от его объема;
- Подать нагрузку с низкой мощностью для смешивания жидкости.

- Если изменений в уровне нет, добавляем во вторую половину электролит и получаем идеальную плотность.
Кислота – вредная субстанция для кожи. Использование резиновых перчаток, фартука и защитных очков при работе с этим веществом категорически обязательно!
Как заливать и доливать кислоту?
Электролит заливается при помощи трубки до 15 мм над пластинками батареи. Затем оставляем аккумулятор на 2 часа для остывания и заряжаем током в 10 раз меньшим от объема АКБ.
Ключевые характеристики надо проверять пару раз в году с помощью особого прибора и не пропускать проверки.
При смешивании дистводы с кислотой, важно добавлять именно кислоту в воду, так как в обратном случае есть вероятность активации бурной реакции вещества с тепловыделением, доведением её до состояния кипения.
Внимательно соблюдайте все вышеперечисленные рекомендации и АКБ будет служить очень долгое время!
Сдать старый АКБ за деньги вы сможете в нашей фирме, тарифы на приём акумуляторов на этой странице.
Приготовление электролита для аккумуляторов своими руками
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Что такое электролит?
Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.

Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора | Количество твёрдой щелочи равняется количеству электролита, разделенному на |
1,17–1,19 г/см³ | 5 |
1,19–1,21 г/см³ | 3 |
1,25–1,27 г/см³ | 2 |
- Влейте в посуду дистиллированную воду.

- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Соляная кислота « Попаданцев.нет
Соляная кислота HCl — штука нужная.
Во-первых как электролит (для гальваники в том числе), во-вторых как хлорсодержащее сырье, в третьих — разные краски, клеи, активированный уголь, обработка кожи, в конце концов — для удаления накипи из паровых котлов.
Тут даже тяжело вспомнить для чего она еще применяется.
В любом случае — попаданцу ее получать придется.
Мы сейчас не будем рассматривать два современные способа получения соляной кислоты — сжиганием хлора в водороде и абгазную, получаемую их побочных газов при хлорировании углеводородов.
Мы рассмотрим две другие методики, куда как более древние…
Первый метод появился где-то в районе 12-13 века. Существует легенда, что первым этот метод открыл арабский алхимик Джабир ибн Хайян в начале 9-го века.
Метод относительно несложный, для него нужна поваренная соль и железный купорос.
Нужно их смешать и прокалить в реторте. Происходит химическая реакция и выделяется газообразная соляная кислота:
FeSO4∙7H2O + 4NaCl = 4HCl↑ + 2FeO + Na2SO4 + 10Н2О↑.
Эту газообразную кислоту нужно было пропустить через воду и получить классическую соляную кислоту.
Следует помнить, что растворимость соляной кислоты ограничена температурой воды. При обычной комнатной температуре концентрация кислоты будет порядка 30%.
И не нужно забывать, что поглощение газообразной кислоты водой — процесс экзотермический, поэтом вода будет греться.
Собственно, тут нужно следить за процессом — как только пузырьки газообразной кислоты свободно проходят через воду, не растворяясь в ней — достигнута максимальная концентрация. Вот только таким методом этой концентрации в 30% достичь очень сложно, кислота будет слабой.
Если вы попали в средневековье после 12 века и не хотите возиться с самостоятельным получением соляной кислоты, то ее можно купить. Эту реакцию проводили в аптеках и соляная кислота называлась «дух из солей» (spiritus salis), или «кислый спирт». Естественно, в больших количествах вам ее не купить, но если нужно немного на электролит — то вполне. Следует только помнить, что метод этот дает море примесей в кислоте.
Следует только помнить, что метод этот дает море примесей в кислоте.
Второй метод дает соляную кислоту куда более чистую. Он разработан алхимиком Иоганном Рудольфом Глаубером примерно в 1649 году. Для производства нужна поваренная соль и серная кислота.
Серная кислота реагирует с поваренной солью при повышенной температуре, порядка 150oC, хотя сразу после заливки серной кислоты процесс понемногу пойдет:
2NaCl + H2SO4 = 2HCl↑ + Na2SO4.
Серную кислоту желательно брать как можно более концентрированную, потому как выделяющийся хлороводород сначала будет растворятся в этой воде, что в серной кислоте — а только потом выделяться. В общем — чем меньше воды, тем лучше.
Кислоты и соли желательно брать 1:1.
Помните — выделяемый HCl токсичен, сейчас подобные реакции проводят только в противогазах. Есть риск сжечь органы дыхания, да и зубы посыпятся. А когда концентрация кислоты в воде станет максимальной, то газ будет проходить через воду насквозь и наверняка выделяться наружу. Да и весь процесс — на редкость горячий и ядовитый.
Да и весь процесс — на редкость горячий и ядовитый.
Однако, именно по глауберовскому процессу много столетий получали соляную кислоту. В России это начали делать с 1790 года и закончили в середине 20-го века. Это показатель эффективности процесса и качества получаемого результата.
P.S. Я честно пытался найти более простой способ получение соляной кислоты, который не знали в древности (все-таки это дорогие методы для средневековья). Мне не удалось. 🙁
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.

А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмонияНа самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся.
 «Едкость» на фоне гидроксидов натрия и калия — так себе.
«Едкость» на фоне гидроксидов натрия и калия — так себе.Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.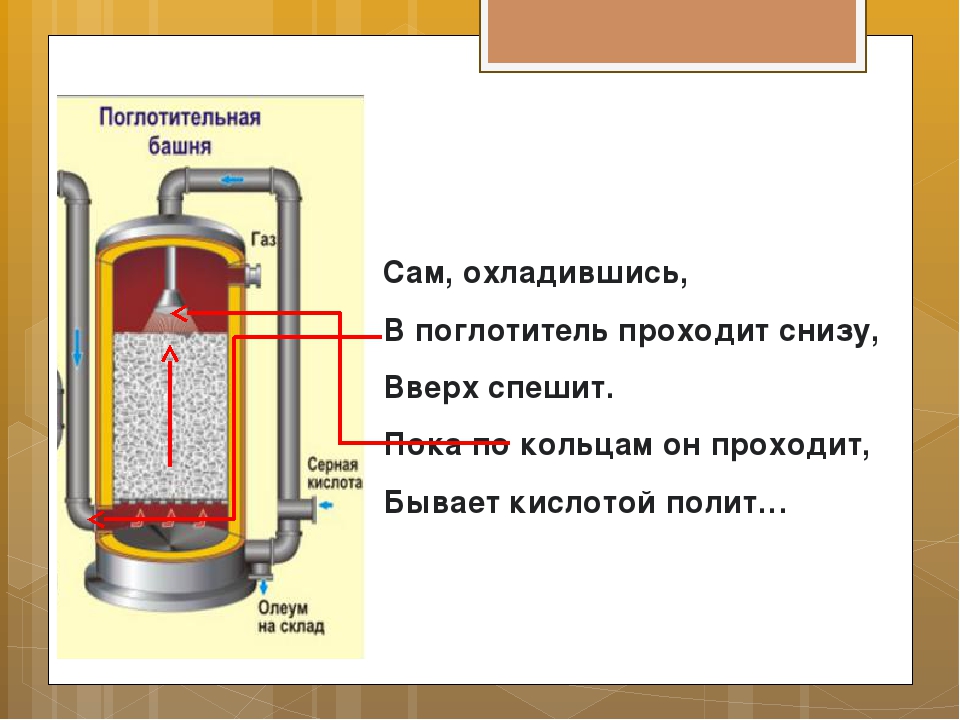
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте.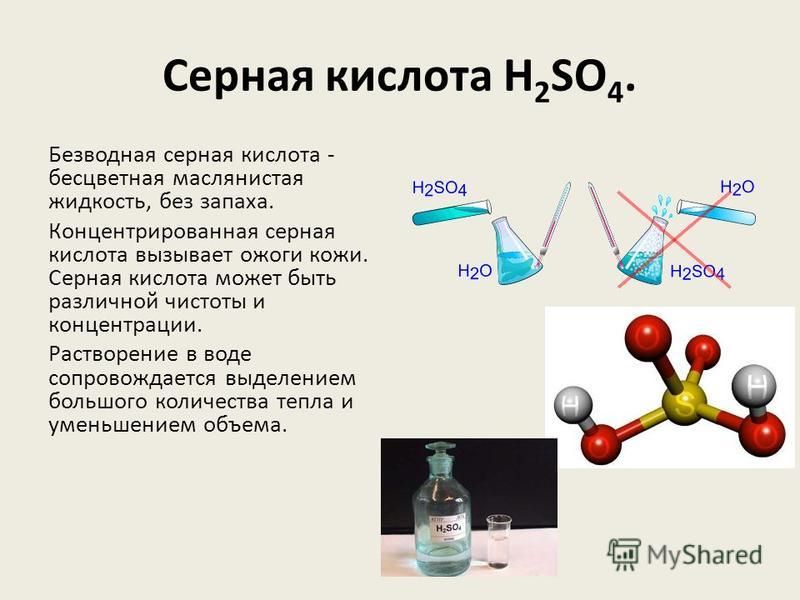 По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод).
 Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах.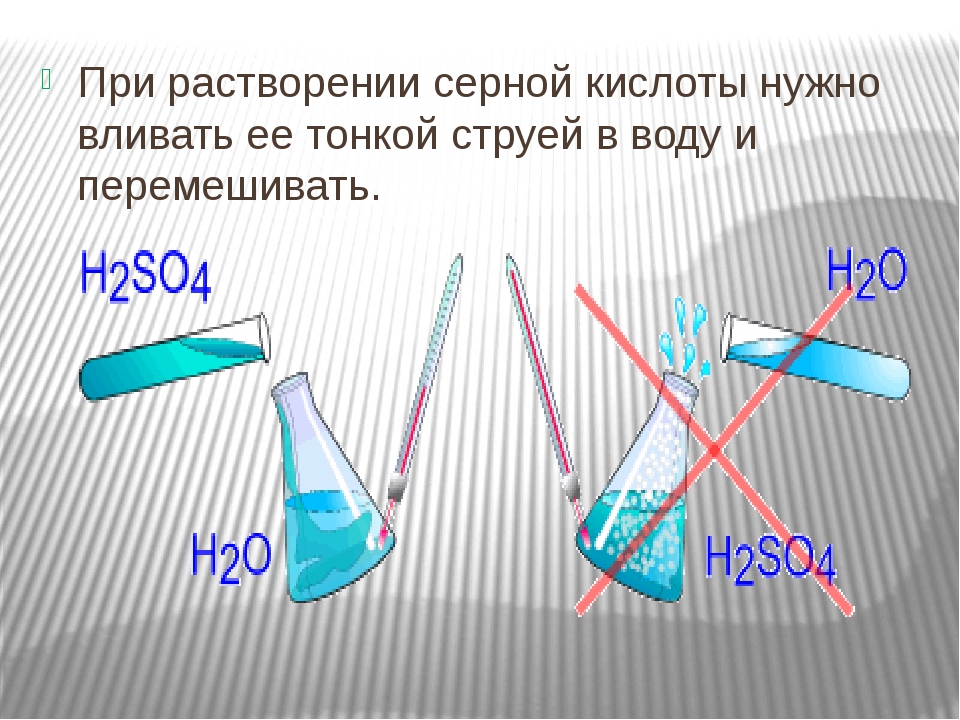 Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.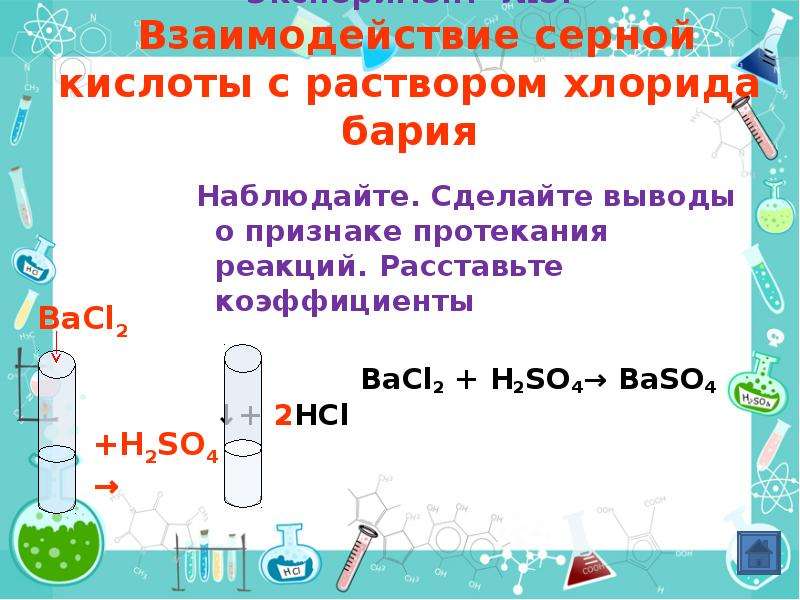
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню.Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном.
Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.

Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13.
 Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры — фторсерная и хлорсерная кислотыУ фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.

Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.

А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красоткаЭто — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат нат
Профилактика чесотки
Чесотка – чрезвычайно заразное паразитарное заболевание, причиной которого является чесоточный клещ.
Заражение происходит в случае длительного телесного контакта с кожей заболевшего. Чаще всего это случается в тесных коллективах: детские сады, общежития, больничные палаты, армейские казармы и т.д. Крайне высок риск заражения внутри семьи.
Чаще всего это случается в тесных коллективах: детские сады, общежития, больничные палаты, армейские казармы и т.д. Крайне высок риск заражения внутри семьи.
Пути заражения чесоткой:
1.Контакт с кожей больного, который возможен: при некоторых видах спорта, у детей во время игры, во время сна в одной постели, при частых и длительных рукопожатиях.
2.Через личные вещи заболевшего: постельное белье, полотенце, одежда и т.д. Такой путь заражения бывает крайне редко, т.к. клещи неустойчивы во внешней среде.
Процесс заражения заключается в переносе женских особей и личинок от больного человека к здоровому. Мужские особи заразными не являются и нужны только для оплодотворения.
Многих волнует вопрос: можно ли заразиться чесоткой от животных, например, от всеми любимых собак и кошек? Ответ здесь неоднозначный. На животных (кошки, собаки, коровы, овцы, козы) паразитируют клещи другого вида, которые, попав на поверхность кожи человека, вскоре погибают. Но они могут вызвать зуд и высыпания (такое состояние называется псевдосаркоптоз или псевдочесотка). Лечение в данном случае не требуется. Необходимо лишь обработать больное животное либо прекратить с ним контактировать.
Лечение в данном случае не требуется. Необходимо лишь обработать больное животное либо прекратить с ним контактировать.
При процессе заражения оплодотворенная самка клеща, попадая на кожу, внедряется в нее и начинает проделывать чесоточные ходы, где откладывает яйца. Спустя 2-3 дня из них вылупляются личинки. Через 10-14 дней из личинок вырастают половозрелые особи.
Активность клещи проявляют в вечернее и ночное время, это определяет особенности симптоматики болезни. Инкубационный период заболевания может быть разным. В некоторых случаях он составляет всего несколько часов (при заражении взрослой особью), в других первые признаки могут появиться спустя 2 недели (при заражении личинками).
Различают несколько форм чесотки, каждая из которых имеет свои особенности:
1. Типичная – характеризуется триадой симптомов:
— зуд – появляется на начальной стадии болезни. Он возникает вследствие активности клеща, а также является результатом иммунного ответа организма (аллергической реакции) на паразита и продукты его жизнедеятельности (слюна, экскременты, яйца). Зуд беспокоит человека, как правило, в вечерние и ночные часы, когда клещ активизируется. Иногда он бывает очень сильным, и человек не спит ночами;
Зуд беспокоит человека, как правило, в вечерние и ночные часы, когда клещ активизируется. Иногда он бывает очень сильным, и человек не спит ночами;
— сыпь – представляет собой узелки красноватого цвета, расположенные изолированно или слившиеся друг с другом. Со временем из узелков образуются пузырьки. Они вскрываются, и на их месте появляются кровянистые или гнойные корочки;
— чесоточные ходы – наиболее характерный признак заболевания. При отшелушивании кожи ходы видны невооруженным глазом и похожи на царапины белесовато-серого цвета. Чаще всего они локализуются на участках с толстым слоем эпидермиса: на кистях рук и стопах.
2. Чесотка «Инкогнито» — возникает у людей, которые часто моются. Симптомы в этом случае такие же, как при типичной форме, но выражены намного слабее.
3. Норвежская (корковая) чесотка – самая заразная форма. Для нее характерно появление корок на коже, которые, утолщаясь и сливаясь друг с другом, формируют своеобразный панцирь. В корках находится огромное количество клещей.
4. Осложненная чесотка. Заболевание может сопровождаться:
дерматитом; крапивницей; фурункулезом; абсцессами и флегмонами мягких тканей. Клиническая картина чесотки в этом случае определяется симптомами конкретного осложнения.
5. Чесотка без ходов. Развивается, когда заражение происходит не взрослыми особями, а личинками. На коже имеются единичные бугорки, пузырьки, человек ощущает сильный зуд
Чесотку нередко путают с укусами клопов, блох, клещей, с проявлениями экземы, крапивницы или опоясывающего лишая. Для того чтобы отличить чесотку от других патологий, нужно запомнить характерные ее особенности:
— зуд вечером и ночью;
— типичные места высыпаний: на ладони, на запястье, на животе;
— зуд носит групповой характер;
— на коже заметны чесоточные ходы (не всегда).
Для диагностики врач проводит внешний осмотр тела пациента. При постановке диагноза принимаются во внимание похожие симптомы у всех контактировавших с заболевшим. В сомнительных случаях проводится лабораторная диагностика: для выявления чесоточных ходов их подкрашивают зеленкой, метиленовым синим или раствором йода; для обнаружения взрослых особей может применяться метод извлечения клеща при помощи стерильной иглы с последующим изучением его под микроскопом; для подтверждения диагноза делают соскоб с кожи, предварительно размягченной 40% молочной кислотой. При его микроскопировании выявляют элементы клеща и продукты его жизнедеятельности.
В сомнительных случаях проводится лабораторная диагностика: для выявления чесоточных ходов их подкрашивают зеленкой, метиленовым синим или раствором йода; для обнаружения взрослых особей может применяться метод извлечения клеща при помощи стерильной иглы с последующим изучением его под микроскопом; для подтверждения диагноза делают соскоб с кожи, предварительно размягченной 40% молочной кислотой. При его микроскопировании выявляют элементы клеща и продукты его жизнедеятельности.
Для эффективного лечения чесотки необходимо соблюдать некоторые правила:
— лечить заболевшего и всех, кто контактировал с ним;
— контактировавшим провести однократную обработку препаратом в вечернее время; взрослые должны обработать все участки тела, за исключением лица и головы;
— постельное белье и одежду заменить после проведенного лечения;
— мыться с мылом необходимо до обработки и через 4 дня после нее;
— наносить препараты следует на 12 часов.
Для лечения чесотки используют специальные препараты:
*Серная мазь: обладает кератолитическим (отшелушивающим) действием, устраняет возбудителя чесотки в течение недели. Но у нее есть недостатки:
Но у нее есть недостатки:
оставляет жирные следы на одежде; имеет неприятный запах; плохо впитывается в кожу; необходимо наносить мазь в течение 5 дней; противопоказана при беременности.
*Бензилбензоат — выпускается в виде мази 20% (для взрослых) и 10% (для детей) и эмульсии — обладает противопаразитарным, кератолитическим и анестезирующим действием; не действует на яйца клещей, поэтому необходима повторная обработка; быстро и полностью впитывается, не оставляя следов на одежде; может привести к развитию дерматита;
при беременности и кормлении грудью использовать препарат запрещено;
следует соблюдать осторожность при обработке детей младше 3 лет.
*Медифокс – выпускается в виде мази крема лосьона и спрея. Препарат не наносится на лицо и волосистую часть головы. Его не применяют у кормящих женщин и грудных детей.
*Спрегаль (аэрозоль) – одно из наиболее эффективных средств. К достоинствам препарата следует отнести следующие положения: он содержит нейротоксичный яд для насекомых и эффективно уничтожает даже яйца клеща; для должного эффекта достаточно одной обработки; практически не имеет запаха и не оставляет на одежде следов; разрешен к применению во время беременности и для детей.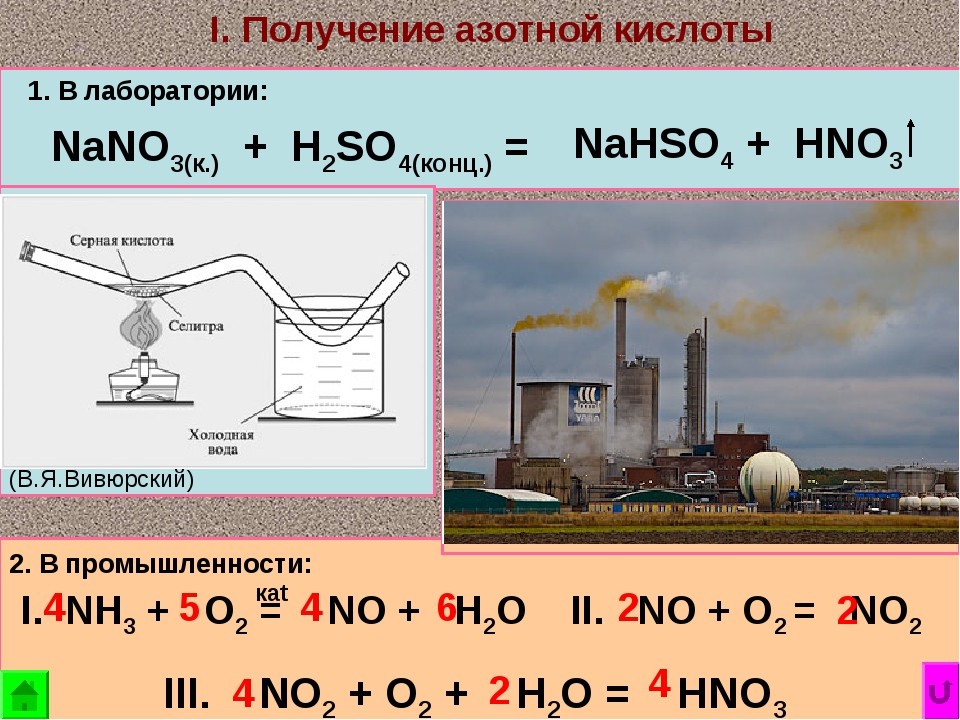
При развитии осложнений чесотки применяются антибиотики (перорально или местно), антигистаминные препараты и гормональные мази.
Чесоточный клещ вне кожи человека живет очень недолго – около 5 дней. В сухих и горячих условиях (при температуре 60 градусов) он погибает в течение часа, а при температуре ниже 0 либо кипячении – практически сразу. На этой особенности и основаны способы дезинфекции при чесотке:
нательное и постельное белье, полотенца кипятят в 1-2% содовом растворе в течение 5-10 минут с момента закипания; одежду, которую кипятить нельзя, проглаживают утюгом с отпаривателем с обеих сторон; верхнюю одежду, а также подушки, матрасы, одеяла помещают на открытый воздух на 5 дней. Зимой для этой цели достаточно одного дня.
В настоящее время для дезинфекции помещений и личных вещей больного применяется препарат «А-ПАР», выпускаемый в виде аэрозоля. Им обрабатывают вещи, которые невозможно прокипятить или погладить: матрасы, подушки, одеяла, верхнюю одежду и т. п. Помимо этого аэрозолем можно обработать помещение – стены, полы, дверные ручки, мебель. Постельные принадлежности должны быть обработаны аэрозолем дважды.
п. Помимо этого аэрозолем можно обработать помещение – стены, полы, дверные ручки, мебель. Постельные принадлежности должны быть обработаны аэрозолем дважды.
Средство не оставляет пятен, поэтому после обработки стирка вещей не нужна, однако использовать их можно спустя 2-3 часа.
Чесотка – заболевание заразное и широко распространенное, но при своевременном проведении всех мероприятий по лечению, профилактике и дезинфекции прогноз благоприятный – излечение наступает в 100% случаев. Будьте внимательны к себе и близким!
КАК ОТМЫТЬ ДУШЕВУЮ КАБИНУ: СОВЕТЫ
Как правильно отмыть душевую кабину? Узнайте быстрые и эффективные способы.
Ванная комната – это место, где каждый из нас проводит меньшую часть времени, оно имеет важный статус одной из самых чистых зон в дом. «Сокровищница чистоты» не только привлекательна для тех, кто хочет уединиться и расслабиться после тяжелого рабочего дня, но также приманка для грязи и бактерий.
Уборка ванной комнаты состоит из нескольких этапов: чистка туалета, раковины и душевой кабины. Эксперты Доместос разобрались с самыми сложным моментами этого процесса и подготовили полезные советы по тому, как правильно отмыть душевую кабину.
Эксперты Доместос разобрались с самыми сложным моментами этого процесса и подготовили полезные советы по тому, как правильно отмыть душевую кабину.
ПРОБЛЕМА НОМЕР 1 – ИЗВЕСТКОВЫЙ НАЛЕТ
Одной из самых распространенных проблем, с которой сталкиваются многие домохозяйки, у которых дома душевые кабины, – это известковый налет. Он образуется на кране, стекле, креплениях душевых дверец, словом, везде, куда попадает вода.
Прежде чем приступить к уборке и покупке моющих средств для душевой кабины, необходимо понять, из какого материала она состоит. Сделав неправильный выбор, вы рискуете повредить поверхность кабины, что приведет к тому, что грязь будет въедаться еще сильнее в появившиеся царапины.
Совет 1: регулярная профилактика
Самый верный способ предотвратить появление налета и возникновение бактерий – это регулярная чистка душевой кабины. Ее рекомендуется проводить каждый раз после того, как вы приняли душ.
Для начала смойте все мыльные остатки горячей водой, чтобы нейтрализовать благоприятную для развития бактерий среду, а потом ополосните ее холодной водой.

Протрите все поверхности насухо чистой мягкой тряпкой.
Для регулярной профилактики в домашних условиях вам не понадобятся моющие средства.
Совет 2: “магическая” губка
Меламиновая губка обладает магическими свойствами и подходит для ежедневной профилактики возникновения известкового налета и для поддержания гигиены в душевой кабине.
Губка не оставляет разводов и не требует использования моющих средств. Она отлично подходит для стеклянных поверхностей в душевой кабине. Ее достаточно намочить и просто протереть загрязнения.
ЧИСТИМ ИЗВЕСТЬ НА СТЕНКАХ КАБИНКИ
Примерно один раз в неделю необходимо осуществлять генеральную очистку душевой кабины, проводя химическую чистку. Эксперты Доместоса предлагают подходит к чистке каждой зоны ответственно. Начинаем уборку с удаления извести на стенках кабинки.
Существует много разных методов удаления известкового налета на стенах в душе. Эксперты Доместос выбрали один народный, который основывается на использовании только натуральных средств, а второй – химический на случай серьезных загрязнений.
Народный метод: лимонная кислота
Лимонная кислота имеет широкое применение: хозяйки добавляют ее в пироги или используют для удаления глубоких загрязнений – такое универсальное средство незаменимо в каждом доме!
На пол-литра горячей воды вам понадобится 100 грамм порошковой лимонной кислоты;
Перелейте раствор в бутылку с распылителем. Нанести средство на загрязнения. Оставьте на несколько минут;
Протрите сухой чистой тканью.
Современный метод: универсальный спрей Domestos
Сегодня рынок химических моющих средств очень большой – там можно найти средства любых запахов и мощности. Спрей универсальный Domestos – это средство, которое подходит для разных поверхностей, и безопасно для здоровья. Он подходит как для уборки в ванной комнате, так и для уборки на кухне.
Спрей достаточно распылить на поверхность с загрязнениями и тут же тщательно протереть тряпкой – он моментально удаляет бактерии и налет. При сильных и глубоких загрязнениях рекомендуется оставить средство на 1 минуту. После смойте средство водой. Если спрей использовался на отдельных участках, например, на кране, то достаточно протереть его влажной тряпкой.
После смойте средство водой. Если спрей использовался на отдельных участках, например, на кране, то достаточно протереть его влажной тряпкой.
ЧИСТИМ ИЗВЕСТКОВЫЙ НАЛЕТ НА СТЕКЛАХ В КАБИНЕ
Многие современные душевые кабинки имеют стеклянные дверцы. На них сразу видны разводы и налет, поэтому они требуют тщательного ухода.
Мыть стеклянные дверцы обычно не составляет никакого труда, если вы правильно выбрали моющее средство, которое не оставляет следов.
Если у вас не оказалось специального средства для стекол, вспоминаем наш первый совет – лимонная кислота…или уксус. При смешивании с водой они становятся менее агрессивными к поверхностям и смогут разъесть такие загрязнения, как налет и известь. Для чистки стекол не подойдут твердые губки – они могут поцарапать его. Лучше всего использовать сухую тряпку.
ЧИСТИМ ПОДДОН
Акрил
Этот материал считается одним из самых нежных и капризных – для него требуется особенный уход. Лучше всего для акриловых поверхностей использовать мягкие губки или ткань, а также жидкие средства, как гель или спрей. Для удаления известкового налета и загрязнений на акриловом поддоне подойдет гель Domestos Антиналет. Он не повредит поверхность, так как не содержит абразивных веществ, которые противопоказаны в этом случае.
Для удаления известкового налета и загрязнений на акриловом поддоне подойдет гель Domestos Антиналет. Он не повредит поверхность, так как не содержит абразивных веществ, которые противопоказаны в этом случае.
Поддон из камня
Если поддон выполнен из натурального камня, то такой материал с годами почти не теряет цвет. Он требует минимального ухода с использованием химических средств. При образовании известкового налета наиболее эффективным способом будет использование пароочистителя, который буквально растопит налет. А потом вы сможете удалить его с помощью обычной сухой тряпки.
Если поддон изготовлен из искусственного камня, то он может потемнеть. Чтобы вернуть материалу его цвет и удалить известковый налет, домохозяйки с опытом иногда рекомендуют использовать средство для унитаза. У Domestos представлено 10 видов гелей для очищения унитазов. Рекомендуем взять самый обычный без дополнительных свойств отбеливания. Универсальное чистящее средство Domestos Лимонная свежесть очистит камень от налета, удалит бактерии, а также придаст приятный запах цитруса.
После проведения процедуры очищения поддон необходимо тщательно промыть водой
Эмалированный поддон
Также при чистке душевой кабины лучше использовать моющие гели, которые не содержат абразивных веществ, способные повредить верхний слой поддона или просто стереть эмалированное покрытие.
ПРОБЛЕМА НОМЕР 2 – ЧЕРНАЯ ПЛЕСЕНЬ
Черная плесень появляется при застаивании воды. Это благоприятная среда для развития и распространения бактерий, в том числе и опасных для здоровья человека.
Помимо черных пятен, которые могут появляться практически на любых поверхностях, черная плесень сопровождается неприятным запахом из душевой кабины.
Со всеми этими проблемами может справиться универсальный гель Domestos: он не только убьет микробы и удалит такие въевшиеся загрязнения, как черная плесень, но и также придаст ванной комнате прекрасный запах. В линейке универсальных средств Domestos есть ароматы свежести Атлантики, лавандового поля, лимона, фруктов и хвои.
Совет 1: поддержание сухости
Первый и главный совет: если вы знаете, что в вашей душевой кабине есть угол, в котором всегда скапливается вода, то просушивайте его после каждого похода в душ.
Также в ванне необходимо установить вытяжку или любые другие источники сухого тепла: теплый пол, обогреватель. Если у вас есть вытяжка, но плесень все же появилась, возможно проблема в ее исправности. Проверить, работает ли вытяжка, можно одним простым способом: поднести лист бумаги к ней, если он втягивается, то вытяжка работает, если нет, то вам необходимо обратиться в компанию, где вы ее заказывали.
Чтобы влага не задерживалась в ванной комнате, необходимо открывать дверь после того, как вы приняли душ.
УДАЛЯЕМ ПЛЕСЕНЬ НА СТЕНКАХ И НА ПОТОЛКЕ ДУШЕВОЙ КАБИНЫ
Чем раньше вы заметите «первые симптомы» появления плесени, тем проще вам будет избавиться от нее. Для борьбы с ней необходим комплексный уход.
Этап подготовки
Для начала вам нужно снизить влажность в ванной комнате;
Заклейте зону появления плесени пленкой, чтобы не позволить ей распространяться.

Для того, чтобы приступить к удалению плесени, вам понадобятся сильные химические средства, поэтому необходимо следовать мерам предосторожности и защитить ваши лицо и руки.
Народный метод: спиртовой уксус, масло чайного дерева и пищевая сода
Иногда для решения задачи, как удалить черную плесень, используют народные средства. Однако стоит помнить, что они могут быть эффективны только на небольших участках. Если вы сталкиваетесь с существенным количеством черной плесени на поверхности – обойтись без химических средств практически невозможно.
Спиртовой уксус не требует разбавления. Нанесите его на заплесневелую поверхность (либо распылите). Не смывайте. Плесень должна начать исчезать постепенно. Перед тем, как будете принимать душ, смойте и высушите это место. Далее продолжайте следить за его сухостью.
Масло чайного дерева необходимо размешать с водой: 2 чайные ложки на 400 мл воды. Нанесите на плесень с помощью тряпки или распылителя. Жидкость должна полностью впитаться. Масло не вредно для человека, потому можно начать пользоваться душем без предварительной уборки.
Масло не вредно для человека, потому можно начать пользоваться душем без предварительной уборки.
Пищевая сода – такое же универсальное средство, как и лимонная кислота. На пол-литра воды вам понадобится 1 столовая ложка соды. Нанесите раствор на поврежденную зону и потрите щеткой. Через 30 минут смойте теплой водой.
Современный способ: универсальный гель Domestos
В состав геля Domestos входит гипохлорит натрия, который обладает мощным воздействием на микроорганизмы. Хлор убивает их и дезинфицирует поверхность, на которой было образование плесени и предотвращает ее дальнейшее появления.
Нанесите гель Domestos свежести Атлантики на пораженную зону и потрите щеткой (для более чувствительных поверхностей, используйте тряпки или мягкие губки). Оставьте средство на 5 минут. Потом смойте водой. Желательно протереть поверхность насухо после обработки. Гель удалит не только черную плесень, но и также придаст вашей ванне приятный запах моря.
Для обработки и удаления черной плесени лучше использовать тряпки, которые вам не жалко будет выкинуть. После прямого контакта с большим количество хлора их следует выбросить или утилизировать.
После прямого контакта с большим количество хлора их следует выбросить или утилизировать.
Рекомендуется провести поверхностную чистку всей душевой кабины после химической обработки пораженного участка.
ПРОБЛЕМА НОМЕР 3 – РЖАВЧИНА
Ржавчина – это то, от чего не застрахован никто, так как она возникает из-за состава воды. Чтобы предотвратить появление ржавчины, также, как и при известковом налете, необходимо проводить регулярную профилактическую чистку душевой кабины.
Народный метод: уксус и поваренная соль
Берем стеклянную емкость. Наливаем туда 100 мл уксуса и добавляем 2 столовых ложки соли.
Хорошенько перемешиваем и ставим в микроволновую печь. Раствор должен нагреться до температуры 65 градусов.
Полученную смесь наносим на мягкую губку и протираем ржавые зоны.
Оставляем средство на 15-20 минут, чтобы жидкость впиталась. Тщательно смываем теплой водой.
В случае если вы не получили желаемый эффект, необходимо повторить процедуру.

Современный способ: гель Доместос Антиржавчина
Чистящее средство Domestos Антиржавчина справляется с плотными образованиями ржавчины и извести на поверхностях в душевой кабине. Основной компонент, который входит в состав моющего средства, – это соляная кислота, которая отлично справляется с ржавчиной.
После нанесения на поврежденную зону его необходимо оставить на 30 минут, чтобы оно впиталось в слой кристаллов налета и разъело его. Для более эффективного действия можно потереть нежесткой щеткой. Смойте средство теплой водой. Если вы не получили желаемого результата или загрязнение было слишком глубоким, то процедуру необходимо повторить.
Как сделать серную кислоту дома?
Серная кислота — это полезная кислота, которую нужно иметь под рукой для различных проектов в области домашней химии. Однако получить его непросто. К счастью, вы можете сделать это самостоятельно.Самодельные материалы на основе серной кислоты
На самом деле, этот метод начинается с разбавленной серной кислоты, которую вы кипятите, чтобы получить концентрированную серную кислоту.
 Это самый безопасный и простой способ приготовления серной кислоты в домашних условиях.
Это самый безопасный и простой способ приготовления серной кислоты в домашних условиях. - автомобильный аккумулятор кислотный
- стеклянная тара
- уличный источник тепла типа гриля
Самый безопасный метод
Если вы никуда не торопитесь, вы можете сконцентрировать серную кислоту, позволив воде испариться естественным образом. На это уходит несколько дней.
1. Поместите открытую емкость с серной кислотой в место с хорошей циркуляцией, защищенное от возможного разлива.
2. Неплотно накройте контейнер, чтобы свести к минимуму загрязнение пылью и другими твердыми частицами.
3. Подождите. Вода испарится из раствора, и в конечном итоге останется концентрированная серная кислота.
Обратите внимание, что серная кислота очень гигроскопична, поэтому она будет удерживать определенное количество воды. Вам нужно будет нагреть жидкость, чтобы удалить оставшуюся воду.
Самый быстрый метод
Самый быстрый метод концентрирования серной кислоты — это кипячение воды из кислоты.Это быстро, но требует особой осторожности. Лучше делать это на открытом воздухе, чтобы не подвергаться воздействию кислотных паров, используя боросиликатное стекло (например, Pyrex или Kimax). Всегда существует риск разбить стеклянный контейнер, независимо от того, что вы нагреваете, поэтому вы должны быть готовы к такой возможности. Не оставляйте этот проект без внимания!1. Нагрейте аккумуляторную кислоту в емкости из боросиликатного стекла.
2. Когда уровень жидкости перестанет падать, вы сконцентрируете кислоту настолько, насколько сможете.В этот момент пар также будет заменен белым паром. Будьте осторожны, чтобы не вдыхать пары. Читать далее ..
Будьте осторожны, чтобы не вдыхать пары. Читать далее ..
Серная кислота — Sciencemadness Wiki
Серная кислота (альтернативное написание серная кислота ), представленная молекулярной формулой H 2 SO 4 , является одной из самых важных кислот в химии и наиболее важной химическая промышленность в мире. Это самая сильная легкодоступная кислота с pK и равным -3.
Недвижимость
Химические свойства
Серная кислота — дипротонная кислота, способная отдавать два протона (H + ). Сначала он диссоциирует с образованием гидроксония и гидросульфата с pKa -3, что указывает на сильную кислоту:
- H 2 SO 4 + H 2 O → H 3 O + HSO 4 —
При второй диссоциации образуется сульфат и другой ион гидроксония из иона гидроксония.Он имеет pKa 1,99, что указывает на кислоту средней силы, и происходит следующим образом:
- HSO 4 — + H 2 O ⇌ H 3 O + + SO 4 2-
Концентрированная серная кислота также оказывает сильное окислительное действие, превращая неметаллы, такие как углерод и сера превращаются в диоксид углерода и диоксид серы, соответственно, восстанавливая серную кислоту до диоксида серы и воды в процессе.
- 2 H 2 SO 4 + C → CO 2 + SO 2 + H 2 O + H 2 SO 4
- 2 H 2 SO 4 + S → 2 SO 2 + H 2 O + H 2 SO 4
Это свойство полезно для получения больших количеств диоксида серы для использования в качестве восстановителя, если вода постоянно удаляется.Тепло ускоряет этот процесс.
Серная кислота достаточно сильна, чтобы протонировать азотную кислоту, образуя ион нитрония, который можно использовать в смеси для нитрования для получения алкилнитратов.
В органической химии серная кислота является наиболее практичной кислотой в большинстве случаев, когда требуется источник ионов H 3 O + , поскольку она вводит наименьшее количество воды. Органические соединения часто легко атакуются нуклеофилами, оставшимися после диссоциации кислот, таких как HCl, после чего остаются ионы Cl — , которые могут легко атаковать многие органические соединения. Однако сульфат-ионы, оставшиеся после диссоциации серной кислоты, гораздо менее реакционноспособны, чем ионы, оставленные большинством кислот, что позволяет протонировать реакционную смесь, не вызывая в большинстве случаев нежелательных побочных реакций.
Однако сульфат-ионы, оставшиеся после диссоциации серной кислоты, гораздо менее реакционноспособны, чем ионы, оставленные большинством кислот, что позволяет протонировать реакционную смесь, не вызывая в большинстве случаев нежелательных побочных реакций.
В концентрированном виде он сильно гигроскопичен и обладает сильными обезвоживающими свойствами. Он может разрушить большинство органических молекул, содержащих группы OH —, чтобы использовать их для образования воды, оставляя только углерод. Это свойство используется в знаменитой демонстрации «черной змеи», где серная кислота обезвоживает сахарозу (столовый сахар), образуя воду с атомами водорода и кислорода и оставляя аморфный углерод.
Физические свойства
Температура кипения h3SO4 VS концентрация Серная кислота — маслянистая жидкость при комнатной температуре. Он бесцветен, но часто имеет очень светло-желтый цвет при небольшом загрязнении железом или углеродом из органических веществ, таких как пыль. Даже очень небольшое количество растворенного органического вещества может изменить цвет концентрированной серной кислоты на бледно-желтый или розовый, красный, коричневый и даже черный. Обычно он продается в разбавленном виде примерно на 35% по весу в качестве кислоты для автомобильного аккумулятора и в концентрации от 95% до 98% по весу в качестве очистителя сточных вод.
Даже очень небольшое количество растворенного органического вещества может изменить цвет концентрированной серной кислоты на бледно-желтый или розовый, красный, коричневый и даже черный. Обычно он продается в разбавленном виде примерно на 35% по весу в качестве кислоты для автомобильного аккумулятора и в концентрации от 95% до 98% по весу в качестве очистителя сточных вод.
Температура кипения серной кислоты повышается с увеличением концентрации, как показано на этом рисунке справа. Азеотроп образуется при 98% мас. / Мас.
При комнатной температуре серная кислота не дымится и не имеет запаха. Известно, что горячая серная кислота обильно дымит и пахнет смесью обожженных спичек и чистой боли (это происходит из-за ее частичного разложения в горячем состоянии; запахи соответствуют диоксиду серы и триоксиду соответственно).
Источники, производство и концентрация
Серная кислота — широко используемый химикат для свинцово-кислотных аккумуляторов и очистки стоков.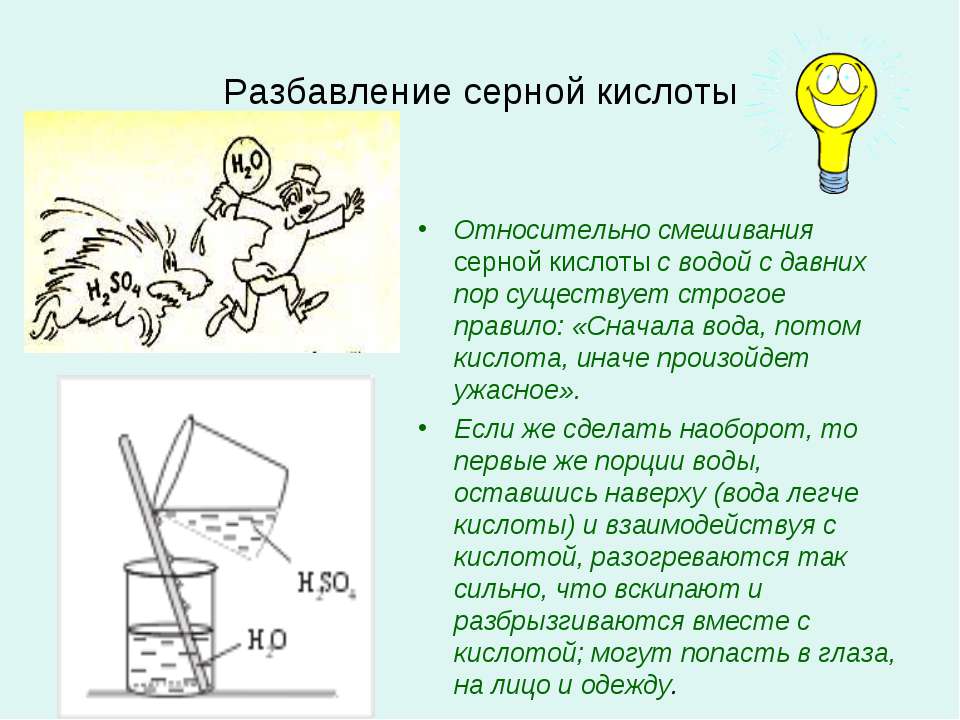 Аккумуляторную кислоту часто можно найти в автомагазинах или универмагах, она составляет примерно 35% серной кислоты по весу. Этого достаточно для большинства химиков-любителей. Если требуется более концентрированная серная кислота, можно поискать в хозяйственных магазинах средство для очистки канализации, которое может содержать более 90% серной кислоты по весу. В целях безопасности эта концентрация серной кислоты может содержать краситель. Другие формы серной кислоты могут быть загрязнены различными химическими веществами и будут иметь желтый, черный или красный цвет.
Аккумуляторную кислоту часто можно найти в автомагазинах или универмагах, она составляет примерно 35% серной кислоты по весу. Этого достаточно для большинства химиков-любителей. Если требуется более концентрированная серная кислота, можно поискать в хозяйственных магазинах средство для очистки канализации, которое может содержать более 90% серной кислоты по весу. В целях безопасности эта концентрация серной кислоты может содержать краситель. Другие формы серной кислоты могут быть загрязнены различными химическими веществами и будут иметь желтый, черный или красный цвет.
Тем не менее, существует по крайней мере одна марка очистителей для сливов, которые содержат ~ 95% серной кислоты без каких-либо добавок красителей.
Некоторым любителям может быть трудно найти концентрированную серную кислоту, поскольку кислотные очистители для слива запрещены (в результате разбрызгивания кислоты или незаконного производства наркотиков) или очень загрязнены в некоторых странах. Итак, здесь мы предоставим краткий список доступных методов получения серной кислоты.
Самый проверенный метод концентрирования серной кислоты описан в подпункте: Кипячение летучей мыши.
- Если у вас серная кислота технической чистоты с концентрацией от 80% до 94%, ее можно превратить в чистое соединение с помощью перегонки Зинтля-Карякина.Этот процесс дает серную кислоту высшего качества и с концентрацией выше азеотропа. Однако это требует больших затрат на стеклянную посуду и очень рискованно, если выполнять ее дома. Для проведения этой перегонки вам понадобится триоксид хрома или дихроматная соль (подойдет любой, , кроме аммония : дихромат аммония разложится при нагревании, и у вас будет зеленая мутная кислота, загрязненная оксидом хрома (III) и сульфатом хрома), которая будет работать как разрушитель азеотропа. Поместите это в круглодонную колбу, налейте кислоту и подключите к конденсатору с воздушным охлаждением.Поместите на колбу теплоизоляцию (асбест, минеральную вату) и начните ее нагревать. Откажитесь от первых нескольких граммов дистиллята, пока его плотность не достигнет 1,84; после этого соберите каждую каплю.
 Это дает чистую серную кислоту с концентрацией выше 98%. Остерегайтесь утечки шестивалентного хрома, это канцероген! Если такая утечка произошла, нейтрализуйте ее любым восстанавливающим раствором, например йодидом калия.
Это дает чистую серную кислоту с концентрацией выше 98%. Остерегайтесь утечки шестивалентного хрома, это канцероген! Если такая утечка произошла, нейтрализуйте ее любым восстанавливающим раствором, например йодидом калия.
Серную кислоту можно дополнительно концентрировать, добавляя триоксид серы, который реагирует с оставшейся водой с образованием чистой серной кислоты.Триоксид серы можно продолжать добавлять в раствор с образованием олеума, который дымится на воздухе с образованием капель серной кислоты. При добавлении серной кислоты и триоксида серы в эквимолярной концентрации образуется пиросерная кислота, которая при комнатной температуре является твердым веществом. Триоксид серы можно легко получить пиролизом сульфата меди (II).
Проектов
Обработка
Безопасность
В то время как серная кислота низкой концентрации относительно безопасна в работе (менее 40% масс.), Концентрированная серная кислота (более 90% масс.) Чрезвычайно коррозионна и опасна. Он не только вызывает химические ожоги, но и вызывает ожоги в результате обезвоживания органических материалов (например, кожи), разрушая молекулы с образованием воды с группами -ОН в них. При работе с концентрированной серной кислотой необходимо соблюдать меры безопасности и прикрывать всю кожу.
Он не только вызывает химические ожоги, но и вызывает ожоги в результате обезвоживания органических материалов (например, кожи), разрушая молекулы с образованием воды с группами -ОН в них. При работе с концентрированной серной кислотой необходимо соблюдать меры безопасности и прикрывать всю кожу.При нагревании серной кислоты важно НЕ ПЕРЕПОЛНЯТЬ КОЛБКУ. Объем концентрированной серной кислоты увеличивается почти на 16% при температуре от 0 до 330 ° C, при переполненной колбе ее содержимое выливается. Кроме того, серная кислота, даже в разбавленном виде, имеет тенденцию биться при кипении, накапливая тепло, время от времени выделяя сильный выброс пара.Использование кипящей щепы уменьшает это явление, но полностью остановить его невозможно. Рекомендуется принять меры для предотвращения разливов, так как адаптер для защиты от брызг с соединением матового стекла является очень удобным вариантом.
Горячая концентрированная серная кислота может разлагаться с образованием диоксида серы и триоксида серы, которые являются токсичными и едкими соответственно. В горячем состоянии он обильно дымит, пары состоят из капель серной кислоты и смеси SOx. Эти пары очень опасны и являются канцерогеном для легких.
В горячем состоянии он обильно дымит, пары состоят из капель серной кислоты и смеси SOx. Эти пары очень опасны и являются канцерогеном для легких.
При переноске стеклянных бутылок с серной кислотой и беспокойстве о том, что они могут разбиться, рекомендуется носить их в (пластиковом) ведре, частично заполненном песком.
Хранилище
Серную кислоту хранить в закрытых флаконах. В то время как стеклянные бутылки, будучи инертными, хороши для хранения концентрированной серной кислоты, концентрированная (80-98%) серная кислота часто хранится в бутылях из полиэтилена (точнее, UDPE или UHDPE), поскольку полиэтилен не является хрупким, поэтому в случае падения бутылка на твердой поверхности, она не расколется и не разбрызгивает конц.серная повсюду. К сожалению, полиэтиленовые бутылки чувствительны к свету и со временем разлагаются под воздействием солнечного света, поэтому их необходимо хранить в темном месте, вдали от УФ-излучения, например в шкафу. Коммерческие полиэтиленовые бутылки, используемые для конц. серные кислоты имеют тенденцию быть окрашенными, что помогает ограничить разложение от яркого света и кислорода. Однако, если вы планируете хранить кислоту более нескольких лет, рекомендуется использовать стеклянные бутылки.
серные кислоты имеют тенденцию быть окрашенными, что помогает ограничить разложение от яркого света и кислорода. Однако, если вы планируете хранить кислоту более нескольких лет, рекомендуется использовать стеклянные бутылки.
Выбытие
Серная кислота может быть нейтрализована любым основанием или карбонатом, предпочтительно гидроксидом или карбонатом кальция.
Концентрированная серная кислота, как и любую концентрированную кислоту, следует сначала сильно разбавить в большом объеме воды, прежде чем нейтрализовать ее основанием. Другой метод — добавить его в кислотоупорный контейнер с крышкой, медленно добавить куски твердого гидроксида / карбоната кальция или бикарбоната натрия и закрыть крышку, чтобы предотвратить разбрызгивание. Подождите, пока он перестанет шипеть, затем продолжайте добавлять, пока он не перестанет реагировать. Будьте осторожны, чем гуще раствор становится, тем сильнее пенится.
Список литературы
Релевантные темы Sciencemadness
Серная кислота — MOTM, май 2008 г.
 Серная кислота — MOTM, май 2008 г. — версия в Jmol
Серная кислота — MOTM, май 2008 г. — версия в JmolОрфография
Если вы хотите, чтобы эта молекула месяца содержала мочевую кислоту sul ph , а не мочевую кислоту sul f , нажмите на знак опасности (справа). Раньше его называли «купоросным маслом». На самом деле было бы даже лучше назвать это серной (VI) кислотой.
Контактный процесс
Серная кислота производится в больших количествах, чем любая другая кислота. Почти каждый производимый предмет в современном мире вступает в контакт с H 2 SO 4 на каком-то этапе своей истории. Это настолько важно, что когда-то годовое производство серной кислоты считалось мерой степени индустриализации страны и снискало ей прозвище «король химикатов».
Серная кислота (H 2 SO 4 ) по-прежнему является чрезвычайно важным химическим веществом, используемым при производстве удобрений и взрывчатых веществ.В настоящее время он производится контактным способом из диоксида серы. Этот процесс взаимодействует вместе с кислородом O 2 и диоксидом серы SO 2 при 450 ° C и давлении 2 атмосферы с помощью оксида ванадия (V) с образованием триоксида серы, SO 3 , газа в 98 % Уступать. Затем его растворяют в воде с образованием H 2 SO 4 . [Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермического характера реакции, в результате чего вместо жидкости образуется коррозионный туман.Вместо этого SO 3 может быть абсорбирован существующим H 2 SO 4 для получения олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты. ]. Исходная реакция для получения SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно. Это стало экономически выгодным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализировал реакцию с использованием оксидов азота посредством промежуточного образования HOSO 2 ONO.
Этот процесс взаимодействует вместе с кислородом O 2 и диоксидом серы SO 2 при 450 ° C и давлении 2 атмосферы с помощью оксида ванадия (V) с образованием триоксида серы, SO 3 , газа в 98 % Уступать. Затем его растворяют в воде с образованием H 2 SO 4 . [Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермического характера реакции, в результате чего вместо жидкости образуется коррозионный туман.Вместо этого SO 3 может быть абсорбирован существующим H 2 SO 4 для получения олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты. ]. Исходная реакция для получения SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно. Это стало экономически выгодным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализировал реакцию с использованием оксидов азота посредством промежуточного образования HOSO 2 ONO. Можно утверждать, что открытие этого процесса послужило катализатором промышленной революции (а также реакции!) В Великобритании, и в результате даже помогло создать Британскую империю!
Можно утверждать, что открытие этого процесса послужило катализатором промышленной революции (а также реакции!) В Великобритании, и в результате даже помогло создать Британскую империю!
Свойства серной кислоты
При комнатной температуре чистая серная кислота (100%) является ковалентной жидкостью. Концентрированная серная кислота 98% (18,7 М) представляет собой маслянистую жидкость с плотностью 1,83 г / см 3 . Он разлагается при своей температуре кипения. (330C) и образует белые пары.
H 2 SO 4 (л) H 2 O (г) + SO 3 (г).
Обратная реакция — это получение серной кислоты.
Для получения информации о безопасности щелкните здесь.
В концентрированном виде имеет несколько важных свойств; кислота, окислитель и дегидратирующий агент, что делает его очень универсальным реагентом. На вкус это не так кисло, как в лаборатории! Он становится синей лакмусовой краской, кроме случаев, когда это ковалентная молекула, , то есть . 100% H 2 SO 4 .
100% H 2 SO 4 .
Концентрированная серная кислота очень гигроскопична.Его сродство к воде настолько велико, что если вы оставите стакан наполовину наполненным конц. H 2 SO 4 в течение трех недель его объем значительно увеличился бы и он стал бы более разбавленным, потому что он поглотил бы так много водяного пара из воздуха.
Тест на серную кислоту (и растворимые сульфаты)
Сначала добавьте разбавленную HNO 3 . Это сделано для предотвращения осаждения других нерастворимых соединений бария, таких как BaCO 3 или BaSO 3 .Во-вторых, добавьте Ba (NO 3 ) 2 (водн.). Если присутствует серная кислота или сульфат, сразу же будет наблюдаться белый осадок.
Ba 2+ (водн.) + SO 4 2- (водн.) BaSO 4 (s) [Белый]
В качестве окислителя
Горячая концентрированная серная кислота является окислителем, когда она принимает электроны. Электроны поставляются восстановителем в реакции:
Электроны поставляются восстановителем в реакции:
2 H 2 SO 4 (водн.) + 2e — SO 4 2- (водн.) + 2 H 2 O (л) + SO 2 (г)
Реакции с металлами
Zn (тв.) + 2 H 2 SO 4 (конц) ZnSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Fe (тв.) + 2 H 2 SO 4 (конц.) FeSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Mg (тв) + 2 H 2 SO 4 (конц) MgSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Cu (т.) + 2 H 2 SO 4 (конц.) CuSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
Реакции с неметаллами
S (т) + 2 H 2 SO 4 (конц) 2 H 2 O (л) + 3 SO 2 (г)
C (т) + 2 H 2 SO 4 (конц) 2 H 2 O (л) + 2 SO 2 (г) + CO 2 (г)
Двуокись серы можно обнаружить с помощью полоски фильтровальной бумаги, смоченной дихроматом калия, цвет которой меняет цвет с оранжевого на зеленый.
Галогенидные соли с конц. серная кислота
Хлориды
Хлориды реагируют только одним способом, независимо от температуры.
NaCl (т.) + H 2 SO 4 (л) HCl (г) + NaHSO 4 (т)
Видны туманные пары хлороводорода. Причина, по которой газообразный хлор не образуется, заключается в том, что серная кислота недостаточно сильна для окисления ионов хлора.
Бромиды
Ионы брома являются более сильным восстановителем, чем ионы хлора. Поскольку ионы бромида больше, чем ионы хлорида, их электроны легче удалить. Бромид-ионы восстанавливают серную кислоту до диоксида серы в два этапа.
NaBr (т) + H 2 SO 4 (л) HBr (г) + NaHSO 4 (т)
2 HBr (г) + H 2 SO 4 (л) Br 2 (л) + 2 H 2 O (л) + SO 2 (г)
Йодиды
Иодид-ионы даже крупнее, чем бромид-ионы, а иодид-электроны еще легче удалить. Иодид-ионы восстанавливают концентрированную серную кислоту до газообразного иодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре.
Иодид-ионы восстанавливают концентрированную серную кислоту до газообразного иодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре.
Уравнение 1: 8 HI (г) + H 2 SO 4 (л) 4 I 2 (с) + H 2 S (г) + 4 H 2 O (л)
Уравнение 2: 6 HI (г) + H 2 SO 4 (л) 3 I 2 (с) + S (с) + 3 H 2 O (л)
Уравнение 3: 2 HI (г) + H 2 SO 4 (л) I 2 (с) + SO 2 (г) + H 2 O (л)
Что можно ожидать, если конц.серную кислоту добавляли к твердому йодиду натрия?
- Запах тухлых яиц из-за токсичного H 2 S (уравнение 1)
- Пурпурный пары йода (уравнения 1-3)
- коричневый из-за образования трииодида (I 2 + I — I 3 — )
- Темно-серое твердое вещество йода, конденсирующееся на холодной посуде
Использование серной кислоты
Концентрированная серная кислота очень хорошо удаляет воду из сахаров. Когда элементы воды удаляются из сахарозы, это приводит к черной массе углерода (см. Фото слева и страницу Молекула месяца о глюкозе).
Когда элементы воды удаляются из сахарозы, это приводит к черной массе углерода (см. Фото слева и страницу Молекула месяца о глюкозе).
C 12 H 22 O 11 (s) + n H 2 SO 4 (l) 12 C (s) + 11 H 2 O (l) + n H 2 SO 4 (л)
Серная кислота также может использоваться для дегидратации натриевых солей некоторых карбоновых кислот. Об этом использовании серной кислоты уже упоминалось на странице «Молекула месяца», посвященной монооксиду углерода.Реакции включают протонирование кислотой с последующей дегидратацией.
Реакции серной кислоты
С основаниями
Разбавленная серная кислота нейтрализует основные оксиды или гидроксиды с образованием сульфатных солей и воды. Не забывайте, что серная кислота — сильная кислота (полностью ионизируется в воде).
CuO (т.) + H 2 SO 4 (водн. ) CuSO 4 (водн.) + H 2 O (л)
) CuSO 4 (водн.) + H 2 O (л)
ZnO (т.) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 O (л)
Cu (OH) 2 (s) + H 2 SO 4 (водн.) CuSO4 (водн.) + 2 H 2 O (l)
Zn (OH) 2 (т) + H 2 SO 4 (водн.) ZnSO4 (водн.) + 2 H 2 O (л)
Поскольку серная кислота является двухосновной (ионизируется в две стадии), когда она реагирует с гидроксидом натрия, она может образовывать две возможные соли натрия.Чтобы увидеть, какой из них предпочтителен, необходимо учитывать стехиометрию (количество молей в сбалансированном уравнении) для следующих двух реакций.
2 NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + 2 H 2 O (л)
NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн.) + H 2 O (л)
С карбонатами
Разбавленная серная кислота нейтрализует основные карбонаты с образованием сульфатных солей, воды и углекислого газа, что приводит к вспениванию (как показано на фотографии справа).
Na 2 CO 3 (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + H 2 O (л) + CO 2 ( г)
MgCO 3 (водн.) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 O (л) + CO 2 (г)
Скорость реакции зависит не только от площади поверхности карбоната, концентрации и температуры кислоты, но и от растворимости сульфата.Когда мрамор (CaCO 3 ) реагирует с разбавленной H 2 SO 4 , он сначала шипит, но поскольку сульфат кальция плохо растворяется в воде, как только он образуется в виде осадка на поверхности мрамора, реакция вскоре замедляется.
С металлами
Разбавленная серная кислота реагирует с металлами, имеющими более высокий, чем водород, ряд реакционной способности с образованием сульфатных солей и газообразного водорода. Обратите внимание, что с концентрированной серной кислотой реакции металлов отличаются.
Mg (тв) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 (г)
Zn (т) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 (г)
Fe (тв.) + H 2 SO 4 (водн.) FeSO 4 (водн.) + H 2 (г)
Железо очищается от ржавчины перед покрытием оловом для образования белой жести и цинком для получения гальванизированного железа.
Сульфаты
Наибольшее (80%) использование серной кислоты при производстве сульфатов.
Гипс представляет собой CaSO 4 .2H 2 O и используется для изготовления гипсовых плит и гипсовых слепков (см. Фото справа). Слабительное ‘ эпсомская соль ‘ — это MgSO 4 .7H 2 O, а зеленый купорос — это FeSO 4 .7H 2 O. В 1648 году Глаубер получил серную кислоту путем дистилляции кристаллов этой соли. .Сульфат калия необычен тем, что он кристаллизуется без кристаллизационной воды и имеет формулу K 2 SO 4 . Поскольку серная кислота является двухосновной (дипротонной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси;
.Сульфат калия необычен тем, что он кристаллизуется без кристаллизационной воды и имеет формулу K 2 SO 4 . Поскольку серная кислота является двухосновной (дипротонной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси;
2 NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + H 2 O (л)
NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн.) + H 2 O (л)
Серная кислота в космосе
В 1999 г. твердая (замороженная) серная кислота была обнаружена на спутнике Юпитера, Европе.Ученые даже идентифицировали твердые гидраты серной кислоты, такие как гемитрискаидекагидрат (H 2 SO 4 .6H 2 O).
Сульфирование
Ароматическое сульфирование — это замена H на SO 3 H (группа сульфоновой кислоты). В случае бензола его нужно нагреть концом. H 2 SO 4 в течение 8 часов для получения бензолсульфоновой кислоты.
Эта реакция слишком медленная, и ее нельзя предпринимать, поскольку бензол вызывает лейкоз у детей.
В случае бензола его нужно нагреть концом. H 2 SO 4 в течение 8 часов для получения бензолсульфоновой кислоты.
Эта реакция слишком медленная, и ее нельзя предпринимать, поскольку бензол вызывает лейкоз у детей.
Вместо этого лучше (быстрее и безопаснее) использовать толуол (метилбензол), так как метильная (CH 3 ) группа высвобождает электроны и ускоряет реакцию. Порядок действий: Добавить 30 капель конц. H 2 SO 4 до 12 капель (толуола) в пробирке. Нагрейте, пока метилбензол не растворится в кислотном слое. Вылейте смесь в 30 см 3 холодного насыщенного раствора хлорида натрия. Образуются белые кристаллы метилбензолсульфонатов натрия.Метильная группа орто-пара направляющая.
и наконец …
Даже Барт Симпсон может писать серную кислоту по буквам
Вернуться на страницу «Молекула месяца».
Использование химикатов в качестве эффективных очистителей канализации
ПОЖАЛУЙСТА, ПРОЧИТАЙТЕ: Химические вещества, предлагаемые в этой статье для очистки слива, очень опасны, и перед использованием прочтите все предупреждения на бутылке.Лучше всего носить химически стойкие перчатки, защитные очки и защитную одежду.
Темы обсуждений:
О серной кислоте, используемой в качестве очистителя канализации
Я обнаружил, что серная кислота — лучший очиститель канализации. Серная кислота быстро разъедает бумагу, тряпки, гигиенические салфетки, пищевые отходы и все органические вещества, растапливая лед и разжижая жир. Не используйте серную кислоту для труб из нержавеющей стали, хромированного алюминия или оцинкованной стали. безопасно использовать с пластиковыми трубами.
Серная кислота очень проста в использовании и очищает сток в течение часа, обычно в течение нескольких секунд, если он не забит полностью.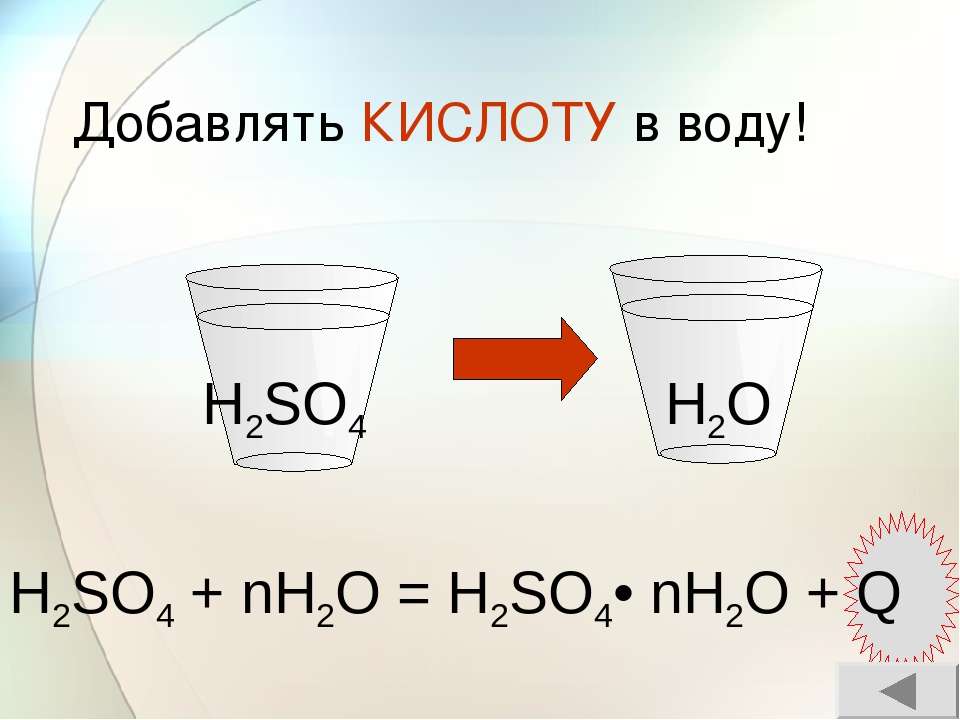 Серная кислота встречается в природе и безопасна для сточных вод и септиков, так как она растворяется в пути по вашим трубам.
Серная кислота встречается в природе и безопасна для сточных вод и септиков, так как она растворяется в пути по вашим трубам.
Наша серная кислота 98%, самая сильная из имеющихся. Более высокие концентрации нестабильны и сами по себе разлагаются до 98%, а оставшиеся 2% — это вода. 98% серная кислота очень агрессивна, поэтому используйте ее с особой осторожностью.При обращении с ним лучше всего надевать химически стойкие перчатки и, желательно, защитные очки и лабораторный халат.
Использование серной кислоты в качестве очистителя канализации
Откройте все окна в комнате, где нужно прочистить слив, чтобы обеспечить надлежащую вентиляцию. При работе с серной кислотой используйте средства индивидуальной защиты (средства защиты). Перед использованием прочтите и усвойте паспорт безопасности материала (MSDS).
Для легких засоров (когда вода все еще проходит, но медленно) медленно вылейте в канализацию около 200 мл серной кислоты. Примерно через 10 секунд нанесите медленную струю воды. Если засор еще не исчез, вы можете выключить воду и оставить ее на более длительный период времени или добавить еще серной кислоты, чтобы ускорить процесс. Обычно 200 мл справятся с любым медленным стоком. После прочистки промойте трубопровод большим количеством воды, чтобы удалить остатки серной кислоты.
Примерно через 10 секунд нанесите медленную струю воды. Если засор еще не исчез, вы можете выключить воду и оставить ее на более длительный период времени или добавить еще серной кислоты, чтобы ускорить процесс. Обычно 200 мл справятся с любым медленным стоком. После прочистки промойте трубопровод большим количеством воды, чтобы удалить остатки серной кислоты.
При сильном засорении медленно нанесите 500 мл (половину литрового флакона) серной кислоты на засорение. Оставьте на час, а затем проверьте, есть ли сливное отверстие, применив воду.Если засор не был удален, нанесите еще 250 или 500 мл серной кислоты и оставьте на час. Если засор сохраняется, продолжайте добавлять серную кислоту. Даже в случае серьезных засоров серная кислота должна устранить их в течение 15 минут. После устранения засора промойте водой.
Общие указания и предостережения при использовании серной кислоты
Не рекомендуется добавлять серную кислоту непосредственно в воду, так как это может вызвать разбрызгивание или разбрызгивание в процессе нейтрализации. Однако хорошая новость заключается в том, что добавление кислоты в воду безопаснее, чем добавление воды в кислоту, поэтому, если она предназначена для использования в унитазе или раковине, наполненной водой, это достаточно безопасно. Обычно при медленном добавлении кислоты образуется лишь немного дыма и очень легкие брызги. Если кислота попадет на кожу, немедленно промойте ее водой. При работе с этой кислотой всегда держите поблизости источник проточной воды.
Однако хорошая новость заключается в том, что добавление кислоты в воду безопаснее, чем добавление воды в кислоту, поэтому, если она предназначена для использования в унитазе или раковине, наполненной водой, это достаточно безопасно. Обычно при медленном добавлении кислоты образуется лишь немного дыма и очень легкие брызги. Если кислота попадет на кожу, немедленно промойте ее водой. При работе с этой кислотой всегда держите поблизости источник проточной воды.
Комбинация воды и серной кислоты вызывает экзотермическую реакцию.Жидкости будут значительно нагреваться, поэтому не добавляйте слишком много за один раз, иначе это может привести к расплавлению труб.
О гидроксиде натрия, используемом в качестве очистителя канализации
Гидроксид натрия когда-то продавался в магазинах как Red Devil Lye, но больше не продается этой компанией. Red Hot Devil Lye, распространяемый Duda Diesel, теперь заменяет красный Devil Lye.
Щелок гидроксида натрия реагирует с жирами и жирами при смешивании с водой с образованием мыла. Это прочная основа и эффективная защита от забитых канализаций. Гидроксид натрия встречается в природе и безопасен для канализаций и септиков, поскольку он растворяется в пути по вашим трубам. Хотя она не так эффективна, как серная кислота, она безопаснее и проще в использовании. Если на коже попадет сухой гидроксид натрия, он не будет гореть, если не будет присутствовать небольшое количество влаги. Просто сразу смойте, и ожоги будут минимальными.
Это прочная основа и эффективная защита от забитых канализаций. Гидроксид натрия встречается в природе и безопасен для канализаций и септиков, поскольку он растворяется в пути по вашим трубам. Хотя она не так эффективна, как серная кислота, она безопаснее и проще в использовании. Если на коже попадет сухой гидроксид натрия, он не будет гореть, если не будет присутствовать небольшое количество влаги. Просто сразу смойте, и ожоги будут минимальными.
Гидроксид калия также можно использовать в сливном отверстии. Он немного дороже, но быстрее растворяется в воде и обычно быстрее очищает сток.Лучше всего, когда стоки сильно забиты.
Не используйте гидроксид натрия с трубами из хромированной алюминия, латуни или оцинкованной стали.
Использование гидроксида натрия в качестве очистителя канализации
Надевайте средства индивидуальной защиты (средства защиты) при работе с гидроксидом натрия. Перед использованием прочтите и усвойте паспорт безопасности материала (MSDS).
Необходимое количество щелока зависит от серьезности засора. Лучше всего добавлять немного гидроксида натрия к пробке, используя воду, чтобы растворить ее в трубопроводе.Если засорение не является серьезным, следует прочистить слив в течение нескольких секунд после заливки его в канализацию с проточной водой. Если засор серьезный, гидроксид натрия необходимо растворить в резервном бассейне с водой и оставить как минимум на час, с добавлением еще немного, если засор не будет очищен достаточно быстро. Иногда для прохождения засора может потребоваться ночь или несколько дней, если используется недостаточно гидроксида натрия или засор очень серьезен.
Количество используемого щелока трудно определить количественно.Обычно, если стоки не слишком засорены, достаточно примерно 1/2 фунта. Сильно забитые стоки могут потребовать до 2 фунтов или более.
Общие примечания и меры предосторожности при использовании щелока в качестве очистителя канализации
Гидроксид натрия при смешивании с водой вызывает экзотермическую реакцию.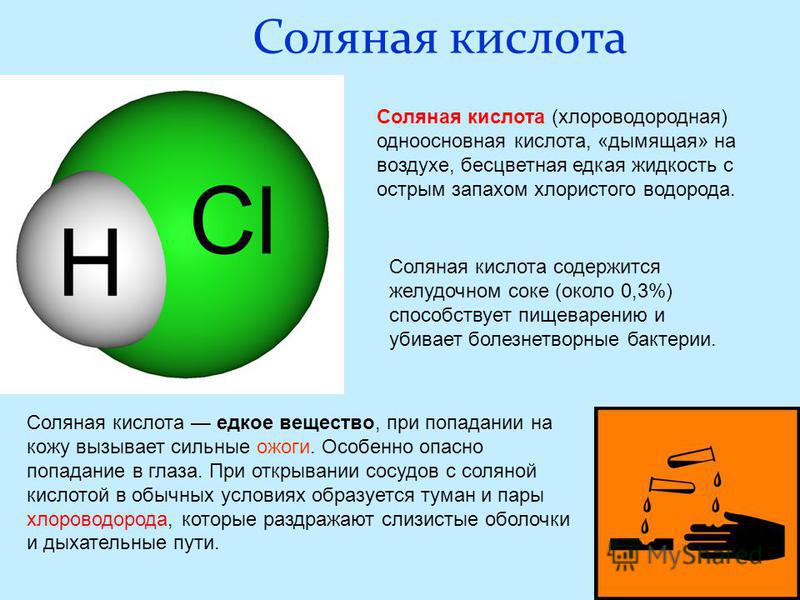 Не добавляйте слишком много щелока сразу, иначе из-за чрезмерного нагрева вода может закипеть или пластиковые трубы расплавятся. Не прикасайтесь к воде, содержащей щелок, так как она оказывает сильное разъедающее действие на кожу.
Не добавляйте слишком много щелока сразу, иначе из-за чрезмерного нагрева вода может закипеть или пластиковые трубы расплавятся. Не прикасайтесь к воде, содержащей щелок, так как она оказывает сильное разъедающее действие на кожу.
Какой тип реакции происходит, когда серная кислота реагирует с щелочью?
Если вы когда-либо смешивали уксус (содержащий уксусную кислоту) и бикарбонат натрия, который является основанием, вы уже видели кислотно-щелочную реакцию или реакцию нейтрализации. Так же, как уксус и пищевая сода, когда серная кислота смешивается с основанием, они нейтрализуют друг друга. Такая реакция называется реакцией нейтрализации.
Характеристики
Химики определяют кислоты и основания тремя разными способами, но наиболее полезное повседневное определение описывает кислоту как вещество, которое хочет отдавать ионы водорода, в то время как основание хочет их улавливать.Сильные кислоты лучше отдают свои ионы водорода, а серная кислота определенно является сильной кислотой, поэтому, когда она находится в воде, она почти полностью депротонирована — практически все молекулы серной кислоты отдали оба своих иона водорода. Эти пожертвованные ионы водорода принимаются молекулами воды, которые становятся ионами гидроксония. Формула иона гидроксония h4O +.
Эти пожертвованные ионы водорода принимаются молекулами воды, которые становятся ионами гидроксония. Формула иона гидроксония h4O +.
Реакция
Когда к серной кислоте добавляют основание или щелочной раствор, кислота и основание реагируют, нейтрализуя друг друга.Основные частицы отбирают ионы водорода у молекул воды, поэтому они имеют высокую концентрацию гидроксид-ионов. Ионы гидроксида и гидроксония вступают в реакцию с образованием молекул воды, в результате чего остается соль (продукт кислотно-щелочной реакции). Поскольку серная кислота — сильная кислота, может произойти одно из двух. Если основание представляет собой сильное основание, такое как гидроксид калия, полученная соль (например, сульфат калия) не будет нейтральной, другими словами, ни кислотой, ни основанием. Однако если основание представляет собой слабое основание, такое как аммиак, полученная соль будет кислой солью, которая действует как слабая кислота (например,г., сульфат аммония). Важно отметить, что, поскольку у него есть два иона водорода, которые он может отдать, одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия.
Важно отметить, что, поскольку у него есть два иона водорода, которые он может отдать, одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия.
Серная кислота и пищевая сода
Поскольку пищевая сода часто используется для нейтрализации разливов кислоты из аккумуляторной батареи на автомобилях или разливов кислоты в лабораториях, реакция серной кислоты с пищевой содой является типичным примером, который имеет небольшой поворот. Когда бикарбонат пищевой соды контактирует с раствором серной кислоты, он принимает ионы водорода, превращаясь в угольную кислоту.Угольная кислота может разлагаться с образованием воды и двуокиси углерода; однако по мере того, как серная кислота и пищевая сода вступают в реакцию, концентрация угольной кислоты быстро накапливается, что способствует образованию диоксида углерода. Когда углекислый газ выходит из раствора, образуется бурлящая масса пузырьков. Эта реакция является простой иллюстрацией принципа Ле-Шателье — когда изменения концентрации нарушают динамическое равновесие, система реагирует таким образом, чтобы восстановить равновесие.
Другие примеры
Реакция между серной кислотой и карбонатом кальция в некотором смысле похожа на реакцию с пищевой содой — углекислый газ исчезает, а оставшаяся соль — сульфат кальция. При взаимодействии серной кислоты с гидроксидом натрия с сильным основанием образуется сульфат натрия, а при взаимодействии серной кислоты с оксидом меди — сульфат меди (II) синего цвета. Серная кислота настолько сильная кислота, что ее можно использовать для прикрепления иона водорода к азотной кислоте с образованием иона нитрония.Эта реакция используется при производстве одного из самых известных в мире взрывчатых веществ — 2,4,6-тринитротолуола или тротила.
Формула серной кислоты — использование серной кислоты, свойства, структура и формула
Формула и структура: Химическая формула серной кислоты: H 2 SO 4 , а ее молекулярная масса составляет 98,079 г / моль. Его химическая структура показана ниже. Атом серы связан с двумя атомами кислорода двойными связями и двумя гидроксильными группами (ОН) одинарными связями. Это дипротонная кислота, так как она может выделять два протона.
Это дипротонная кислота, так как она может выделять два протона.
Происхождение: Серная кислота образуется естественным путем в результате окисления сульфидных минералов в горных породах. Разбавленная серная кислота также образуется в атмосфере в результате окисления диоксида серы (в результате сжигания топлива) в присутствии влаги, в конечном итоге выпадая в виде «кислотного дождя».
Получение: Серную кислоту получают в промышленных масштабах реакцией воды с триоксидом серы.
SO 3 + H 2 O → H 2 SO 4
Триоксид серы (SO 3 ) образуется в результате реакции диоксида серы и кислорода, катализируемой оксидом ванадия, в процессе контактного или камерного процесса.
Физические свойства: H 2 SO 4 представляет собой бесцветную или слегка желтоватую вязкую жидкость с резким запахом. Он имеет плотность 1,84 г / мл, температуру кипения 337 ° C и точку плавления 10 ° C. «Концентрированная» серная кислота на 98% содержится в воде и является наиболее стабильной формой. Многие другие концентрации с разными названиями доступны для различных целей. Аккумуляторная кислота составляет 29–32%, камерная кислота — 62–70%, а кислотная — 78–80%.
«Концентрированная» серная кислота на 98% содержится в воде и является наиболее стабильной формой. Многие другие концентрации с разными названиями доступны для различных целей. Аккумуляторная кислота составляет 29–32%, камерная кислота — 62–70%, а кислотная — 78–80%.
Химические свойства: Серная кислота — очень сильная дипротонная кислота.Он гигроскопичен и легко впитывает влагу из воздуха. Это мощный окислитель, вступающий в реакцию со многими металлами при высоких температурах. Концентрированный H 2 SO 4 также является сильным дегидратирующим агентом. Добавление воды к концентрированной серной кислоте является очень экзотермической реакцией и может привести к взрывам.
Область применения: Серная кислота имеет множество применений в различных отраслях промышленности, таких как переработка полезных ископаемых, переработка нефти, производство удобрений, очистка сточных вод и т. Д.Он также используется в производстве чистящих средств, красителей, пигментов, лекарств, моющих средств и взрывчатых веществ. Обычно он используется в качестве электролита в свинцово-кислотных аккумуляторах.
Обычно он используется в качестве электролита в свинцово-кислотных аккумуляторах.
Опасность для здоровья / воздействие на здоровье: Концентрированный H 2 SO 4 является очень коррозионным и может серьезно повредить ткани при контакте. Как сильная кислота, окислитель, коррозионный агент и дегидратирующий агент, он более опасен, чем другие минеральные кислоты. При контакте с кожей вызывает сильные химические ожоги. Попадание в глаза может привести к необратимым повреждениям и слепоте.Проглатывание кислоты может даже привести к смерти.
|
| |







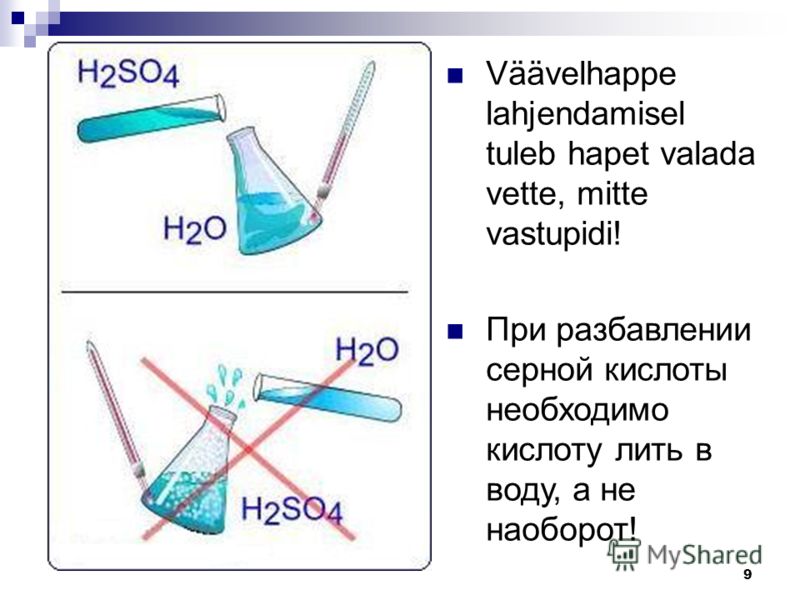 Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном.
Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Такая себе бифильная дрянь.


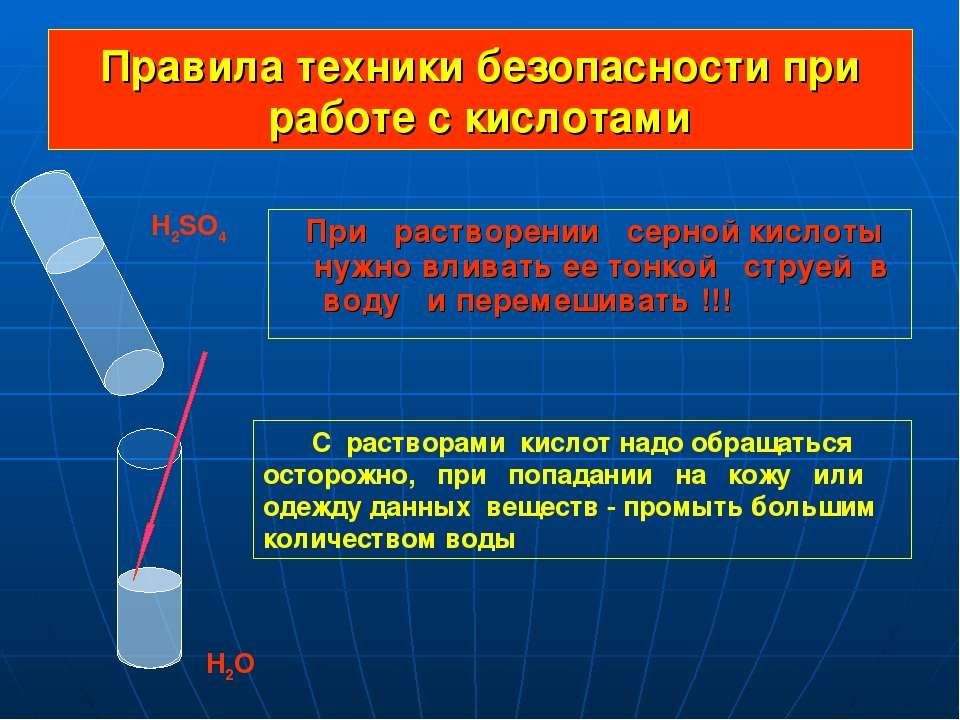 Это дает чистую серную кислоту с концентрацией выше 98%. Остерегайтесь утечки шестивалентного хрома, это канцероген! Если такая утечка произошла, нейтрализуйте ее любым восстанавливающим раствором, например йодидом калия.
Это дает чистую серную кислоту с концентрацией выше 98%. Остерегайтесь утечки шестивалентного хрома, это канцероген! Если такая утечка произошла, нейтрализуйте ее любым восстанавливающим раствором, например йодидом калия.
