Рассмотрим какие бывают виды аккумуляторов.
Ученые многих стран мира постоянно разрабатывают новые типы аккумуляторов и занимаются усовершенствованием существующих видов, которые наиболее отвечаю все возрастающим требованиям потребителей и условиям их применения.
Все разновидности аккумуляторов имеют свои положительные и отрицательные характеристики, но до настоящего времени идеальной батареи изобрести пока не удалось.Поэтому в каждом конкретном устройстве используются АКБ с оптимальными характеристиками.
Рассмотрим основные виды аккумуляторов, маркировку, условные обозначения и типы клемм.
У аккумуляторов, изготовленных по различным стандартам, конструктивное устройство клемм отличаются.По европейскому стандарту одним из наиболее распространённых является конус «А». Отрицательный токовывод имеет диаметр 17,9 мм, а положительный — 19,5 мм.
Европейский тип клемм «Е» (винтовые).
АКБ, выпускаемые в странах азиатского региона, имеют тип клемм конус «В».
Сурьмянистые
Сурьмянистые аккумуляторы относятся к классическим, но также и устаревшим типам АКБ по причине повышенного состава сурьмы (более 5%).
Свинец в чистом виде не используется при изготовлении аккумуляторных батарей, поэтому в пластины для повышения прочности добавляется сурьма. Такая добавка позволяет ускорить процесс электролиза.
При работе батареи повышается температура электролита и вода начинает выкипать, что неизбежно вызывает падение уровня электролита в батарее. При обслуживании аккумуляторной батареи необходимо эпизодически добавлять дистиллят. По этой причине данный тип АКБ относят к классу обслуживаемых, поскольку в процессе эксплуатации необходимо периодически проводить проверку уровня и плотности электролита.
На современном этапе для автомобилей применяются различные типы аккумуляторов, имеющие низкое содержание сурьмы или не имеющие её вовсе. От сурьмянистых аккумуляторов однако не отказались совсем. Их применение осуществляется там, где работает квалифицированный персонал. К достоинствам сурьмяных батарей необходимо отнести невысокую стоимость, доступность в обслуживании. Однако этих достоинств уже оказывается недостаточно, чтобы сохранять лидерство на рынке автомобильных батарей.
От сурьмянистых аккумуляторов однако не отказались совсем. Их применение осуществляется там, где работает квалифицированный персонал. К достоинствам сурьмяных батарей необходимо отнести невысокую стоимость, доступность в обслуживании. Однако этих достоинств уже оказывается недостаточно, чтобы сохранять лидерство на рынке автомобильных батарей.
Малосурьмянистые
Материалом для пластин является свинец с небольшой примесью сурьмы. Такие батареи универсальны и довольно широко представлены на российском потребительском рынке.
При разработке этого вида батарей ставилась задача — максимальное снижение процесса выкипания электролита. Немаловажный фактор малосурьмянистых АКБ — степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
Малосурьмянистым батареям также необходимо обслуживание, хоть и с довольно меньшей периодичностью, чем сурьмянистым. Небольшое испарение воды все же происходит, поэтому иногда требуется производить контроль соответствия уровня и плотности, добавляя дистиллированную воду.
В силу этих обстоятельств малосурьмянистые АКБ можно назвать малообслуживаемыми. Преимущества: малый уровень саморазряд при хранении, невысокая цена, устойчивость к нестабильности параметров бортовой сети автомобиля, высокой срок эксплуатации. Данный тип АКБ в силу своих преимуществ чаще всего применяются на отечественных автомобилях, которые страдают нестабильностью бортовой сети.
Кальциевые
При производстве кальциевых батарей свинцовые пластины легированы 0,07-0,1% кальцием. Они могут иметь различные заряды (отрицательный или положительный). Виды аккумуляторных батареи такого типа маркируются «Са/Са», что обозначает наличие кальция в составе пластин обоих полюсов. Кальций существенно снижает испарение воды из электролита, в связи с чем отпадает необходимость контроля соответствия уровня и плотности практически отпадает. За счет введения кальция батареи приобретают высокую виброустойчивость и повышается их коррозоустойчивость. Положительный эффект достигается введением в материал пластин небольшого количества серебра.
Для кальциевых АКБ противопоказаны глубокие разряды. Настоятельно рекомендуется не разряжать Сa/Сa ниже границы в 70%. Кальциевые батареи теряют около 50% своей энергоёмкости даже после одного полного разряда (уровень ниже 10в). Данный тип АКБ рекомендуется тем, кто часто ездит на значительные расстояния, кому нужны виброустойчивые аккумуляторы, хорошо переносящие постоянные перезаряды (ввиду длительности поездки).
Если вы планируете приобрести для своего автомобиля кальциевую батарею, то необходимо быть уверенным в исправности электроприборов и стабильности напряжения в бортовой сети автомобиля. Немаловажный минус данного типа аккумуляторов — более высокая стоимость в сравнении с сурьмянистыми АКБ. Однако данный недостаток нивелируется высокой степенью надежности и отличным качеством, а также отсутствием периодического контроля электролита.
Подробней о кальциевых аккумуляторах Вы можете почитать здесь.
Гибридные
Гибридные аккумуляторы повсеместно вытесняют кальциевые. Конструктивные отличия состоят в том, что при их производстве объединили две технологии: одна, когда пластины формируется из сплава свинца и сурьмы (положительные электроды), другая же – из сплава свинца и кальция (отрицательные электроды). В результате это дало неоспоримое преимущество в сравнении с кальциевыми батареями.
Конструктивные отличия состоят в том, что при их производстве объединили две технологии: одна, когда пластины формируется из сплава свинца и сурьмы (положительные электроды), другая же – из сплава свинца и кальция (отрицательные электроды). В результате это дало неоспоримое преимущество в сравнении с кальциевыми батареями.
Для гибридной батареи глубокий разряд перестал быть гибельным. Для тех автовладельцев, которые пользуются автомобилем круглогодично, это теперь позволяет значительно увеличить период службы АКБ. В связи с тем, что практически перестал выкипать электролит, такой тип батареи стал считаться полностью необслуживаемым.
Ключевая особенность гибридных аккумуляторов — лучшая виброустойчивость, которую высоко ценят водители. Такой результат достигнут благодаря толстым литым пластинам, применение которых позволило повысить срок эксплуатации до семи лет.
Ошибочно считать, что гибридные аккумуляторы являются лучшими и их следует применять без учета особенностей каждого автомобиля.
Гелевые
В начале 21-го века на автомобильном рынке появился новый тип АКБ – гелевые автомобильные аккумуляторы. Отличительная особенность гелевых аккумуляторов — применение гелеобразного (киселеобразного) электролита. Данная технология позволила снизить текучесть электролита, в котором содержится агрессивная серная кислота.
В случае небрежного обращения с аккумулятором возможны повреждения кожи от контакта с электролитом. Чтобы электролит приобрел гелеобразное состояние в него добавляют кремний. К преимуществам гелевых АКБ можно отнести низкую скорость саморазряда. Гелевые батареи относятся к необслуживаемым.
Какие же недостатки имеют гелевые батареи?
- При заряде АКБ напряжение более 14в приводит к вспучиванию оболочки.
- Применение данного типа АКБ для автомобилей не рекомендуется, как и то, что для зарядки необходимы специальные ЗУ, имеющие функцию заряда в щадящем режиме.
- Гелевые батареи не переносят низких температур из-за загустевания электролита и снижения ёмкости аккумулятора.
К сожалению, не смотря на все достоинства, гелевые батареи не являются «вечными», наполненные гелеобразным электролитом они могут беспроблемно работать от восьми до десяти лет, а при правильной эксплуатации и соответствующем обслуживании – и до двенадцати. На гелевые аккумуляторы наносится специальный знак, с включением в него аббревиатуры «GEL».
EFB
EFB — «улучшенная жидкозаполненная батарея». Свинцовые пластины в ЕФБ аккумуляторах в два раза толще, чем у обычных, в следствии чего увеличивается их ёмкость. Каждая пластина запечатана в пакет из специальной ткани, который наполнен жидким сернокислотным электролитом.
Преимущества аккумуляторов EFB:
- работают при температуре от -50 до +60°С;
- стойко выдерживают глубокий разряд;
- минимальное испарение электролита;
- способны выдерживать большое количество циклов заряда-разряда.
АКБ по технологии EFB довольно безопасны и требуют минимального обслуживания. Их можно заряжать в домашних условиях, поскольку электролит не испаряется. Из недостатков можно отметить меньшую отдаваемую мощность, чем у AGM изделий.
Подробней о аккумуляторе АКОМ + EFB.
AGM
Отличительной особенностью данного типа аккумуляторных батарей является то, что в электролит между пластинами с помощью специальной технологии монтируются стекловолоконные микропористые прокладки.
Предназначение таких прокладок – удержание геля и защита электродов от осыпания. В принципе, основные характеристики батареи GEL и AGM отличаются незначительно. Батареи AGM имеют меньшую стоимость; у них ниже чувствительность к подаваемому напряжению при зарядке, КЗ и температуре окружающей среды. Устойчивы к вибрации и тряске. Они также как и GEL АКБ, практически не требуют обслуживания.
Устойчивы к вибрации и тряске. Они также как и GEL АКБ, практически не требуют обслуживания.
К недостаткам относят меньшее число циклов заряда-разряда (примерно в два раза). Они более чувствительны к глубокому разряду, имеют более быстрый саморазряд. При зарядке необходимо специальное ЗУ. Обычное зачастую не подходит. Отличительной особенностью при обслуживании является необходимость внимательно изучать инструкции перед использованием по предназначению. AGM АКБ чаще применяются в условиях, когда необходим большой период циклов заряда и разряда. При маркировке аккумуляторов данного типа используют аббревиатуру «AGM».
Щелочные
Исторически щелочные источники энергии появились позже кислотных аккумуляторов, вследствие этого некоторые недостатки, свойственные кислотным, не присутствуют у щелочных аккумуляторов. Более того, щелочные АКБ имеют преимущества над кислотными: они переносят перегрузки и короткие замыкания, хорошо работают при различных температурах и т.д. Во всех ЩА (почему они и называются щелочными) применяется растворенная в воде щёлочь.
Что же касается состава химически активной массы пластин, то он может быть различным. При их производстве применяют никель, кадмий, цинк, серебро или др. материалы. От вида использования соответствующих химических элементов в отрицательных пластинах (электродах) щелочные аккумуляторы подразделяются на: цинково-никелевые, кадмиево-никелевые, железо-никелевые, серебряно-цинковые и т.д.
В аккумуляторах щелочного типа количество пластин в положительных и отрицательных электродах не одинаково. В никель-кадмиевом аккумуляторе количество положительных пластин на одну больше количества отрицательных пластин. В щелочных аккумуляторах с никель-железными пластинами больше на одну отрицательную.
По конструкции электродов (пластин) кадмиево-никелевые и железо-никелевые аккумуляторы разделяются на ламельные и безламельные, по способу исполнения — на герметичные и негерметичные.
Наиболее широкое распространение получили ламельные щелочные кадмиево-никелевые и железо-никелевые аккумуляторы, и те и другие схожи как по устройству, так и по действию.
Например, сосуды этих аккумуляторов производятся из никелированного железа при помощи сварки, состав активной массы плюсовых пластин и электролит одинаков. У железо-никелевых и кадмиево-никелевых различаются только отрицательные пластины, но не по устройству, а по составу активной массы. В процессе зарядки и разрядки плотность электролита не изменяется.
Активная масса щелочной батареи заключена в стальные перфорированные пакеты, или ламели, а ламели впрессованы в стальные стойки (рамку) пластин. Для лучшего контакта и электропроводности между активной массой и никелированной основой пластин в активную массу добавляют чешуйки графита или лепестки Никеля.
Номинальное напряжение одного аккумулятора составляет 1,25в. Большинство потребителей работают на напряжении 14-15в., поэтому аккумуляторы представляют из себя сборку. Характерная особенность щелочных АКБ – они не требуют разборки. При грамотной эксплуатации и уходе батареи могут использоваться до 10 лет.
Литий-ионные
Химическое внедрение сторонних атомов и молекул («гостей») в кристаллическую решетку основного материала («хозяина») известно с начала XX века. Название процесса — «внедрение» перевели на латынь и начали говорить не о внедрении-извлечении, а об интеркалации-деинтеркалации (от латинского iniercalarius, другое написание iniercalatus — вставной, добавочный). Осуществлённое во второй половине XX века обратимое проведение этого процесса электрохимическим способом в неводных средах создало экспериментальную основу для разработки нового поколения вторичных источников тока.
Название процесса — «внедрение» перевели на латынь и начали говорить не о внедрении-извлечении, а об интеркалации-деинтеркалации (от латинского iniercalarius, другое написание iniercalatus — вставной, добавочный). Осуществлённое во второй половине XX века обратимое проведение этого процесса электрохимическим способом в неводных средах создало экспериментальную основу для разработки нового поколения вторичных источников тока.
Первоначальное название такого аккумулятора — «кресло-качалка» (rocking chair), которое затем устойчиво сменилось на литий-ионный аккумулятор (далее Li-ion).
Впервые коммерциализировала это изделие японская фирма Sony в начале 90-х годов XX века. Новое поколение АКБ стремительно вошло в нашу жизнь и уверенно завоёвывает позиции во всех автономных изделиях, требующих независимого питания электрической энергией. На рынке Li-ion имеют два основных конкурента, Ni-Cd (никель-кадмиевые) и Ni-MH (никель-металлгидридные) аккумуляторы. Основа коммерческого успеха Li-ion АКБ лежит в том, что он появился в нужное время и в нужном месте.
В качестве анодного материала используется широкий круг углеродов, который можно разделить на две группы — углероды с неупорядоченной структурой, так называемые жесткие углероды, и обладающие упорядоченной структурой графиты.
Современными катодными материалами являются литий металл оксиды. К ним относится главным образом литий кобальт диоксид (LiCo02), представляющий собой твердофазное соединение оксидов лития и кобальта. Этот оксид удовлетворяет всем техническим требованиям, но имеет высокую цену, а также токсичен. Это побуждает заменить, хотя бы частично, кобальт на никель, а также на другие металлы, в частности на марганец. В Li-ion используется жидкий электролит, представляющий собой раствор фторсодержащих солей лития типа LiPF6 в смеси эфиров угольной кислоты (карбонатов), например, ЭК и ДМК. Отличительной особенностью литиевых первичных источников тока является длительная сохранность. Диапазон рабочих температур (-20… + 60 °С)
Первичные литиевые источники тока имеют более широкий диапазон рабочих температур по сравнению с традиционными водными элементами. Это обусловлено использованием для изготовления электролитов неводных растворителей с существенно более низкой температурой замерзания и более высокой температурой кипения по сравнению с водой. Однако электропроводность этих электролитов заметно снижается с понижением температуры. Для слаботочных первичных литиевых источников тока это обстоятельство не является критичным.
Это обусловлено использованием для изготовления электролитов неводных растворителей с существенно более низкой температурой замерзания и более высокой температурой кипения по сравнению с водой. Однако электропроводность этих электролитов заметно снижается с понижением температуры. Для слаботочных первичных литиевых источников тока это обстоятельство не является критичным.
У Li-ion температурная зависимость электропроводности имеет место не только в электролите, но и в матрицах электродов. Наложение этих явлений приводит к тому обстоятельству, что преимущества неводных электролитов, имеющие место для первичных литиевых элементов, не проявляются в Li-ion батареях. Герметичное исполнение и автоматический контроль состояния аккумулятора обеспечивают его долгую эксплуатацию. Полное отсутствие эффектов памяти и прочих недостатков делает Li-ion АКБ весьма комфортным в использовании.
Какие бывают аккумуляторы в мобильной, компьютерной и бытовой технике | Батарейки и аккумуляторы | Блог
Аккумуляторы окружают нас повсеместно. Их можно встретить как в привычных каждому пользователю мобильных гаджетах, так и в сложных системах резервного электропитания. В каждой из областей используется свой тип аккумуляторной батареи, в которой ее характеристики «раскрываются» наилучшим образом. В данном материале поговорим о типах аккумуляторных элементов, областях применения и основных правилах эксплуатации.
Их можно встретить как в привычных каждому пользователю мобильных гаджетах, так и в сложных системах резервного электропитания. В каждой из областей используется свой тип аккумуляторной батареи, в которой ее характеристики «раскрываются» наилучшим образом. В данном материале поговорим о типах аккумуляторных элементов, областях применения и основных правилах эксплуатации.
Аккумуляторы. Общие принципы
По историческим меркам аккумулятор — довольно «молодое» изобретение, которому немногим более 160 лет. Основной принцип работы любого аккумуляторного элемента — протекание в нем обратимой электрохимической реакции, т. е. при приложении к контактам элемента постоянного напряжения, на его пластинах (электродах) накапливается электрическая энергия, при приложении нагрузки — происходит ее расходование. Причем протекает такая реакция на протяжении большого количества циклов заряда/разряда. Как правило, возможное количество перезарядок зависит от типа аккумуляторного элемента, но в среднем, современный аккумулятор способен обеспечить 300–1000 полных циклов.
Работоспособным считается аккумулятор, остаточная емкость которого составляет 70–80 % от начальной. Элементы с меньшими показателями остаточной емкости считаются непригодными для дальнейшей эксплуатации, поскольку не могут обеспечить расчетную автономность.
Какого бы типа не был аккумулятор, костяк конструкции и основной принцип действия у них остается неизменным. В каждом аккумуляторе есть два электрода (положительный и отрицательный, иначе именуемые анод и катод), погруженные в специальную среду — электролит, являющуюся прекрасным «поставщиком» ионов вследствие электролитической диссоциации.
Ион — атом или молекула, несущая на себе электрический заряд. Если ион положительно заряжен — его называют катион, если отрицательно — анион.
В зависимости от используемого материала электродов и применяемого типа электролита существуют различные вариации аккумуляторных элементов, каждый из которых имеет свои конструкционные и эксплуатационные особенности. Ниже поговорим о наиболее распространенных типах аккумуляторов, сферах их применения и особенностях эксплуатации.
Ниже поговорим о наиболее распространенных типах аккумуляторов, сферах их применения и особенностях эксплуатации.
Свинцовые аккумуляторы
Несмотря на преклонный возраст технологии, свинцовые аккумуляторы до сих пор успешно применяются в системах резервного питания, автомобильном транспорте, системах аккумулирования возобновляемых источников энергии (солнечная и ветряная энергетика, гидроэнергетика и т. д.).
Как видно из названия, в качестве основного материала, из которого изготавливают электроды, выступает свинец. Точнее, для производства положительных электродов — просто свинец, а для изготовления отрицательных электродов — оксид свинца. В качестве электролита, как правило, выступает раствор серной кислоты.
Существует большое количество конструкций свинцового аккумулятора, направленных на улучшение его эксплуатационных характеристик. Поскольку свинец сам по себе достаточно мягкий металл с невысокой физической прочностью, в чистом виде он слабо противостоит вибрационным нагрузкам, поэтому для использования аккумуляторов, например, в транспорте, в сплав свинца добавляют кальций, делающий структуру металла более прочной.
Для использования свинцового аккумулятора в источниках бесперебойного питания, дабы не допустить контакт пользователя с кислотой, исключить необходимость обслуживания, а также не создавать условия для взрыва водорода, выделяемого из АКБ, при ее заряде, используют свинцовые аккумуляторы определенного типа. Такими аккумуляторами являются источники питания типа AGM (Absorbent Glass Mat), в которых абсорбированным электролитом (не жидким) пропитан специальный пористый мат из стекловолокна.
Довольно часто свинцовые аккумуляторы, выполненные по технологии AGM, ошибочно называют гелевыми. На самом деле это не так. Гелевые аккумуляторы — отдельная ветвь развития свинцовых источников питания.
Аккумуляторы, электролитом в которых выступает раствор серной кислоты в желеобразном состоянии, называются гелевыми. Они рассчитаны на медленную отдачу энергии, поэтому основная область их применения — использование в инертных системах накопления и расходования электроэнергии (солнечная энергетика, питание моторов кресел для инвалидов, гольф-каров и т. д.).
д.).
К неоспоримым преимуществам свинцовых аккумуляторов относятся их невысокая стоимость и возможность работы в широком диапазоне температур окружающей среды (от — 40 до + 40 ° С).
Один свинцовый аккумуляторный элемент выдает напряжение порядка 2 В и способен выдать удельной энергии из расчета 30–60 Вт*ч с 1 кг массы, что в сравнении с другими типами — достаточно мало. Такие аккумуляторы имеют высокие значения саморазряда, а их глубокий разряд приводит к разрушению и осыпанию пластин электродов и безвозвратной порче аккумулятора.
Никель-кадмиевые аккумуляторы
Следующим типом аккумуляторных элементов, активно использующихся во многих сферах, являются никель-кадмиевые аккумуляторы (NiCd). Их можно встретить в детских игрушках, пультах управления, фонариках, ручном аккумуляторном электроинструменте и т. д.
Конструкция элемента не претерпела изменений, только в качестве материала для изготовления электродов используются никель и кадмий, а точнее гидраты закиси этих металлов. В качестве электролита применяют гидроксид калия. Один элемент на основе этих металлов может выдать напряжение 1,2–1,35 В, а значение удельной энергии находится в диапазоне 40–80 Вт*ч/кг.
В качестве электролита применяют гидроксид калия. Один элемент на основе этих металлов может выдать напряжение 1,2–1,35 В, а значение удельной энергии находится в диапазоне 40–80 Вт*ч/кг.
Никель-кадмиевые аккумуляторы — одни из самых морозоустойчивых. Они работают без существенной потери своей емкости при температурах, близких к –50 ° С, к тому же, абсолютно не боятся глубокого разряда, и после цикла зарядки полностью восстанавливают свои эксплуатационные характеристики.
Хранить NiCd аккумуляторы рекомендуется полностью разряженными.
К отрицательным моментам относят их малую удельную емкость, высокий саморазряд, длительное время зарядки (восполнять энергию нужно малыми зарядными токами) и ярко выраженный «эффект памяти».
Чтобы не испортить аккумулятор, его необходимо заряжать только после полного разряда! Пренебрежение этим правилом повлечет быструю потерю емкости и выход элемента из строя.
youtube.com/embed/XPYhtatscH0?origin=https://club.dns-shop.ru» srcdoc=»<style>*{padding:0;margin:0;overflow:hidden}html,body{height:100%}img,svg{position:absolute;width:100%;top:0;bottom:0;margin:auto}svg{left:calc(50% — 34px)}</style><a href=https://www.youtube.com/embed/XPYhtatscH0?origin=https://club.dns-shop.ru&autoplay=1><img src=https://img.youtube.com/vi/XPYhtatscH0/hqdefault.jpg><svg width=68 height=48><path fill=#f00 d=’M66.52,7.74c-0.78-2.93-2.49-5.41-5.42-6.19C55.79,.13,34,0,34,0S12.21,.13,6.9,1.55 C3.97,2.33,2.27,4.81,1.48,7.74C0.06,13.05,0,24,0,24s0.06,10.95,1.48,16.26c0.78,2.93,2.49,5.41,5.42,6.19 C12.21,47.87,34,48,34,48s21.79-0.13,27.1-1.55c2.93-0.78,4.64-3.26,5.42-6.19C67.94,34.95,68,24,68,24S67.94,13.05,66.52,7.74z’></path><path fill=#fff d=’M 45,24 27,14 27,34′></path></svg></a>» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Заряжают NiCd-элементы малыми зарядными токами, значения которых составляет порядка 10 % от емкости аккумулятора.
Логическим продолжением никель-кадмиевых аккумуляторов стали никель-металлогидридные (NiMH) элементы питания. В них учтены и практически устранены недостатки предшественников. Аккумуляторы при тех же массогабаритных показателях имеют большую в 2–3 раза емкость, обладают высокой надежностью, с легкостью переносят глубокий разряд и перезаряд, менее подвержены эффекту памяти.
Немаловажную роль в популяризации и широком распространении NiMH элементов сыграл тот факт, что они не содержат в своем составе кадмия, очень вредного для окружающей среды металла. Следовательно, с повестки дня снимаются вопросы правильного хранения и утилизации таких элементов.
Для производства анода используют гидрид никеля с лантаном или литием — так называемый металлогидридный электрод. В качестве катода — оксид никеля. Электролитом выступает соединение гидроксида калия.
Заряжают никель-металлогидридные аккумуляторы большими (в сравнении с NiCd-элементами) токами, величины которых составляют порядка 20–25 % от емкости аккумулятора, но очень важно контролировать температуру элемента во время заряда. Если она превышает 45 °С, нужно немедленно прервать процесс зарядки, в противном случае существует риск порчи элемента.
Если она превышает 45 °С, нужно немедленно прервать процесс зарядки, в противном случае существует риск порчи элемента.
Зарядку для NiMH-аккумуляторов можно использовать в паре с NiCd-элементами. Обратная совместимость недопустима! Алгоритмы зарядки никель-кадмия более примитивны, они могут причинить вред NiMH-элементу.
Никель-металлогидридные аккумуляторы хранят полностью заряженными. Поскольку этому типу элементов присущ высокий саморазряд, для сохранения работоспособности элемента его нужно периодически подвергать полному циклу разряда/заряда.
Никель-металлогидридные аккумуляторы используют в тех же сферах, что и никель-кадмиевые, однако, благодаря повышенной емкости, их охотно применяют в фототехнике, использующей для питания элементы типа АА и ААА.
youtube.com/embed/RGmXjeo9KgI?origin=https://club.dns-shop.ru&autoplay=1><img src=https://img.youtube.com/vi/RGmXjeo9KgI/hqdefault.jpg><svg width=68 height=48><path fill=#f00 d=’M66.52,7.74c-0.78-2.93-2.49-5.41-5.42-6.19C55.79,.13,34,0,34,0S12.21,.13,6.9,1.55 C3.97,2.33,2.27,4.81,1.48,7.74C0.06,13.05,0,24,0,24s0.06,10.95,1.48,16.26c0.78,2.93,2.49,5.41,5.42,6.19 C12.21,47.87,34,48,34,48s21.79-0.13,27.1-1.55c2.93-0.78,4.64-3.26,5.42-6.19C67.94,34.95,68,24,68,24S67.94,13.05,66.52,7.74z’></path><path fill=#fff d=’M 45,24 27,14 27,34′></path></svg></a>» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
NiMH элементы — самые морозоустойчивые. Они без проблем переносят эксплуатацию при экстремально низких температурах, достигающих -60 °С. По этой причине их довольно успешно применяют в электроинструменте, используемом при выполнении работ на открытом воздухе в зимнее время.
Один элемент генерирует 1,2–1,25 в ЭДС, а его удельная энергия составляет 60–75 Вт*ч/кг. Теоретический расчетный «потолок» этого параметра находится на уровне 300 Вт*ч/кг, но видимо технологии производства NiMH-элементов, еще не до конца совершенны.
Литий-ионные аккумуляторы
Современные мобильные устройства уже сложно представить без литий-ионных аккумуляторов. Именно их разработка дала мощный толчок к развитию легких и миниатюрных решений источников питания, и, как следствие, миниатюризации всего сегмента мобильных гаджетов.
Сильными сторонами Li-ion являются высокая плотность аккумулируемой энергии, ее удельное значение, в большинстве случаев, составляет солидные 280 Вт*ч/кг, недостижимые при использовании аккумуляторов другого типа. Именно по этой причине Li-ion аккумуляторы используются не только для питания персональных гаджетов, но и для приведения в движение различных самокатов, велосипедов с электродвигателем и даже автомобилей.
Справедливости ради следует сказать, что «литий-ионный аккумулятор» — это обобщенное название целой группы электрохимических элементов, переносчиком заряда в которых выступают ионы лития.
Разница заключается в составе материала катода и типе электролита.
Наибольшее распространение в бытовом сегменте получили литий-полимерные аккумуляторы, в которых в качестве электролита используется специальный твердый полимер, а катодный и анодный материал нанесены на тонкие слои алюминиевой и медной фольги соответственно. Такое конструктивное решение позволяет производить аккумуляторы любой формы и размера, изящно «вписывая» их в разрабатываемые устройства.
Существенный недостаток твердого полимера — его плохая проводимость при нормальной температуре окружающей среды (+ 25 °С). Наилучшие показатели достигаются при увеличении температуры до + 60 °С, а это уже опасно с точки зрения обычного использования. Поэтому производители идут на небольшие ухищрения, добавляя к полимеру электролит в жидком или желеобразном состоянии.
Существенное отличие конструкции литий-ионных аккумуляторов от традиционной конструкции заключается в обязательном наличии разделительного сепаратора, исключающего свободное перемещение ионов лития, в моменты, когда аккумулятор не используется.
Другой элемент, который должен обязательно присутствовать в схеме аккумулятора — BMS-контроллер (Battery Management System), отвечающий за корректную и сбалансированную зарядку ячеек аккумулятора.
Li-ion аккумуляторы при высокой удельной емкости обладают малым весом. Для их зарядки нужно не так уж много времени. У них практически отсутствует эффект памяти и саморазряд. К аккумуляторам литий-ионного типа не предъявляется особых требований к соблюдению циклов заряда/разряда. Заряжать их можно в любое удобное время, не привязываясь к величине остаточного заряда элемента. Хранить Li-ion батареи рекомендуется наполовину заряженными.
Самым существенным недостатком литий-ионного элемента является его категорическое «нежелание» полноценно работать при отрицательных температурах. Эксплуатация литиевого элемента на морозе очень быстро приблизит его выход из строя.
Как выбрать батарейки | Батарейки и аккумуляторы | Блог
Сегодня батарейки это такой же продукт первой необходимости, как и зубная паста или салфетки, без них не будет работать пульт, ночник, фонарик, калькулятор, часы и многое другое. Если вы сейчас сядете и посчитаете, сколько же приборов питается от этих маленьких элементов, то возможно удивитесь, практически половине устройств необходимо покупать батарейки. Как часто придется менять, зависит от грамотного подхода к выбору батареек. Почему элементы питания одной фирмы работают месяц, а другой пол года? Дело даже не в цене. Как правило, в магазине покупатель первым делом смотрит на форму и размер, может еще и на производителя. Лишь единицы подбирают батарейки по химическому составу, напряжению, емкости, проверяют сроки годности.
Если вы сейчас сядете и посчитаете, сколько же приборов питается от этих маленьких элементов, то возможно удивитесь, практически половине устройств необходимо покупать батарейки. Как часто придется менять, зависит от грамотного подхода к выбору батареек. Почему элементы питания одной фирмы работают месяц, а другой пол года? Дело даже не в цене. Как правило, в магазине покупатель первым делом смотрит на форму и размер, может еще и на производителя. Лишь единицы подбирают батарейки по химическому составу, напряжению, емкости, проверяют сроки годности.
Что такое батарейка и когда она появилась?
Батарейка (она же гальванический элемент) – это источник электроэнергии, который действует на основе химических взаимодействий определенных веществ между собой. Первый химический элемент питания был изобретен Луиджи Гальвани. Точнее Гальвани первооткрыватель процесса, причем совершенно случайный. Ученый проводил опыты над лягушкой и когда он подсоединил к ее лапке две полоски разных металлов, то обнаружил протекание тока между ними.
Открытие Гальвани послужило толчком для другого ученого — Алессандро Вольта, который докопался до истины и дал развитие научной находке. В дальнейшем инициативу по усовершенствованию элементов питания подхватили компании, первой из которых была Eveready. Реализуемая компанией продукция лишь отдаленно напоминала современные виды элементов питания, основными действующими веществами были марганец и цинк. Предназначались первые батарейки для радиоприемников, в дальнейшем электропитание на основе химического взаимодействия распространилось в машиностроительной отрасли.
В 1920 годах на рынок выходит всем известная компания Duracell. Приборы с питанием от батареек распространялись все шире, производство росло в геометрической прогрессии. Первая батарейка Duracell изготавливалась из цинкового корпуса с графитным электродом и латунным колпачком. Заполнена она была оксидом марганца, стенки цинкового корпуса изнутри покрывали электролитом. Латунный колпачек был положительным, а донышко цинкового корпуса отрицательным полюсом. Такие батарейки выпускались вплоть до развала СССР. Но ввиду своих недостатков: малого срока службы, не безопасной конструкции они быстро ушли в прошлое. На смену старому образцу пришли современные элементы питания с долгим сроком жизни, безопасной конструкцией и высокой емкостью.
Такие батарейки выпускались вплоть до развала СССР. Но ввиду своих недостатков: малого срока службы, не безопасной конструкции они быстро ушли в прошлое. На смену старому образцу пришли современные элементы питания с долгим сроком жизни, безопасной конструкцией и высокой емкостью.
Современные виды батареек
В зависимости от состава и активных компонентов батарейки можно разделить на группы. У каждой группы есть плюсы и минусы.
— Солевые батарейки. Самый бюджетный вид элементов питания, характеризуются низкой отдачей тока, коротким сроком службы и хранения. При низких температурах емкость уменьшается намного быстрее. Устройство солевых батареек не далеко ушло от первых образцов компании Duracell. Электроды выполнены из оксида марганца, цинка и соединены между собой солевым мостом. Но несмотря на все недостатки потребители по-прежнему покупают солевые батарейки в больших количествах. Лучший способ применения для солевых гальванических элементов это приборы с низким потреблением: часы, пульты дистанционного управления, весы. Если солевую батарейку оставить в приборе и долго не использовать велика вероятность что она потечет. Связанно это с протеканием химических реакции, на последней стадии разряда характерно повышение активной массы положительного электрода, из-за чего увеличивается давление на электролит. Параллельно протекают процессы разложения диоксида марганца и коррозии цинка, что влечет за собой выделение кислорода и водорода, объем и давление внутри батарейки повышаются.
Если солевую батарейку оставить в приборе и долго не использовать велика вероятность что она потечет. Связанно это с протеканием химических реакции, на последней стадии разряда характерно повышение активной массы положительного электрода, из-за чего увеличивается давление на электролит. Параллельно протекают процессы разложения диоксида марганца и коррозии цинка, что влечет за собой выделение кислорода и водорода, объем и давление внутри батарейки повышаются.
— Щелочные (алкалайновые) батарейки. Универсальные как по цене, так и по сроку службы батарейки, занимающие большую долю рынка . В качестве электролита используется гидроксид калия, от чего у батареек такое название. Щелочные батарейки хранятся до пяти лет, имеют большую емкость, чем предшественники. У данного вида снижены риски протечки, долгая работоспособность при низких температурах и минимальная скорость саморазряда. Маркируются щелочные элементы питания надписью ALKAliNE, что в переводе с английского значит щелочные. Рекомендуются для использования в приборах с умеренной нагрузкой, таких как: детские игрушки, ночники, радио, пульты ДУ и т.п.
Рекомендуются для использования в приборах с умеренной нагрузкой, таких как: детские игрушки, ночники, радио, пульты ДУ и т.п.
— Литиевые батарейки. Появились сравнительно недавно, находятся выше по ценовой категории. С развитием всевозможных гаджетов и портативных устройств начал расти спрос на элементы питания, выдерживающие интенсивное потребление тока в длительный промежуток времени. Литиевые батарейки отвечают всем требованиям потребителя: долгий срок хранения и службы, устойчивость к температурам (высоким и низким), легкие по весу, не протекают. Следует отметить, литиевые батарейки обладают постоянным напряжением и высокой энергоплотностью, которую не обеспечит ни один предшественник. Подходят для оборудования с высоким энергопотреблением: фонари, вспышки, фотоаппараты, портативные колонки. Маркируются надписью на корпусе «lithium».
Довольно редко встречаются ртутные и серебряные элементы питания, хотя по своим свойствам они схожи и мало чем уступают литиевым.
Недостатками ртутных элементов питания считается небезопасность использования при повреждении целостности конструкции, сложности с утилизацией.
Типоразмеры батареек
Батарейки отличаются не только размерами, но формой, одни распространены и широко известны (АА, ААА), другие приходится долго искать по магазинам. Несмотря на изобилие форм, все батарейки имеют классификацию согласно стандартам. Привычные на слух названия размеров АА, ААА, С, D принадлежат американскому стандарту.
Существуют и другие системы классификаций элементов питания: международные, национальные. В России размеры батареек регламентированы согласно ГОСТу, но данный вид маркировки не на слуху и мало кто из молодежи им пользуется.
АА (пальчиковые или R6/LR6) – цилиндрические тонкие батарейки, используются в пультах ДУ, часах, игрушках, фонарях и другой мелкой технике. Обозначение R6 говорит о размерности батарейки, а приставка L вносит ясность, что элемент щелочной.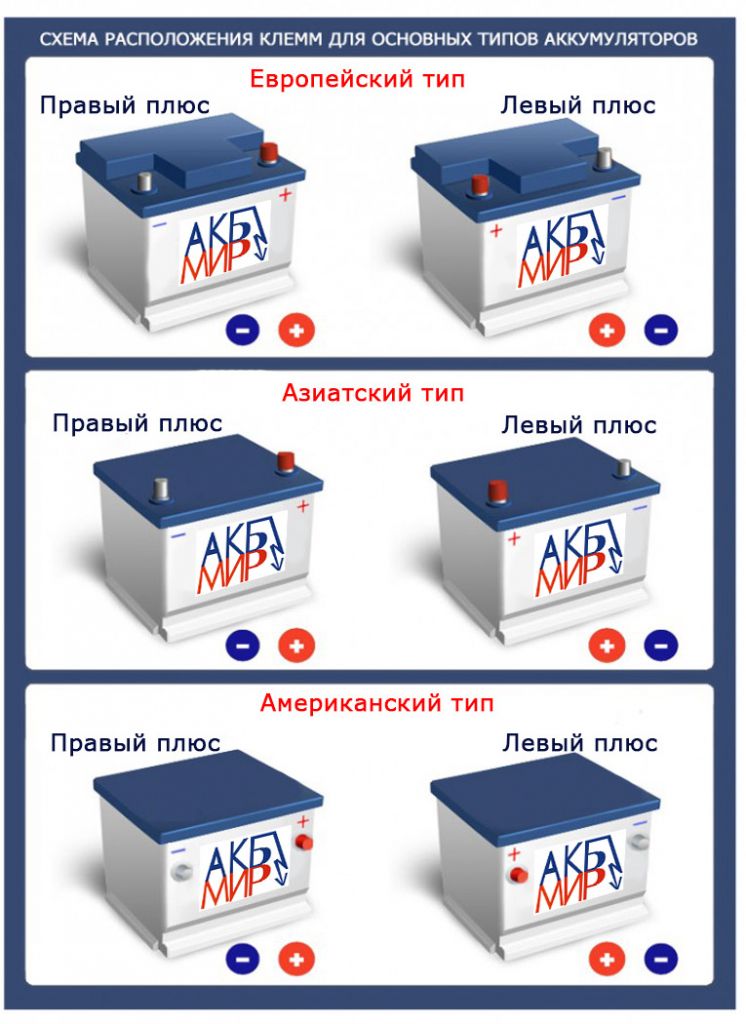
ААА (мизинчиковые или R03/LR03) – цилиндрические батарейки, тоньше элементов АА, но могут применяться в тех же приборах.
С (R14/LR14) и D (R20/LR20) – похожие по форме и размеру элементы, по сравнению с АА и ААА очень громоздкие и тяжелые. Сегодня производители редко прибегают к установке данных элементов питания, так как размеры гаджетов становятся все меньше и компактнее, батарейки соответственно тоже.
Крона (6F22 / 6LR61) – данный элемент питания отличается от предыдущих размерами, формой и самым высоким напряжением 9V. Контакты батарейки находятся с одной стороны. Применяется в современных приборах крайне редко.
К отдельной категории следует отнести миниатюрные элементы питания, выполненные в виде «таблетки». Они имеют собственную обширную маркировку и классификацию, отличаются по диаметру, высоте, емкости, химическому составу.
Важные особенности
— Саморазряд. Это потеря емкости батареи за период хранения, поэтому у каждого элемента питания есть срок годности. За время хранения (без использования) батарейки емкость может сократиться до 30%, так же многое зависит от температуры хранения. Происходит это из-за медленного протекания химических процессов внутри батарейки, т.е. процесс протекает все время, просто в рабочем режиме химические реакции проходят быстрее, а в состояние покоя медленнее. Когда покупаете батарейки, обязательно смотрите на дату производства, чем она свежее, тем больше емкость соответствует заявленной.
— Напряжение. В зависимости от вида и типа батарейки варьируется напряжение, которое она обеспечивает. Стандартное напряжение бюджетных элементов питания 1,5V, литиевые батарейки обеспечивают напряжение в 3V. Самым мощным элементом питания следует считать Крону, напряжение составляет 9V.
— Емкость. Показатель, определяющий количество «электричества» с батарейке, срок службы элемента питания напрямую зависит от емкости. Как рассчитать время выработки батарейки?
Для расчета важно знать два параметра: заряд и потребляемый ток. Допустим заряд батарейки 3 Ач и установлена она в устройство с потреблением тока 250 мАч (0,25Ач), рассчитываем сколько часов проработает батарейка: 3 Ач / 0,25 Ач = 12 часов.
Фактический срок службы может не совпадать с рассчетным по ряду причин:
• Температура внешней среды
• Саморазряд
• Режимы использования
• Ток отсечки
Подводим итоги
Многие производители указывают на упаковке для каких устройств подходит элемент питания. Но что делать, если область применения не указана? Подбираем батарейку в зависимости от целей использования:
— Солевые элементы питания нет смысла устанавливать в приборы, выдающие высокую мощность: профессиональные фонари, вспышки фотоаппаратов. В приборах со средними нагрузками солевые элементы питания тоже прослужат недолго. Все дело в маленькой емкости, всего 600-700 мАч.
— Щелочные батарейки так же не подойдут для мощных осветительных приборов, но долго прослужат во всех остальных гаджетах, начиная от музыкальной колонки и заканчивая детским паровозиком.
— Литиевые элементы питания подойдут абсолютно для любого устройства, но не всегда имеет смысл покупать дорогостоящий элемент. Оптимальный выбор для приборов частого использования.
Важно: просто выбросить отработанную батарейку в мусорное ведро не правильно!
На упаковке или корпусе всегда присутствует обозначение -не выбрасывать вместе с бытовым мусором. Если в вашем городе есть пункт приема, то не поленитесь сделать мир чуточку чище.
типы аккумуляторных батарей и их особенности
Одной из важнейших составляющих электрического оборудования и техники любого типа является аккумуляторная батарея, или, проще говоря, аккумулятор. Существуют различные виды аккумуляторов, и в данной статье речь пойдет обо всех типах таких приспособлений.
Самый первый АКБ был создан более полутора столетий назад во Франции ученым Гастоном Планте. С каждой последующими попытками усовершенствования устройства становились все лучше, однако принцип их функционирования и строение остались неизменны. Сейчас же существуют самые разнообразные типы аккумуляторов: Li-Ion, Ni-MH, Ni-Cd и многие другие. Они имеют примерно одинаковый принцип работы, но у каждого — свои особенности. Стоит рассказать обо всех этих разновидностях по порядку.
Устройства с пониженным содержанием сурьмы
Пожалуй, стоит начать описание с одного из самых часто применяемых видов аккумуляторов. АКБ с содержанием менее 5% сурьмы избавили от необходимости частого добавления дистиллированной воды. Хотя это не делает аккумуляторы данного типа необслуживаемыми из-за имеющихся расходов жидкости.
Также они обладают крайне малой степенью саморазряда батареи и переносимости электрических характеристик автомобильной бортовой сети, в отличие от своих более новых аналогов.
Сурьмянистые аккумуляторы
Данный вид аккумуляторных батарей признан устаревшим. Ему на замену пришли более современные и усовершенствованные типы АКБ с пониженным содержанием сурьмы. Однако до сих пор аккумуляторы данного вида служат по своему назначению в стационарных токовых источниках с неприхотливыми батареями.
Кальциевые альтернативы
Кальциевые АКБ хороши тем, что они уменьшают интенсивность электролиза и снижают уровень электролита. Помимо этого, кальций, заменивший сурьму, увеличил напряжение, нужное для начала осуществления электролиза, что уменьшило критичность последствий перезаряда.
Но не стоит забывать, что, как и все существующие типы аккумуляторных батарей, кальциевые АКБ обладают своими слабыми сторонами. Главный минус — повышенная чувствительность к мощному разряду ведет к резкому падению емкости.
Щелочные АКБ
Щелочными батареями называют такие устройства, в которых электролитом выступает щелочь, а не кислота. Устройства такого вида встречаются в автомобилях далеко не часто, однако они могут выступать в качестве аккумуляторов, например, для шуруповертов.
Одним из таких приспособлений является Ni-Cd аккумулятор — по факту его признали устаревшим, тем не менее он еще может встать наравне со своими более новыми конкурентами за счет дешевизны. Однако так называемый «эффект памяти» и повышенный саморазряд делают применение Ni-Cd устройства весьма проблематичным.
Его никель-металл-гидридный конкурент, разумеется, выше по цене, но при этом по качеству он существенно лучше. По сравнению с Ni-Cd аналогами, «эффект памяти» у них выражается в меньшей степени, хотя он все же присутствует. Также увеличенная вместимость и пониженный саморазряд вполне объясняют высокую цену.
Литий-ионная альтернатива
Пожалуй, из всех существующих видов аккумуляторов для автомобилей и не только самым лучшим можно назвать Li-ion. Он стоит значительно дороже своих Ni-MH и Ni-Cd аналогов. Это можно объяснить тем, что аккумуляторы с ионами лития не имеют тех недостатков, которыми обладают рассмотренные ранее модели. Хотя приспособления такого вида, равно как и все существующие устройства, все же не лишены своих слабых сторон, причем действительно существенных.
Среди главных уязвимостей можно выделить:
- чрезмерную чувствительность к низким температурам, из-за чего уменьшается ток, отправляемый li-ion батареей;
- уменьшение вместимости с каждым годом;
- литий-ионные приспособления не выдерживают тотальной разрядки и зарядки до конца — в противном случае это оканчивается разрушением и даже взрывом прибора. Подробнее о том, как правильно заряжать Li-ion аккумуляторы →
Модели такого типа широко применимы в качестве зарядного устройства для мобильных устройств. В случае, если технологический прогресс дойдет до достаточного уровня, чтобы Li-Ion приспособления лишились своих уязвимостей, они сумеют встать на замену кислотным батареям.
Стоит также заметить, что в старых моделях литий-ионных аккумуляторов применялись разнообразные оксиды лития, в которых также содержался марганец либо кобальт. Однако в более новые модели эти элементы добавлять перестали, заменив их сплавами литий-ферро-фосфатов в связи с их дешевизной, уменьшенной токсичностью и более простой возможносттю переработки.
Литий-полимерные аккумуляторы
Литий-ионный полимерный аккумулятор, известный также как Li-Pol, LiPo, Li-polymer, представляет собой улучшенную версию стандартного литиевого аккумулятора и находит применение во многих видах техники. Электролитом здесь служит полимерный материал.
Такие типы литиевых аккумуляторов хороши тем, что обладают значительной энергетической плотностью на единицу объема и массы, пониженным саморазрядом, донельзя тонкими элементами (всего от 1 мм), возможностью гибкости, крайне несущественным перепадом напряжения в процессе разрядки, широким диапозоном температур, при которых устройство продолжит свою полноценную работу. И, ко всему прочему, LiPo не имеет эффекта памяти.
Хотя не стоит слепо полагать, что батареи такого плана на самом деле можно назвать полностью идеальными. Даже у Li-Pol есть свои изъяны. Один из самых существенных — опасность возгорания в случае перезарядки и избыточного потребления тепла. Недостатком представляется и сравнительно небольшое количество рабочих циклов — 800-900, а также старение аккумуляторов, даже если они лежат в стороне без надобности.
Наконец, даже сама зарядка весьма пагубно влияет на приспособление: если процесс зарядки уменьшает вместимость, то при глубоком заряде прибор можно смело отправлять в металлолом.
AGM и GEL-батареи
Гелевые батареи, как их часто называют, выступили как альтернативный вариант, безопасный в использовании. Проблему безопасности решили посредством перемещения электролита в связанное состояние, чтобы обеспечить уменьшение текучести.
Другими достоинствами GEL-батарей стали:
- пониженное осыпание активной массы пластин;
- пониженный саморазряд;
- переносимость к вибрации.
Их также можно наклонять практически под любым удобным углом, они могут храниться в течение достаточно продолжительного времени за счет медленного саморазряда, а переразряд не «смертелен» и не несет никакого ущерба технике в процессе.
А вот перезарядка устройства этого типа, наоборот, может крайне отрицательно повлиять на него. Поэтому AGM и GEL-батареи все же требуют очень аккуратного и бережного обращения.
К примеру:
- несмотря на то, что их можно класть чуть ли не как угодно, их нельзя держать перевернутыми;
- работа при пониженных температурах может резко снизить функциональность приборов;
- особых мер предосторожности требует особая чувствительность приспособлений к зарядке.
При надежном хранении устройства оно сможет прослужить до десяти лет.
Гибриды
Название говорит само за себя: гибридными считаются те батареи, в строение которых входят неодинаковые пластины, то есть выполненные из различных материалов. Стоит учесть, что положительно заряженные пластины включают в себя компоненты сурьмы (ее содержание в них не превышает 5%), в то время как отрицательно заряженные пластины имеют в составе кальциевые компоненты.
Новый, чуть ли не революционный метод изготовления аккумуляторных батарей смог привести к следующему:
- Во-первых, если сравнивать аккумуляторы с пониженным содержанием сурьмы, расход жидкости очевидно уменьшается.
- Во-вторых, батарея стала более устойчивой и выносливой к перепадам напряжения, даже в случаях интенсивной зарядки и тотальной разрядки.
Конечно, это вовсе не означает, что данные аккумуляторы можно считать полностью идеальными «без единого изъяна». Они не имеют никаких особых преимуществ над всеми вышеописанными устройствами. Но при этом по качеству характеристик их можно поставить прямо посередине этого ряда.
Никель-металл-гидрид
Никель-металл-гидриды, или Ni-MH, как их обозначают в сокращенном варианте, являются такими видами аккумуляторных батарей, где в качестве отрицательного иона выступает водородный металлогидридный электрод, калиевый гидроксид в качестве электролита, никелевый — в качестве положительного иона.
Существует немалое количество различных типов батарей Ni-MH. К примеру, есть батареи долгого хранения LSD NiMH, которым не страшен мороз и длительный срок хранения. Они функционируют и с повышенными токами разряда, не разрываясь и не приходя в негодность из-за чрезмерной нагрузки.
Поэтому, к примеру, никель-металл-гидриды размера АА могут быть применимы в различных видах мелкой техники. Так, АА с большим объемом емкости в 1500-3000 мА/ч можно поместить в музыкальный плеер, радиоуправляемые игрушки, фотоаппарат и многие другие приспособления, где будет произведена зарядка за относительно непродолжительное время.
Весьма хороши и АА-батареи с уменьшенным объемом вместимости — такие АА, где емкость составляет всего 300-1000 мА/ч. АА данного типа применимы в качестве обеспечения питанием неавтоматических фонариков, управляемых пультом ДУ игрушек, раций и электронных приспособлений со сбалансированным энергопотреблением.
Свинцово-кислотный аккумулятор
Свинцово-кислотная батарея стала первым изобретенным аккумулятором, увидевшим свет и нашедшим широкое применение в автомобилях и ряде других технических приборов.
Свое название приспособление получило за счет опущенных в воду и серную кислоту пластин из свинца, выполняющих роль электродов, хотя с течением времени водород в устройстве начинает теряться.
Популярность такие приспособления получили неслучайно, а благодаря очевидным достоинствам:
- отсутствие эффекта памяти;
- наличие необслуживаемых экземпляров;
- невысокая цена;
- несложная конструкция;
- надежная технология;
- пониженный авторазряд;
- потенциал увеличенной токоотдачи.
Хотя, несмотря на немалое количество достоинств, даже у этих моделей есть и свои слабые стороны:
- невозможность хранения разряженными;
- чрезмерная чувствительность к температурным изменениям, влияющая на продолжительность функциональности и жизни;
- ограниченность транспортов и дозволяемых целых циклов разряда;
- и, разумеется, самый очевидный изъян — пагубное влияние свинца на экологическую среду.
Никелево-железные аналоги
Дешевые и малообслуживаемые Ni-Fe, они же никелево-железные батареи, обладают никель оксидо-гидроксидами, используемые как положительные пластины. В роли отрицательных пластин выступают оксиды-гидроксиды феррума. Жидкий электролит представляется в виде разъедающего калия.
Стоит признать, что данный тип батарей весьма надежен благодаря выносливости к тотальным разрядам, частой перезарядке. В отличие от той же свинцово-кислотной альтернативы, такие аккумуляторы не выйдут из строя, будучи в недозаряженном состоянии.
виды батарей, их преимущества и недостатки
Аккумуляторные батареи прочно вошли в жизнь современного человека и активно используются в мобильных электронных устройствах и автомобилях. Однако не все они одинаковые: существует несколько типов аккумуляторов. Различия между ними заключаются в материалах, из которых изготовлены электролит и электроды. От этого зависят технические характеристики АКБ, например, электрическая емкость и количество циклов перезарядки .
Принцип работы и устройство
Аккумуляторы представляют собой химические источники электрического тока. Для увеличения электрической емкости в их состав включается несколько элементов питания. Например, в автомобильных АКБ чаще всего используется шесть элементов (банок) с напряжением в 2,1 вольта. В результате аккумуляторная батарея способна выдавать около 12,6 В.
Первый аккумулятор был создан много лет назад, но его конструкция и принцип работы остались прежними. С тех времен изменились только материалы, используемые для изготовления электродов и раствора электролита.
При разговоре о том, какие бывают аккумуляторные батареи, многие сразу вспомнят о литий-ионных (Li — ion). Они сегодня активно используются в портативной электронике, например, смартфонах и ноутбуках.
Принцип работы АКБ можно рассмотреть на примере литий-ионной батареи. Два электрода (катод изготовлен из алюминиевой фольги, а анод из медной) находятся в пористом материале (сепараторе), который пропитан электролитом. Заряд в аккумуляторе переносится с помощью положительных ионов лития, которые во время разрядки перемещаются от катода к аноду. Когда АКБ заряжается, ионы двигаются в противоположном направлении.
Основные виды АКБ
В зависимости от вида, аккумуляторные батареи отличаются техническими характеристиками. Говоря о том, какие бывают АКБ, стоит познакомиться с особенностями наиболее распространенных.
Сурьмянистые или традиционные
Эти батареи содержат 5% и более сурьмы. Хотя они и называются традиционными (классическими), в современных устройствах это вещество используется в меньших количествах. Сурьма входит в состав пластин для увеличения их прочности, так как свинец в чистом виде является очень мягким металлом. Кроме этого, сурьма способствует ускорению процесса электролиза, активизирующегося в аккумуляторе при напряжении в 12 В.
В результате уровень электролита постепенно уменьшается, и пластины оголяются. Это делает сурьмянистый аккумулятор требовательным к обслуживанию, которое заключается в доливании дистиллированной воды. Сегодня этот тип АКБ уже не устанавливается в автомобили, так как был вытеснен более современными типами батарей.
Малосурьмянистые батареи
Снижение количества сурьмы в пластинах (менее 5%) позволило снизить интенсивность процесса испарения воды из раствора электролита. В результате этот тип аккумуляторных батарей не нуждается в частом обслуживании, что является его бесспорным преимуществом. Также, в отличие от традиционных АКБ, малосурьмянистые обладают меньшим показателем саморазряда.
В сравнении с новыми видами АКБ, например, гелевыми, батареи с малым содержанием сурьмы более терпимы к параметрам бортовой сети машины.
Специалисты уверены, что в отечественные автомобили стоит устанавливать именно малосурьмянистые батареи. Это связано с тем, что не все модели российских машин способны обеспечить стабильное напряжение в бортовой электросети.
Кальциевые и гибридные
Введение в кристаллическую решетку свинцовых пластин кальция вместо сурьмы позволило значительно уменьшить потери воды в банках из-за электролиза. Если в обозначении АКБ указана маркировка Са/Са, то кальций входит в состав как положительных, так и отрицательных электродных пластин. Для увеличения эффективности кальциевых аккумуляторов некоторые производители добавляют небольшое количество серебра.
В современных батареях этого типа на протяжении всего срока эксплуатации вода практически не испаряется. В результате автовладельцу не приходится контролировать уровень и плотность раствора электролита. Введение в состав электродов кальция позволило снизить показатель саморазряда примерно на 70% в сравнении с сурьмянистыми. В результате такие батареи могут сохранять свои технические характеристики на протяжении длительного отрезка времени.
Однако без недостатков не обошлось — кальциевые АКБ отличаются высокой чувствительностью к перепадам напряжения в бортовой электросети. Кроме этого, они отличаются более высокой стоимостью в сравнении с содержащими небольшое количество сурьмы. Устанавливать их стоит на иномарки, качественное электрооборудование которых гарантирует стабильность всех электрических характеристик.
В попытке объединить достоинства малосурьмянистых и кальциевых батарей на свет появились гибридные. Отличить их можно по маркировке, в которой встречаются обозначения Са/Sb либо Ca+. Они говорят о том, что пластины электродов изготовлены по разным технологиям. Такие аккумуляторы имеют средние характеристики.
Гелевые аккумуляторы и AGM
В этих батареях электролит находится в связанном состоянии, а создавались они для повышения безопасности эксплуатации. В классических АКБ электролит может протекать, а кислота является весьма агрессивным веществом. Уменьшение показателя текучести раствора позволило не только сделать батареи более безопасными, но и замедлить процесс осыпания активного материала электродных пластин.
Гелевая технология отличается от AGM способом связывания раствора электролита. В первом случае в него добавляются соединения кремния, а во втором — раствором пропитывается пористое стекловолокно, расположенное между электродами. Название технологии AGM (Absorbent Glass Mat) можно перевести, как «абсорбирующий стекломатериал».
Среди преимуществ батарей этого типа следует отметить:
- Большое количество циклов перезарядки.
- Высокий КПД.
- Могут устанавливаться в наклонном положении.
- Не требуется обслуживание.
- Высокая безопасность при эксплуатации.
Среди недостатков стоит выделить непереносимость низких температур, а также требования к стабильным характеристикам бортовой системы автомобиля. Кроме этого, стоимость гелевых АКБ довольно высокая.
Щелочные устройства
В таких батареях в качестве электролита используются не кислоты, а щелочи. Сегодня существует много видов аккумуляторов, изготовленных по этой технологии. Однако они крайне редко используются в автомобилях. В сравнении с кислотными АКБ, щелочные обладают рядом преимуществ:
- Хорошо переносят циклы перезарядки.
- Могут длительное время сохранять характеристики при хранении.
- Менее восприимчивы к низким температурам.
- Не выделяют вредные вещества.
- Способны накапливать большую емкость на единицу собственной массы.
Есть у щелочных АКБ и недостатки. Во-первых, они имеют меньшее напряжение, что приводит к увеличению количества банок и, соответственно, габаритов. Во-вторых, стоимость их выше, чем у кислотных.
Литий-ионные и полимерные
Именно этот тип АКБ считается наиболее перспективным. Используя разный материал электродов, можно изменять характеристики аккумулятора. Среди преимуществ литий-ионных батарей можно отметить:
- Высокий показатель электрической емкости.
- Напряжение каждого отдельного элемента батареи выше в сравнении с другими типами.
- Низкий уровень саморазряда.
Однако и недостатков у них много. Наиболее существенный — это химическая деградация, которая приводит к уменьшению срока хранения батарей. Также они весьма чувствительны к низким температурам. Сегодня литий-ионные аккумуляторы активно используются в портативных электронных девайсах и значительно реже в автомобилестроении.
Литий-полимерные АКБ являются результатом совершенствования технологии изготовления литиевых батарей. Роль электролита в них выполняет особый полимерный материал.
Они лишены некоторых недостатков предыдущей технологии. Однако пока не удалось устранить химическую деградацию: получилось несколько замедлить этот процесс. Кроме этого, полимерные АКБ, в случае перегрева или при получении чрезмерного заряда, склонны к самовозгоранию, что и является их главным недостатком.
Работы над усовершенствованием аккумуляторных батарей ведутся постоянно. В основном они направлены на увеличение показателя энергоемкости, применение максимально безопасных материалов и повышение морозоустойчивости. Большинство специалистов уверены, что в ближайшее время на смену свинцово-кислотным АКБ придут более эффективные источники питания.
европейская и азиатская, виды корпусов автомобильных АКБ
Столкнувшись с необходимостью замены аккумулятора, владелец автомобиля оказывается перед сложным выбором. После долгого изучения предложений рынка автомобильных комплектующих, определившись с выбором модели подходящей емкости, покупатель узнает, что еще бывает разный тип клемм аккумулятора. Для выяснения нужного типа можно и заглянуть под капот, сверить со старым прибором, но понять для себя, чем отличается их расположение, будет очень полезно.
Полярность батареи
Как все помнят из школьной программы, полярность — это порядок расположения электродов на корпусе аккумулятора. Например, самый распространенный европейский стандарт конус «А» имеет отрицательный токовывод диаметром 17,9 мм, а положительный — 19,5 мм. Поэтому, принимая решение о приобретении новых контактов, необходимо взвесить все за и против, то есть изучить все их параметры:
- диаметр разъема;
- длину соединительного провода;
- максимальную силу тока, на которую они рассчитаны.
Ошибившись с их расположением на новом приборе, можно столкнуться со сложностью подключения: не хватит длины монтажных проводов, или разъемы отличаются от необходимых. При неправильном подключении возникает огромный риск получить замыкание или, что гораздо хуже, сжечь полностью электропроводку авто. Есть два вида контактов:
- Прямой полярности: «плюсовой» электрод расположен с левой стороны корпуса. По большей части применяется в авто, выпущенных отечественными производителями.
- Обратная полярность: пластина «плюсового» электрода размещается как правило на корпусе справа. Встречается на автомобилях азиатской и американской сборки.
Вид полярности легко определить, расположив аккумуляторную батарею контактами вниз и посмотрев, с какой стороны корпуса находится (+). Кроме прямого и обратного расположения, аккумуляторные клеммы имеют ряд других отличий.
Различия по размеру
При несовпадающей форме клемм и контактов батареи рекомендуется либо заменить контакты, либо воспользоваться подходящим переходником, который можно найти в том же магазине, где приобретался аккумулятор. Если «народные умельцы» уверяют, что в машину, где технически предусмотрен типоразмер Т3, можно «втиснуть» аккумулятор с клеммами Т1, просто разжав их на проводах, прислушиваться к этому мнению не стоит.
Кустарный способ крепления контакта может лишить владельца заводских гарантий и прибавить сложностей. Клеммы аккумуляторов, прежде всего, могут отличаться по форме и размеру:
- Аккумуляторы отечественного производства на своих корпусах имеют высокие конические клеммы, причем плюсовая по диаметру больше, чем клемма «массы». На аккумуляторах американского типа можно увидеть винтовой выход для грузовых автомобилей — «под болт».
- Конической формы для отечественных или европейских авто — стандартного диаметра (тип клемм T1, диаметр «+» — 19,5 мм, «-» — 17,8 мм), для автомобилей японского автопрома диаметр меньше (тип T3, диаметр «+» — 12,7 мм, «-» — 11,1 мм).
Часто в автомобилях азиатской сборки плюсовая клемма очень массивна, это затрудняет подключение источника питания типа «евро». Современный рынок аккумуляторных батарей предлагает достаточно широкий ассортимент, поэтому выбрать аккумулятор с нужным типоразмером и правильной полярностью не составит большого труда.
Виды корпусов АКБ
Любые несоответствия конструкции всегда сказываются прежде всего на безопасности при эксплуатации автомобиля. Если возникают сомнения при выборе аккумулятора, всегда можно прибегнуть к консультации опытного специалиста.
Как правило, сотрудники, занимающиеся продажей АКБ, знают все тонкости и нюансы относительно типоразмеров и видов клемм аккумулятора, типов корпусов, а при наличии дополнительной важной информации марки и модели автомобиля помогут выбрать оптимально подходящий вариант. Кроме различного диаметра типов клемм автомобильных аккумуляторов, в «европейской» и «азиатской» моделях есть существенные различия в способах крепления:
- Европейский тип корпуса аккумулятора: клеммы слегка утоплены в корпус. Конструкторы считают такой способ расположения безопасным — снижается возможность замыкания.
- Азиатский тип корпуса: клеммы выступают над корпусом АКБ. Если конструкция авто допускает установку «азиатского» источника питания, все в порядке. Места под крышкой капота хватает, безопасность соблюдена. Если автомобиль строго «европейской» сборки, есть риск, что крышка капота просто не закроется — будут мешать выступающие клеммы. Если же поставить аккумулятор с другим типом корпуса все же получилось, внимательно изучите, достаточно ли свободного пространства между крышкой капота и клеммами, есть шанс избежать замыкания электропроводки автомобиля.
Использование аккумуляторной батареи того типа, который предусмотрел производитель, гарантирует бесперебойную и безаварийную работу всех энергопотребляющих систем и приборов автомобиля на долгие годы.
Что такое аккумулятор? — learn.sparkfun.com
Добавлено в избранное Любимый 20Введение
Батареи — это совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться на катод, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбрасывать после использования, известны как первичные батареи .Аккумуляторы, которые можно перезаряжать, называются вторичными батареями и .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к сети (как в старые добрые времена). Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac.Даже не думайте пытаться их перезарядить. Используйте их с…
1История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в случае артиллерийской батареи. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, соединенных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушки на лапах на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из набора цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления к гальванической свае
Уильям Крукшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, а свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую батарею «сухих элементов» в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Цинк-угольная батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Японская компания Asahi Chemical создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.В конце 1990-х годов для литий-ионных аккумуляторов был создан мягкий гибкий корпус, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но вы поняли.Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На аккумуляторах катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде.Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, которое способно переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения.
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, мягких пластиковых пакетов и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри анода или вокруг него, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
Некоторые реакции окисления образуют ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже когда батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задымляются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в аккумуляторе в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении аккумулятора, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичный
Первичные клетки содержат химический состав, который нельзя изменить. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, иначе известные как «аккумуляторные батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение всего цикла разряда.
Вместимость
Емкость аккумулятора — это мера количества электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей цепи, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-скорость
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5С для той же батареи будет 2 А.
Большинство батарей теряют емкость при повышенном потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких скоростях C.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или ниже.
MIT предлагает фантастическое руководство по спецификациям и терминологии батарей, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот экран для фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо обязательно использовать специальные схемы, известные как «балансировщик», чтобы обеспечить равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельно
Если напряжение отдельного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо различия в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, поскольку может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация для схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батарейки и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Simple English Wikipedia, бесплатная энциклопедия
Схематический символ батареиАккумулятор преобразует химическую энергию в электрическую с помощью химической реакции.Обычно химические вещества хранятся внутри батареи. Он используется в цепи для питания других компонентов. Батарея производит электричество постоянного тока (DC) (электричество, которое течет в одном направлении и не переключается взад и вперед).
Использование электричества из розетки в здании дешевле и эффективнее, но аккумулятор может обеспечивать электричеством в районах, где нет распределения электроэнергии. Это также полезно для движущихся вещей, например электромобилей и мобильных телефонов.
Батареи могут быть первичными или вторичными. Первичная цепь выбрасывается, когда она больше не может обеспечивать электричество. Вторичный аккумулятор можно заряжать и использовать повторно.
Батарея может состоять из одной ячейки или нескольких элементов . Каждая ячейка имеет анод, катод и электролит. Электролит — это основной материал внутри батареи. Часто это кислота, к которой прикасаться опасно. Анод реагирует с электролитом с образованием электронов (это отрицательный конец или –).Катод реагирует с электролитом и забирает электроны (это положительный конец или или + ). [1] Электрический ток возникает, когда провод соединяет анод с катодом, и электроны перемещаются от одного конца к другому. (Но аккумулятор может быть поврежден просто проводом, соединяющим два конца, поэтому между двумя концами также необходима нагрузка . Нагрузка — это то, что замедляет электроны и обычно делает что-то полезное, например, лампочка в фонарик, или электроника в калькуляторе). [2]
Батареи, подключенные параллельно — показаны на схеме и на чертежеЭлектролит может быть жидким или твердым. Батарея называется аккумулятором с влажным или сухим элементом, в зависимости от типа электролита.
Химические реакции, происходящие в батарее, являются экзотермическими реакциями. Этот тип реакции вызывает тепло. Например, если вы оставите ноутбук включенным на долгое время, а затем прикоснетесь к аккумулятору, он будет теплым или горячим.
Аккумуляторная батарея заряжается путем обращения вспять химической реакции, происходящей внутри батареи.Но перезаряжаемый аккумулятор можно заряжать только определенное количество раз (время перезарядки). Даже встроенные батареи нельзя заряжать вечно. Более того, каждый раз, когда батарея заряжается, ее способность удерживать заряд немного снижается. Неперезаряжаемые батареи нельзя заряжать, так как могут вытечь различные вредные вещества, например гидроксид калия.
Ячейки могут быть подключены, чтобы сделать батарею большего размера. Соединение плюса одной ячейки с минусом следующей ячейки называется соединением их последовательно .Напряжение каждой батареи складывается. Две батареи по шесть вольт, соединенные последовательно, будут составлять 12 вольт. [3]
Соединение положительного полюса одной ячейки с положительным полюсом другого, а отрицательного — с отрицательным называется соединением их параллельно . Напряжение остается прежним, но ток складывается. Напряжение — это давление, проталкивающее электроны по проводам, оно измеряется в вольтах. Ток — это то, сколько электронов может пройти одновременно, он измеряется в амперах.Комбинация тока и напряжения — это мощность (ватты = вольт x ампер) батареи.
Батареи бывают разных форм, размеров и напряжений.
Элементы AA, AAA, C и D, включая щелочные батареи, имеют стандартные размеры и форму и имеют напряжение около 1,5 В. Напряжение ячейки зависит от используемых химикатов. Электрический заряд, который он может передать, зависит от размера ячейки, а также от химических веществ. Заряд аккумулятора обычно измеряется в ампер-часах.Поскольку напряжение остается неизменным, больший заряд означает, что более крупный элемент может подавать больше ампер или работать дольше.
Первая батарея была изобретена в 1800 году Алессандро Вольта. В наши дни его аккумулятор называют гальваническим. [4]
В современных небольших батареях жидкость иммобилизируется в виде пасты, и все это помещается в герметичный корпус. Из-за этого ничего не может вылиться из аккумулятора. В более крупных аккумуляторах, таких как автомобильные, все еще есть жидкость, и они не герметичны.Разновидность батареи, в которой в качестве электролита используются расплавленные соли, была изобретена во время Второй мировой войны.
- Сухие элементы, элементы, не содержащие жидкости (или содержащие иммобилизованную жидкость, такую как паста или гель) в качестве электролита
- Первичная ячейка, ячейки, которые нельзя перезарядить
- Щелочная батарея, «щелочная», не перезаряжаемая
- Батарея ртутная, неперезаряжаемая
- Аккумулятор Leclanche, «сверхтяжелый», не перезаряжаемый
- Литиевая батарейка, неперезаряжаемая, «таблетка»
- Батарея из оксида серебра, неперезаряжаемая, батарейка для часов
- Вольтаическая свая, первая батарея Аллесандро Вольтаса
- Вторичный элемент, элементы, которые можно заряжать
- Первичная ячейка, ячейки, которые нельзя перезарядить
- Влажные элементы, элементы, содержащие жидкость в качестве электролита
- Топливный элемент, перезаряжаемый за счет добавления топлива
Топливные элементы и солнечные элементы не являются батареями, потому что они не накапливают энергию внутри себя.
Конденсатор не является батареей, потому что он не накапливает энергию в химической реакции. Конденсатор может накапливать электричество и производить электричество намного быстрее, чем батарея, но обычно он стоит слишком дорого, чтобы сделать его настолько большим, насколько может быть батарея. Ученые и инженеры-химики работают над улучшением конденсаторов и аккумуляторов для электромобилей.
Небольшие электрические генераторы, приводимые в действие руками и ногами, могут обеспечивать питание небольших электрических устройств. Радиоприемники с часовым механизмом, заводные фонари и аналогичные устройства также имеют заводную пружину для хранения механической энергии.
Battery (преступность) — Простая английская Википедия, бесплатная энциклопедия
Шкала баланса, обычно ассоциируемая с законом и правосудием.Батарея — умышленный и оскорбительный или вредный контакт с другим человеком. [1] Точное определение зависит от юрисдикции. В уголовном праве элементами побоев являются физический контакт с причинением вреда или оскорбительный контакт без согласия этого человека. [2] Батарея часто путают с нападением, которое угрожает разряжению.Батарея — это когда угроза (нападение) осуществляется и человеку каким-либо образом причинен вред. [3] Уголовное и гражданское побои могут быть одинаковыми или незначительно отличаться в зависимости от юрисдикции. Во многих случаях акт побоев может повлечь как уголовную, так и гражданскую ответственность. [3]
Гражданская батарея — это деликт. Это преступление, совершенное против другого человека, которое приводит к ущербу. [3] Это также называется умышленным деликтом. В большинстве случаев они являются результатом небрежности, вызванной небрежностью или опрометчивостью. [3] Лицо, в отношении которого было совершено избиение, потерпевшее, может подать иск в суд о взыскании денежной компенсации. [4]
Преступное избиение является результатом нарушения закона о причинении вреда другому человеку. Уголовные дела возбуждаются государством. [3] Существует четыре элемента уголовного преследования: [4]
Если все четыре элемента могут быть доказаны, существует дело prima facie , позволяющее возбудить судебное преследование преступника.
В большинстве случаев гражданский иск следует за уголовным процессом.Признание невиновным по уголовному делу не препятствует подаче потерпевшим гражданского иска. Бремя доказывания в гражданском суде обычно меньше, чем в уголовном. [3]
Аккумулятор с отягощением и простой аккумулятор [изменить | изменить источник]
Когда суд говорит о «батарее», обычно подразумевают просто батарею. [5] Простая батарейка — это чаще проступок. К элементам простой батареи относятся: [5]
- Несанкционированное или незаконное применение силы.
- Батарея в лицо другому.
- Имеется физическая травма или прикосновение оскорбительного характера.
Обостренный аккумулятор серьезнее простой аккумулятор. В большинстве юрисдикций избиение при отягчающих обстоятельствах является уголовным преступлением. Что определяет аккумулятор с отягчающими обстоятельствами, может варьироваться, но чаще всего включает: [6]
Преимущества и ограничения различных типов батарей
Нас часто озадачивают объявления о новых батареях, которые, как говорят, предлагают очень высокую плотность энергии, обеспечивают 1000 циклов заряда / разряда и имеют толщину как бумага.Они настоящие? Возможно — но не в одном аккумуляторе. Хотя один тип батарей может быть рассчитан на небольшой размер и длительную работу, этот аккумулятор не прослужит долго и преждевременно изнашивается. Другой аккумулятор может быть рассчитан на долгий срок службы, но его размер большой и громоздкий. Третья батарея может обеспечить все желаемые характеристики, но цена будет слишком высокой для коммерческого использования.
Производители аккумуляторов хорошо осведомлены о потребностях клиентов и отреагировали, предложив пакеты, которые лучше всего подходят для конкретных приложений.Индустрия мобильных телефонов — пример умной адаптации. Акцент делается на небольшие размеры, высокую удельную энергию и невысокую цену. На втором месте — долголетие.
Надпись NiMH на батарейном блоке не гарантирует автоматически высокую плотность энергии. Призматический никель-металлогидридный аккумулятор для мобильного телефона, например, имеет тонкую форму. Такой пакет обеспечивает плотность энергии около 60 Втч / кг, а количество циклов составляет около 300. Для сравнения, цилиндрический NiMH-аккумулятор обеспечивает плотность энергии 80 Втч / кг и выше.Тем не менее, количество циклов этой батареи от умеренного до низкого. Высокопрочные NiMH аккумуляторы, выдерживающие 1000 разрядов, обычно упаковываются в громоздкие цилиндрические элементы. Плотность энергии этих элементов составляет скромные 70 Втч / кг.
Компромиссы существуют и в отношении литиевых батарей. Литий-ионные блоки производятся для оборонных приложений, плотность энергии которых намного превышает их коммерческий эквивалент. К сожалению, эти литий-ионные батареи сверхвысокой емкости считаются небезопасными в руках населения, а высокая цена делает их недоступными для коммерческого рынка.
В этой статье мы рассмотрим преимущества и ограничения серийного аккумулятора. Так называемые чудо-батареи, которые просто живут в контролируемой среде, исключаются. Мы тщательно изучаем батареи не только с точки зрения плотности энергии, но и с точки зрения долговечности, характеристик нагрузки, требований к техническому обслуживанию, саморазряда и эксплуатационных расходов. Поскольку никель-кадмиевые батареи остаются стандартом, с которым сравниваются другие батареи, мы сравниваем альтернативные химические составы с этим классическим типом батарей.
Никель-кадмий (NiCd) — зрелый и хорошо изученный, но с относительно низкой плотностью энергии. NiCd используется там, где важны долгий срок службы, высокая скорость разряда и экономичная цена. Основные области применения — двусторонняя радиосвязь, биомедицинское оборудование, профессиональные видеокамеры и электроинструменты. NiCd содержит токсичные металлы и не наносит вреда окружающей среде.
Никель-металлогидрид (NiMH) — имеет более высокую плотность энергии по сравнению с NiCd за счет сокращения срока службы.NiMH не содержит токсичных металлов. Приложения включают мобильные телефоны и портативные компьютеры.
Свинцово-кислотный — наиболее экономичный для мощных систем, где вес не имеет значения. Свинцово-кислотная батарея является предпочтительным выбором для больничного оборудования, инвалидных колясок, аварийного освещения и систем ИБП.
Lithium Ion (Li ‑ ion) — самая быстрорастущая аккумуляторная система. Литий-ионный используется там, где первостепенное значение имеют высокая плотность энергии и легкий вес. Технология хрупкая, и для обеспечения безопасности требуется схема защиты.Приложения включают портативные компьютеры и сотовые телефоны.
Литий-ионный полимер (литий-ионный полимер) — предлагает свойства литий-ионного аккумулятора в сверхтонкой геометрии и упрощенной упаковке. Основное применение — мобильные телефоны.
На рисунке 1 сравниваются характеристики шести наиболее часто используемых систем аккумуляторных батарей с точки зрения плотности энергии, срока службы, требований к упражнениям и стоимости. Цифры основаны на средних номиналах имеющихся в продаже батарей на момент публикации.
Как работает аккумулятор — Любопытно
Представьте себе мир без батарей. Все портативные устройства, от которых мы так зависим, были бы настолько ограничены! Мы сможем доставить наши ноутбуки и телефоны настолько далеко, насколько это досягаемо для их кабелей, что сделает это новое работающее приложение, которое вы только что загрузили на свой телефон, практически бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой.Археологи считают, что на самом деле это не батареи, а в основном они использовались для религиозных церемоний.
Изобретение батареи в том виде, в котором мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать свою точку зрения другому итальянскому ученому Луиджи Гальвани. В 1780 году Гальвани показал, что лапы лягушек, подвешенных на железных или латунных крючках, подергиваются при прикосновении к зонду из какого-то другого металла. Он считал, что это вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенные на латунных крючках, подергивались, когда их ткнули зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.Вольта, первоначально впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит от двух разных типов металла (крючки, на которых висели лягушки, и другой металл зонда) и просто передается через них, а не через них. из тканей лягушек.Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанной соленой водой, и обнаружил, что электрический ток действительно течет через провод, приложенный к обоим концам стопки.
Батарея Алессандро Вольта: куча цинковых и серебряных листов, перемежаемых тканью или бумагой, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.Volta также обнаружил, что, используя различные металлы в свае, можно увеличить количество напряжения.Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. Это было довольно большое дело (Наполеон был весьма впечатлен!), И его изобретение принесло ему устойчивое признание в честь «вольта». ‘(мера электрического потенциала), названная в его честь.
Я сам, шутя в сторону, поражен тем, как мои старые и новые открытия … чистого и простого электричества, вызванного контактом металлов, могли вызвать такое волнение.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и действительно с подергивающимися лягушачьими лапами?
Химия батареи
Батарея — это устройство, которое накапливает химическую энергию и преобразует ее в электричество.Это известно как электрохимия, а система, лежащая в основе батареи, называется электрохимическим элементом. Батарея может состоять из одного или нескольких (как в оригинальной куче Вольты) электрохимических ячеек. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Итак, откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов.В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), А затем они перетекают на другой электрод, где расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и то, как они собраны вместе.
Электроды
Чтобы создать поток электронов, вам нужно где-то, чтобы электроны текли с из , а где-то электроны текли с по .Это электроды ячейки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Обычно это разные типы металлов или другие химические соединения.
В котле Вольта анодом служил цинк, от которого электроны текли по проволоке (при подключении) к серебру, которое было катодом батареи. Он сложил много этих ячеек вместе, чтобы получилась общая свая, и поднял напряжение.
Но откуда анод вообще берет все эти электроны? И почему они так счастливы, что их отправили в веселый путь к катоду? Все сводится к химии, происходящей внутри клетки.
Здесь происходит пара химических реакций, которые нам необходимо понять. На аноде электрод реагирует с электролитом в реакции, в которой образуются электроны. Эти электроны накапливаются на аноде. Между тем, на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин, обозначающий реакцию, которая включает обмен электронами, — это реакция окисления-восстановления, обычно называемая окислительно-восстановительной реакцией. Вся реакция может быть разделена на две половинные реакции, и в случае электрохимической ячейки одна полуреакция происходит на аноде, а другая — на катоде. Уменьшение — это усиление электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается во время реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности / эффективности реакции либо производить, либо поглощать электроны — ее силе в электронном перетягивании каната.
- Стандартные потенциалы для полуреакций
Ниже приведен список половинных реакций, которые включают освобождение электронов из чистого элемента или химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой желания водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородный полуреактион имеет нулевое значение E 0 ).E 0 измеряется в вольтах.
Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 скажут вам, в каком направлении будет протекать общая реакция: реакция с более отрицательной реакцией. Значение E 0 отдает свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном представляет собой напряжение ячейки.
Итак, если вы возьмете литий и фторид и сумеете объединить их, чтобы сделать элемент батареи, у вас будет самое высокое напряжение, теоретически достижимое для электрохимического элемента. Этот список также объясняет, почему в котле Вольта цинк был анодом, а серебро — катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996). .
Стандартные потенциалы для полуреакций восстановления
(относительно стандартного водородного электрода при 25 ° C)
E ° (В) Li + (водн.) + E — Li (s) –3.040 Be 2+ (водн.) + 2e — Be (s) –1,99 Al 3+ (водн.) + 3e — Al (s) –1,676 Zn 2+ (водн.) + 2e —
Энергия в кармане: как работает аккумулятор | EAGLE
Трудно представить мир без батареек. Попрощайтесь со смартфоном, который таскаете в кармане.Или ноутбук, который вы берете с собой куда угодно. О, а та машина, которую ты водишь? Боюсь, вам нужно научиться заводить его вручную, когда батарейки здесь уже нет. Эти маленькие химические супергерои играют огромную и жизненно важную роль в нашей современной жизни, но многие из нас принимают их как должное. Мы просто предполагаем, что они подключаются и обеспечивают питание для более важных целей, но как именно все это работает? К счастью, вы дизайнер электроники, поэтому вам нужно знать немного больше. Возможно, вы просто размещаете держатель батареи на своей печатной плате, но это помогает узнать, что делает эта батарея и почему.
Что такое аккумулятор?
Это может показаться риторическим вопросом, но что такое батарея? Конечно, мы знаем, что он обеспечивает питание, когда мы подключаем его к цепи, но в этом металлическом контейнере могут быть маленькие инженерные гномы, работающие за кулисами! Вы можете думать о батареях как о небольших капсулах с химическим потенциалом. Если оставить его в покое, химическое вещество внутри батареи ничего не делает, но когда вы подключаете его к цепи, эти химические вещества оживают, превращая химическую энергию в электрическую для питания всех ваших самых любимых электронных устройств.
Этот процесс преобразования химической энергии в электрическую может выделяться в течение нескольких дней, месяцев или лет, в зависимости от того, какой тип батареи вы выберете и сколько химикатов в ней. Например, вы можете заменять батарею в часах только раз в пять лет, но батареи AA в вашем контроллере Xbox, возможно, придется менять каждый месяц. Чтобы понять, как устроена батарея изнутри, полезно начать с общей анатомии и строения этих маленьких химических супергероев.
Внешняя структура
Начиная с внешней стороны, любая батарея, независимо от формы и размера, всегда будет иметь две клеммы, одну положительную (+) и одну отрицательную (-). В обычных сухих батареях типа AA или AAA эти две клеммы находятся на каждом конце устройства. Но на чем-то более крупном, например, автомобильном аккумуляторе, положительная и отрицательная клеммы расположены на верхней части устройства.
Обычная батарея на 9 В с положительной и отрицательной клеммами на одной стороне.(Источник изображения)
Независимо от того, где расположены клеммы аккумулятора, результат всегда один и тот же. Вы соединяете две клеммы вместе в цепь, чтобы выполнить определенную задачу, которая называется нагрузка . Нагрузкой может быть что угодно, от питания смартфона до вращения мотора.
Внутренняя работа
Внутри батареи происходит передача энергии. Здесь вы всегда найдете три основных компонента, независимо от того, на какую батарею вы посмотрите:
- Электроды .Сначала вы найдете пару электродов. Одним из них является анод , положительно заряженный электрод, который подключается к отрицательной клемме батареи. Другой — это катод , отрицательно заряженный электрод, который подключается к положительному выводу.
- Разделитель . Эти два электрода всегда следует держать отдельно друг от друга, иначе при включении в цепь произойдет короткое замыкание батареи. Здесь пригодится разделитель ; он не позволяет электронам течь прямо от анода к катоду.
- Электролит . Наконец, все батареи имеют своего рода химическую пасту или жидкую начинку с ионизированным элементом. У этих ионов много дополнительных электронов. Электролит в конечном итоге позволяет электрическому заряду течь между катодом и анодом. Без электролита в батарее не произошло бы никакого волшебства.
Здесь вы можете увидеть внутреннюю структуру типичной сухой аккумуляторной батареи. (Источник изображения)
Как работает аккумулятор?
Мы уже знаем, что батарея преобразует химическую энергию в электрическую для питания наших электронных устройств.Но как именно работает этот преобразующий процесс? Опять же, независимо от того, с какой батареей вы работаете, первичная электрохимическая реакция всегда одинакова.
Во-первых, вы должны подключить аккумулятор к цепи, имеющей нагрузку, или к той работе, которую должна выполнять батарея. После соединения двух клемм батареи между анодом, катодом и электролитом начинает происходить множество электрохимических реакций.
Первое, что происходит, это то, что анод подвергается процессу, называемому реакцией окисления .Это причудливый способ сказать, что группа избыточных электронов накапливается в аноде из-за смеси ионов в электролитной пасте. Если что-то и нужно знать об электронах, так это то, что они ненавидят находиться рядом друг с другом, когда их слишком много, и поэтому они будут искать новое место, чтобы называть их своим домом. Они могут просто пройти прямо к катоду, но их путь преграждает разделитель, поэтому им придется пройти долгий путь по цепи.
Пока на аноде происходит реакция окисления, на другой стороне батареи на катоде происходит реакция восстановления посредством обмена ионами и свободными электронами.Здесь катод сокращает количество электронов, создавая свободное пространство для электронов на аноде.
В реакциях окисления и восстановления электроны перемещаются от анода к катоду, чтобы найти баланс. (Источник изображения)
Итак, теперь у вас есть две противоположные переменные. У вас слишком много электронов на аноде и недостаточно электронов на катоде. Что происходит? Когда вы подключаете эту батарею к цепи, избыточные электроны на аноде будут проходить по цепи, питая все ваши компоненты, пока они, наконец, не достигнут катода.Этот процесс происходит снова и снова, все благодаря электрохимическому процессу, который приводит в движение электролит. В конце концов, электролитная паста закончится, и когда это произойдет, химическая реакция прекратится, и ваша батарея разрядится.
Чтобы любая батарея преобразовывала химическую энергию в электрическую, анод и катод должны быть сделаны из двух проводящих металлов. Почему это? Один металл в батарее должен быть готов накапливать избыточные электроны, а другой — для их уменьшения.Если бы вы использовали два металла одного и того же типа, они оба выполняли бы одно и то же действие, и электрохимический процесс никогда не сработал бы.
Используя два разных металла, например цинк в аноде и диоксид марганца в катоде, вы можете гарантировать, что существует сила, толкающая и тянущая электроны от одного вывода к другому. Весь этот процесс называется электроотрицательностью .
Вы можете увидеть, как все это объединяется, на практическом примере, таком как фонарик:
- Когда вы вставляете батарею в фонарик, вы замыкаете цепь, и химическая энергия внутри батареи начинает преобразовываться в электрическую.
- Внутри батареи избыточные электроны накапливаются на аноде в результате окисления, а электроны на катоде восстанавливаются.
- Электронам теперь нужно куда-то идти, поэтому они выбирают путь наименьшего сопротивления через вашу цепь для питания вашего фонарика, от анода до катода.
Батареи будут вести себя одинаково в любом устройстве. Всегда будет разница в электрическом заряде между положительным и отрицательным полюсами, что заставляет электроны течь и генерировать электричество.Без этой разницы в заряде электроны уже были бы в покое и балансе, так зачем им заставлять цепь работать?
Когда используется более одной батареи
Ваш простой фонарик может работать от одной батареи, но большинству устройств требуется более одного химического супергероя, чтобы получить электрическую энергию. От смартфонов до электромобилей вы обычно найдете аккумуляторы, расположенные одним из двух способов: Parallel или Serial . Вот разница между ними:
Параллельно
При параллельном подключении нескольких батарей вы получаете одинаковое общее напряжение, но увеличиваете ток.Этот повышенный уровень тока измеряется в ампер-часах или миллиампер-часах. Например, аккумуляторная батарея, измеренная на 500 миллиампер-часов, может производить 500 миллиампер тока на нагрузку в течение часа.
Батареи, включенные параллельно, увеличивают ток. (Источник изображения)
Серийный
При последовательном подключении нескольких батарей вы получаете одинаковый общий ток, но теперь ваше напряжение будет выше. Например, автомобильный аккумулятор имеет шесть отдельных аккумуляторных ячеек, каждая из которых на 2 вольта.В сумме этот автомобильный аккумулятор работает от 12 вольт.
Батареи, включенные последовательно, увеличивают свое напряжение. (Источник изображения)
Типы аккумуляторов
В мире аккумуляторов существует множество разновидностей на выбор, в зависимости от ваших конкретных потребностей. Вместо того, чтобы просто кидать вам огромный список, имеет смысл разделить батареи на две основные категории: Primary и Secondary .
Первичные батареи
Первичные батареи или первичные элементы — это типичные одноразовые батареи, которые работают один раз, пока не разрядятся, а затем выбрасываются.Эти батареи предлагают мгновенный источник энергии в вашем кармане и включают:
Цинк-углерод
Эта первичная ячейка представляет собой одноразовую батарею для повседневного использования, которая, вероятно, лежит у вас дома. Этот недорогой аккумулятор питает повседневные электронные устройства, от фонарика до пульта дистанционного управления. В угольно-цинковой батарее положительный электрод сделан из углерода, окруженного порошкообразным углеродом и оксидом марганца. Отрицательный электрод изготовлен из сплава цинка, а электролит состоит из пасты хлорида аммония.
Типичная угольно-цинковая батарея различных размеров. (Источник изображения)
Щелочной
Трудно отличить щелочную батарею от угольно-цинковой, но щелочные батареи могут накапливать и производить больше энергии и часто могут оставаться заряженными годами. В щелочной батарее вы найдете положительный электрод из оксида марганца, отрицательный электрод из цинка и электролит, состоящий из щелочного раствора гидроксида калия.
Щелочные батарейки выглядят как цинковые, но обладают большей мощностью. (Источник изображения)
Литий
Обычно эти литиевые батарейки размером с пуговицу используются в часах и слуховых аппаратах, но они содержат тот же набор химических веществ, что и щелочные батарейки. Верхняя сторона литиевого элемента, отрицательный электрод, сделана из цинка или лития. Нижняя сторона, или положительный электрод, сделана из оксида марганца, оксида серебра или оксида меди.
Эти литиевые батареи могут питать часы годами. (Источник изображения)
Вторичные батареи
В отличие от первичных батарей, которые могут производить электроэнергию только до тех пор, пока не иссякнет ее химическая энергия, перезаряжаемые вторичные батареи могут обратить вспять процесс их старения. Эти батареи направляют всю реакцию электрохимического процесса в обратном направлении, стреляя электронами от катода к аноду, пока элемент батареи не будет полностью восстановлен. Типы вторичных батарей:
Свинцово-кислотный
Это аккумулятор, который вы найдете в вашем автомобиле, и он состоит из шести отдельных аккумуляторных ячеек, каждая из которых вырабатывает 2 вольта, что дает вам 12-вольтовый аккумулятор, подключенный параллельно.Каждый элемент свинцово-кислотной батареи имеет положительный электрод из диоксида свинца, отрицательный электрод из металлического свинца и электролит из серной кислоты.
Свинцово-кислотные аккумуляторы делают всю тяжелую работу по питанию вашего автомобиля. (Источник изображения)
Никель-кадмиевый
Nicad, или Ni-Cd, был традиционной технологией перезаряжаемых батарей, которая использовалась до 1990-х годов и часто использовалась как альтернатива утилизации 1,5-вольтовых батарей. Хотя эти аккумуляторные батареи дешевы и их можно перезаряжать сотни раз, они также имеют небольшую проблему с памятью.Как так? Если вы не разрядите аккумулятор Nicad полностью перед его повторной зарядкой, то со временем заряд будет уменьшаться.
Аккумуляторы Nicad склонны к потере памяти. (Источник изображения)
Никель-металлогидрид
БатареиNiMH работают так же, как и батареи Nicad, но менее подвержены проблемам с памятью. Эта батарея в значительной степени заняла место Nicad после 1990-х годов, главным образом потому, что она менее токсична, чем батарея Nicad, и не требует полной разрядки перед зарядкой.
Вся мощь аккумулятора Nicad без забот о потере памяти. (Источник изображения)
Литий-ионный
Большинство основных электронных устройств в наши дни используют литий-ионные аккумуляторы, включая ваши смартфоны, ноутбуки, планшеты и т. Д. Литий имеет массу преимуществ по сравнению с аккумуляторами Nicad и NiMH, в том числе более экологичен, работает при более высоких напряжениях и дважды хранится. столько же энергии. Кроме того, вы можете заряжать и разряжать литий-ионный аккумулятор без каких-либо проблем с памятью.
Вы когда-нибудь разбирали свой мобильный телефон? Это литиевая батарея, которую вы найдете внутри. (Источник изображения)
Кто изобрел батарею?
Большинство приписывают изобретение Алессандро Вольта в 1791 году, но слышали ли вы когда-нибудь о Багдадской батарее?
Еще в 1938 году археолог Вильгельм Кениг обнаружил несколько странно выглядящих глиняных горшков во время раскопок в Багдаде, Ирак. Горшки датируются примерно 200 г. до н. Э. и содержал железный стержень, окруженный медью.При тестировании внутри были обнаружены следы кислой жидкости, и, если что-то нужно знать об аккумуляторах, у нас есть два разных металла, смешанных с химическим электролитом. Это первая древняя батарея? Были произведены современные копии, и эти багдадские батареи действительно производят электрический заряд.
Багдадская батарея была первой древней батареей? (Источник изображения)
Но что касается 1792 года, багдадских батарей просто не существовало, и поэтому наша история начинается с итальянского врача Луиджи Гальвани, экспериментирующего с ногой мертвой лягушки.Вставив два разных металла в лапу лягушки, он смог произвести то, что он назвал «животным электричеством», когда лапа лягушки подпрыгнула. Однако в то время Гальвани не знал, что лягушка не испускает какое-то первичное электричество. Скорее, ему нужно было благодарить строительные блоки современной батареи.
Чтобы доказать это, итальянский физик Алессандро Вольта провел эксперимент, в котором он сложил слои цинка и серебра друг на друга, которые были разделены картоном, пропитанным рассолом.Эта гальваническая батарея, которая теперь считается первой современной батареей, могла производить постоянный ток.
Гальваническая батарея по замыслу Алессандро Вольта.
Что здесь общего между экспериментами Гальвани и Вольта? Оба использовали основные принципы батарей, используя два разных металла и электролит. Гальвани использовал два разных металлических скальпеля, а лапа лягушки действовала как своего рода химический электролит. В гальванической батарее Вольта рассол действовал как электролит между двумя разными проводящими металлами, цинком и серебром.
После его новаторского эксперимента Алессандро Вольта приписали изобретение первой батареи, а остальное хорошо… история. Сегодня мы усовершенствовали этот базовый набор принципов для питания всех наших электронных устройств.
Батареи и конструкция печатной платы
Начинающим конструкторам электроники батареи часто кажутся второстепенными. В конце концов, может быть, вам просто нужно 5 В для стабильного питания постоянного тока. Но что произойдет, если вы работаете с источником батареи 9 В, а одна из ваших микросхем может выдержать только 1?8В? Вот тогда соображения относительно батарей и конструкции питания немного усложняют ситуацию.
Хотя мы не будем вдаваться в подробности проектирования источников питания в этом блоге, он поможет понять основы того, на что обращать внимание как в схеме, так и в топологии печатной платы при работе с батареями. На схеме, планируете ли вы использовать стандартные щелочные батареи или литий-ионные, вы увидите следующие символы:
Типичный символ одноклеточной и двухклеточной батареи, который вы найдете на схеме.
В этом условном обозначении более длинная линия представляет положительный вывод, а более короткая линия — отрицательный вывод. Вы также можете увидеть батареи с более чем двумя линиями, что указывает на то, что в батарее более одной ячейки.
Вам также необходимо знать, как физический держатель батареи будет выглядеть на вашей печатной плате. Многие начинающие разработчики электроники совершают ошибку, думая, что они кладут настоящую батарею на свою плату, в то время как вы просто устанавливаете держатель для батареек.Если вы когда-нибудь вскрывали электронное устройство, чтобы проверить его внутреннее устройство, возможно, вы видели одно из них:
Типичные держатели батарей, которые можно найти на печатной плате или корпусе. (Источник изображения)
Существует также держатель литиевой батареи таблеточного типа, как показано на изображении ниже, который имеет уникальный физический размер.
Вот и гораздо меньший по размеру держатель литиевой батареи. (Источник изображения)
Хорошо и легко разместить держатель для одноразовой батареи и забыть о нем, но что произойдет, если вы захотите добавить в свою конструкцию автоматическое зарядное устройство? Здесь все немного сложнее.Взгляните на схему ниже, это принципиальная схема автоматического зарядного устройства, и в ней много чего происходит, в том числе:
Схема автоматизированного зарядного устройства может включать в себя множество соединенных деталей. (Источник изображения)
- У нас есть основное питание переменного тока 230 В, которое попадает в трансформатор, понижающий напряжение до 15 В.
- Далее необходимо использовать два диода, D1 и D2, для преобразования переменного напряжения в постоянное.
- Эта мощность постоянного тока затем проходит через регулятор напряжения LM3177, который обеспечивает стабильное и стабильное выходное напряжение постоянного тока независимо от того, как изменяется входное напряжение переменного тока.
- Когда аккумулятор полностью заряжен, загорится КРАСНЫЙ светодиод, а стабилитрон D6 начнет проводить. Это направит ток через транзистор BD139 на землю, поэтому полностью заряженный аккумулятор не повредится.
Питание в кармане
Кто бы мог подумать, что эти маленькие химические супергерои могут иметь так много применений, разделяя так много принципов! В наши дни действительно невозможно представить мир без батареек.Эти электростанции отвязали нашу жизнь от шнуров, позволяя нам быть мобильными с нашими электронными устройствами, куда бы мы ни пошли. Независимо от того, какую батарею вы используете, основа всегда одна и та же. У вас есть набор электродов в виде анода и катода, а также электролит, обеспечивающий химическую реакцию. Находясь в движении, химическая энергия превращается в электрическую энергию в виде избыточных электронов, которые перемещаются от анода к катоду, питая вашу цепь.Наши батареи могут становиться более совершенными и дольше удерживать заряд, но в конце концов все они работают одинаково. Помни это.
Знаете ли вы, что Autodesk EAGLE поставляется с множеством бесплатных библиотек батарей, поэтому вам не нужно тратить время на их создание с нуля? Попробуйте Autodesk EAGLE бесплатно сегодня, чтобы попробовать их!
.
 Разница заключается в составе материала катода и типе электролита.
Разница заключается в составе материала катода и типе электролита.