Углекислый газ на МКС / Хабр
В октябре на МКС была установлена новая (принципиально) система регенерации воздуха, которая повысит замкнутость воздушного цикла вдвое.Однако если с технологическим прогрессом все будет хорошо, то этот вариант просуществует недолго, — и нас ждет откат к системе предыдущего типа. А вот если прогресс будет буксовать, то новая система станет золотым стандартом на десятилетия.
Краткое содержание: Что такое духота: мало кислорода? — Нормы НАСА и ВМФ США по содержанию CO2 — Сколько CO2 выделяет человек? — I поколение систем регенерации воздуха — II поколение — III поколение — Перспективы систем с полной регенерацией — Сравнительная таблица
Что такое духота?
Все знают, что для дыхания нужен кислород. Многие уверены, что духота в комнате наступает, потому что в комнате выдышали часть кислорода; а проветривание нужно для того, чтобы с улицы поступил новый.
На самом деле, это не так.
Средний человек потребляет кислорода ~1 кг/сутки (или ~1/2 гр/минуту).
Чтобы в средней комнате (3х5х2,6=40) при нормальных услових (содержание O2 0,28 кг/м3) выдышать кислород до уровня низкого, как высоко в горах, один человек должен дышать неделю.
В реальности же, как нетрудно убедиться, замуроваться в комнате на неделю не выйдет. Если человек герметично закроется в спальне, то с трудом проведет так даже одну ночь. Через несколько часов сон станет беспокойным, будет нарастающее ощущение духоты. Сутки в такой комнате станут пыткой — не аллегорически, а в самом буквальном смысле. Человеку физически станет очень плохо.
Дело не в кислороде, а в углекислом газе, который человек выдыхает взамен.
Сколько CO
2 выделяет человек?В свежем воздухе содержание CO2 ~0,04% (0,5 гр/м3).
При возрастании содержания до 0,7% и далее, игнорировать духоту все сложнее. Это уже не просто психологический дискомфорт, но и заметные физиологические изменения (с 1%): рост частоты и глубины дыхания, повышение давления, частоты сердечных сокращений, усиление потоотделения; возрастает число ошибок в сложной работе, начинается головная боль, предельная концентрация становится недостижима (с 2%).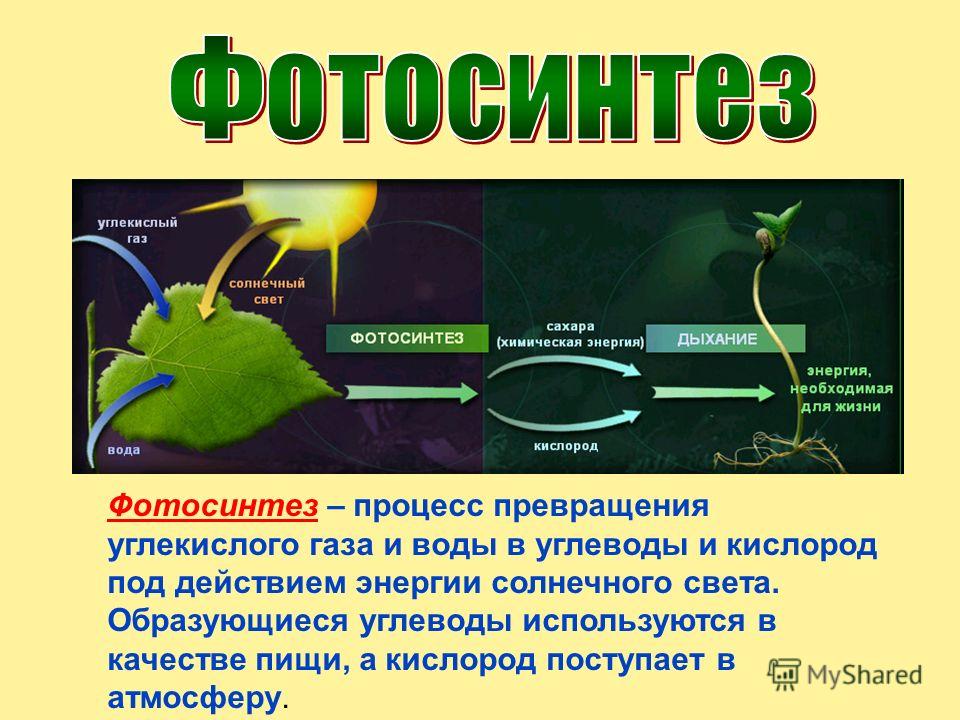 В гражданских исследованиях не экспериментируют с содержанием выше 2,5%.
В гражданских исследованиях не экспериментируют с содержанием выше 2,5%.
Понятно, что потребив 1 кг O2, человык выдыхнет порядка 1,4 кг CO2.
Почему не точно? Разве легкие — это не вроде катализатора?При поглощении из воздуха 1 молекулы O2, разве не выделяется ровно 1 молекула CO2?С точки зрения биологичеких механизмов, это не обязательно так. В эритроцитах эти процессы разделены. Одна система захватывает кислород, другая выбрасывает углекислоту.
И в реальности молекул кислорода захватывается больше, чем выделяется углекислоты.
Проще всего это понять, если обратить внимание на жиры (в еде нашего модельного человека). По составу их можно огрубленно считать как CH
Кроме 1 молекулы кислорода, чтобы окислить атом углерода, нам понадобится еще один дополнительный атом кислорода, чтобы окислить водород. В целом кислорода будет потреблено в полтора раза больше, чем выдохнуто углекислого газа.
Однако для углеводов и белков это соотношение близко к 1:1, поэтому далее, для простоты, рассматривается «катализаторное» приближение дыхания.
В нашей замурованной комнате, объемом в 40м3, с изначально идеально свежим воздухом, человек уже за 20 минут увеличит «природное» содержание CO
Нормы НАСА и ВМФ США по содержанию CO
2В земной жизни такие замурованные места, где форточку не открыть, а работать надо много дней подряд, — это подводные лодки.
Подводников гораздо больше, чем космонавтов. И работа у них не менее сложная и ответственная. Так что есть большая и качественная статистика.
При разработке космических систем регенерации, ориентируются на этот опыт, но нормы для космонавтов ставят более гуманные, НАСА решило брать для долгих сроков множитель 1/3:
То есть 0,8%.
Однако в реальности НАСА старается держать на МКС уровень не выше 0,5%. Дело в том, что уже при таком уровне отдельные астронавты начинают испытывать дискомфорт, — психологи в ЦУПе замечают, что поведение людей ощутимо меняется, даже если сами они не жалуются.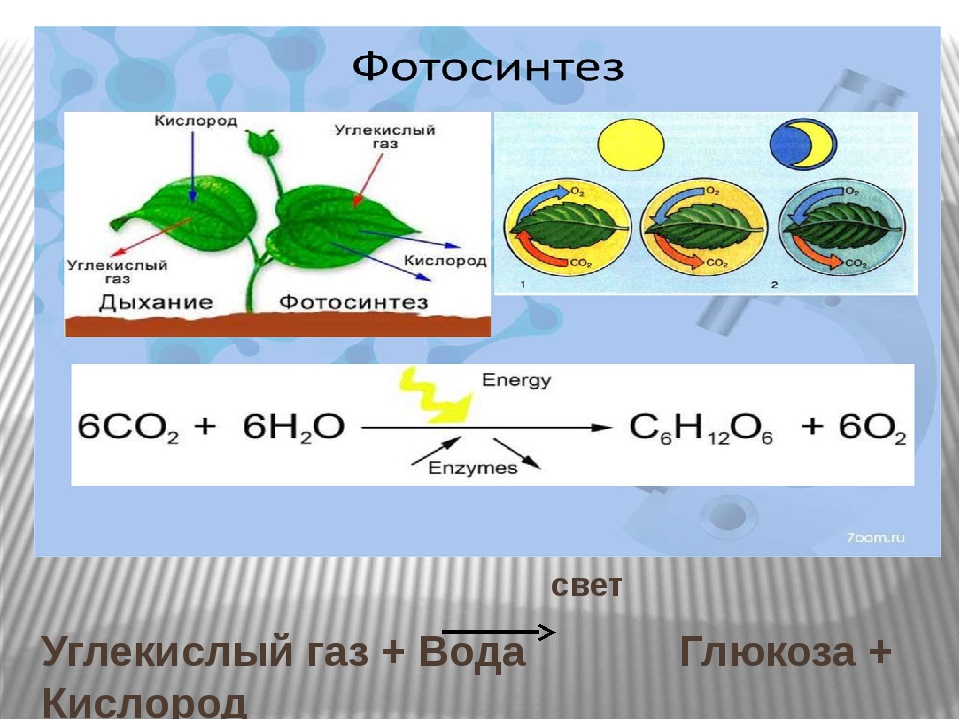
И возникает необходимость: как поддерживать в воздухе низкое содержание CO2?
0-е поколение — продув
Исторически это самое первое решение, потому что самое простое.
Идет просто постепенный продув кислородом атмосферы скафандра. Выделяемый при дыхании углекислый газ выбрасывается в вакуум — вместе со всей остальной смесью. Где остается еще очень много кислорода, которым можно было бы дышать.
Понятно, что как штатная система такое существовало лишь в самом начале космонавтики.
Сейчас эта система используется только как дублирующая система в скафандрах. То есть на случай неисправности основной системы (см. ниже, следующее поколение), или же как экстренное расширение по времени, — когда основная система уже исчерпана, а космонавт не успел вернуться. Расчетное время работы такой запасной системы в современном скафандре — полчаса.
Чтобы было понятно, насколько такая система неэффективна: за эти полчаса будет израсходовано на продув 1,2 кг кислорода, из которых человек усвоит 15-20 граммов. Эффективность менее 2%.
Эффективность менее 2%.
I поколение — знаменитые «шашки» для воздуха
Эта система регенерации стала основной почти сразу — и оставалась такой десятилетия.
Воздух гоняется по замкнутому циклу, без сброса наружу. Убыток кислорода компенсируется тем, что подмешивается кислород из баллонов (или, позже, от электролиза воды), а для удаления CO2 используются емкости с гидроксидом лития:
2LiOH + CO2 → Li2CO3 + H2O
Углекислый газ связывается в карбонат лития. Формально в этой реакции выделяется вода, которую можно было бы (теоретически) попытаться извлечь, и разложить на водород и кислород, который снова использовать.
В реальности — после использования шашка, со всем содержимым, идет в мусор. Из-за своей компактности, такая система используется как штатная система во всех современных скафандрах и кораблях-доставщиках («Союз», будущие американские). Из-за своей простоты и надежности, такая система считается запасной/добавочной на МКС, — если штатная система вышла из строя; если на станции слишком много людей, и основная система не справляется.
Из-за своей компактности, такая система используется как штатная система во всех современных скафандрах и кораблях-доставщиках («Союз», будущие американские). Из-за своей простоты и надежности, такая система считается запасной/добавочной на МКС, — если штатная система вышла из строя; если на станции слишком много людей, и основная система не справляется.
Когда к МКС еще летали шатлы, на каждом из которых была целая орава, и все они проводили на станции больше времени, чем расчетный полет шаттла — двух штатных систем МКС (русская и американская) не хватало, на шаттле постоянно «жгли» свои шашки, а затем еще значительную часть запаса шашек на МКС. Затем на грузовых кораблях добрасывали новых.
Современная американская шашка содержит 3 кг LiOH,
русская 5 кг.
С шашками, в идеале, невосполнимо теряется куда меньше: углекислый газ, забранный шашками; сами шашки. (И, если вы производите кислород из воды, то выделившийся из воды водород, он тоже отправляется за борт. )
)
При этом самая большая трата по массе — это сами шашки. А можно как-то не тратя шашек?
II поколение — штатный режим МКС
Если очень грубо, то это усовершенствованный кошачий лоток с наполнителем.
У нас есть вещество, хорошо пропитывающееся газом, — но не любым, а в зависимости от диаметра молекулы. Углекислота захватывается, азот и кислород почти нет. То есть перед нами так называемое «молекулярное сито». Со времен Skylab, это цеолит.
Чтобы цеолит не вымокал (на станции нормальная влажность, каждый человек выдыхает за сутки литр воды), сначала воздух сушится. Охлаждается. И подается в камеру с цеолитом.
Таких камер две (в американской системе), или три (в русской). Какое-то время одна из камер впитывает углекислый газ, затем поток воздуха переключается на вторую. В это время внутрь первой подается вакуум, а цеолит подогревается. Углекислота выходит из него. Это один цикл. Теперь мы можем снова использовать первую камеру для очистки воздуха, а вторую поставить на выветривание в вакуум.
В идеале, вы забираете из атмосферы МКС только углекислый газ. Это ваша невосполнимая потеря (этот газ вы отправляете за борт), — но сами адсорбенты используются многократно, в отличие от кошачих лотков или систем на шашках. (Ну и разумеется, продолжаете выбрасывать за борт водород, как побочный продукт электролиза при получении кислорода.)
Вопрос: а если выбрасывать углекислый газ за борт стало жалко? Он же на две трети с лишним из кислорода!
Поколение 2.5 — экспериментальное, неудачное
Систему пытались разработать для «Мира», но ничего путного не вышло.
С одной стороны, нужно отдать должное смелости советских инженеров. Если бы система заработала, то это было бы полное замыкание цикла по кислороду.
С другой стороны, нельзя не вспомнить и классическое — «Деточка, ты же лопнешь?» Возможно, если бы усилия были направлены на менее амбициозную задачу (американцы с самого начала все работы вели именно по такой менее амбициозной задаче, хотя и обладали куда большими ресурсами), то советские инженеры прекрасно решили бы ее, и системы III поколения успешно использовались бы уже тридцать лет.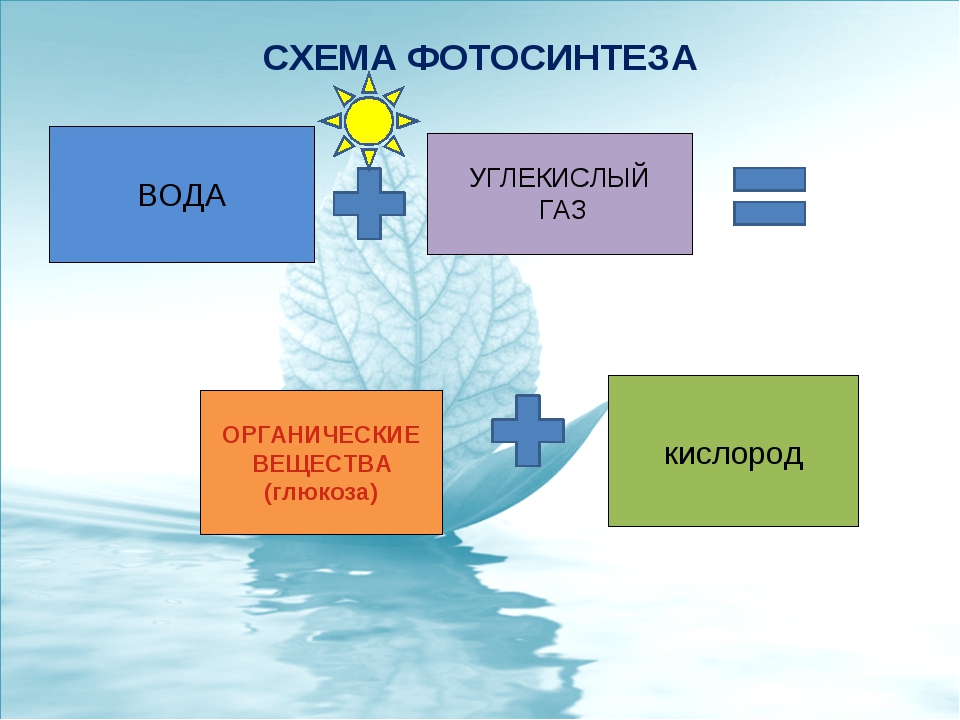
В чем же идея. Чтобы превратить углекислый газ в кислород, можно использовать так называемую реакцию Боша: углекислый газ смешивается с водородом, и при высокой температуре углекислый газ сначала восстанавливается до угарного газа, а затем на катализаторе идет распад угарного газа до атомарного углерода. Получается вода (пар), и углерод в виде отложений:
CO2 + 2H2 → C + 2H2O
Уже из описания реакция видна и основная трудность: реакция идет на катализаторе, который покрывается налетом графита. И что делать?
Чистить, во-первых, сложно и затратно (затратно в космическом смысле: требуется дополнительная аппаратура, и расходники, — и затраты полезной массы на это оказываются больше, чем выигрыш в сохраненном кислороде).
Во-вторых, эти чистки должны быть очень частыми — если в экипаже трое, то в день на катализатор должно осесть 1 кг графита.
III поколение — свежее
Американцы же с самого начала решили делать не реакцию Боша, а реакцию Сабатье.
 Часто ее называют реактором Сабатье, поскольку для реакции требуется не только высокая температура, но и повышенное давление.
Часто ее называют реактором Сабатье, поскольку для реакции требуется не только высокая температура, но и повышенное давление.Реакция идет на катализаторе, в углекислый газ добавляется водород, то есть реагенты аналогичны реакции Боша, — а вот выход у реакции другой:
CO2 + 4H2 → CH4 + 2H2O
вода и метан.
Технологическое преимущество Сабатье перед Боша в том, что все продукты газообразные, и с ними легко работать дальше. В том варианте, который сейчас доставили на МКС, метан просто выбрасывается наружу (как в системах 2-го поколения наружу выбрасывается углекислый газ).
Но есть и минус. Вспомним, откуда на станции берется новый кислород. Разложением воды.
Кислород идет в дело, а водород (в системах 2-го поколения) просто выбрасывается за борт. Теперь же мы можем (и должны! откуда-то же надо брать водород для реакции) использовать этот водород, направив в реактор Сабатье.
И тут нюанс. В воде на 1 атом кислорода приходится 2 атома водорода. А в реакции Сабатье на 1 атом кислорода должно приходиться 4 атома водорода (2 идет на то, чтобы заместить связь кислорода с углеродом, а к этому оторванному кислороду лепятся еще 2 водорода, образуя воду).
А в реакции Сабатье на 1 атом кислорода должно приходиться 4 атома водорода (2 идет на то, чтобы заместить связь кислорода с углеродом, а к этому оторванному кислороду лепятся еще 2 водорода, образуя воду).
Таким образом, если опираться только на электролиз воды и реактор Сабатье, цикл по кислороду можно закрыть лишь на 50%. Половину CO2 можно переработать, а для оставшейся части — водорода уже нет.
(Если вы чуть сбиты на этом моменте, не расстраивайтесь. Даже составители первых пресс-релизов на сайте ESA не сразу сообразили, что к чему, и сначала рисовали неправильные блок-схемы и валили все на недоэффективность катализатора.)
В реальности, конечно, пока получается не теоретические 50%, а поменьше, около 40%. В начале статьи показан только сам реактор Сабатье, элемент нововведения — на блок-смехе это вокруг зеленой стрелки.
Вся же система целиком гораздо крупнее, — как и та, что была у американцев штатной до этого. На полный объем научной стойки, в полтонны.
Перспективы IV поколения — развитие III поколения?
Сразу напрашивается вопрос: а почему бы не использовать дополнительный водород? Доставленный на МКС помимо воды, которую мы пустим на электролиз?
В самом деле. Рассмотрим ту часть CO2, которую приходится выбрасывать в вакуум. На каждые 12 масс углерода мы теряем 32 массы кислорода. А если мы добавим в реактор недостающего водорода, и свяжем углерод в CH4, то кислород сохранится на станции, а в выхлопе мы потеряем только 4 массы водорода. Выигрыш по массе в 32:4=8 раз. 1 кг водорода спас бы целых 8 кг кислорода!
Проблема в том, что водород — не вода. Это для транспортировки воды можно использовать обычные контейнеры. Для простоты, положим на тару 1/10 веса доставленной воды.
В случае же с водородом, хоть сжатым, хоть сжиженным, все прямо наоборот: соотношение массы тары, к массе заключенного в ней водорода, будет ~10/1.
Мы не можем доставить на МКС просто килограмм водорода. Мы еще должны поднять 10 килограммов его тары.
Мы еще должны поднять 10 килограммов его тары.
Не говоря уже о том, что потребуется попутно решать проблемы безопасности: при хранении водорода есть штатная утечка у вентилей (если доставлять как газ), и аналогичный сброс у контейнеров (если сжиженный), из-за необходимости поддерживать низкую температуру внутри. Помимо опасности, эти утечки еще делают невозможным длительное хранение про запас. Стравливаемый водород надо либо сразу использовать, либо безвозвратно терять.
В итоге получается, что проще (и экономичнее) будет доставить на МКС не дополнительный водород для реактора Сабатье, — а дополнительную воду для электролиза. И работать в наполовину замкнутом цикле, сбрасывая лишний углекислый газ в вакуум.
Перспективы IV поколения — иное развитие от II поколения
Пока речь шла о замыкании системы только по кислороду. Углерод рассматривался как бесполезный элемент, неизбежно поступающий в систему (через дыхание людей) из еды. Массозатраты на еду, постоянно вводимую в цикл регенерации воздуха, мы не учитывали.
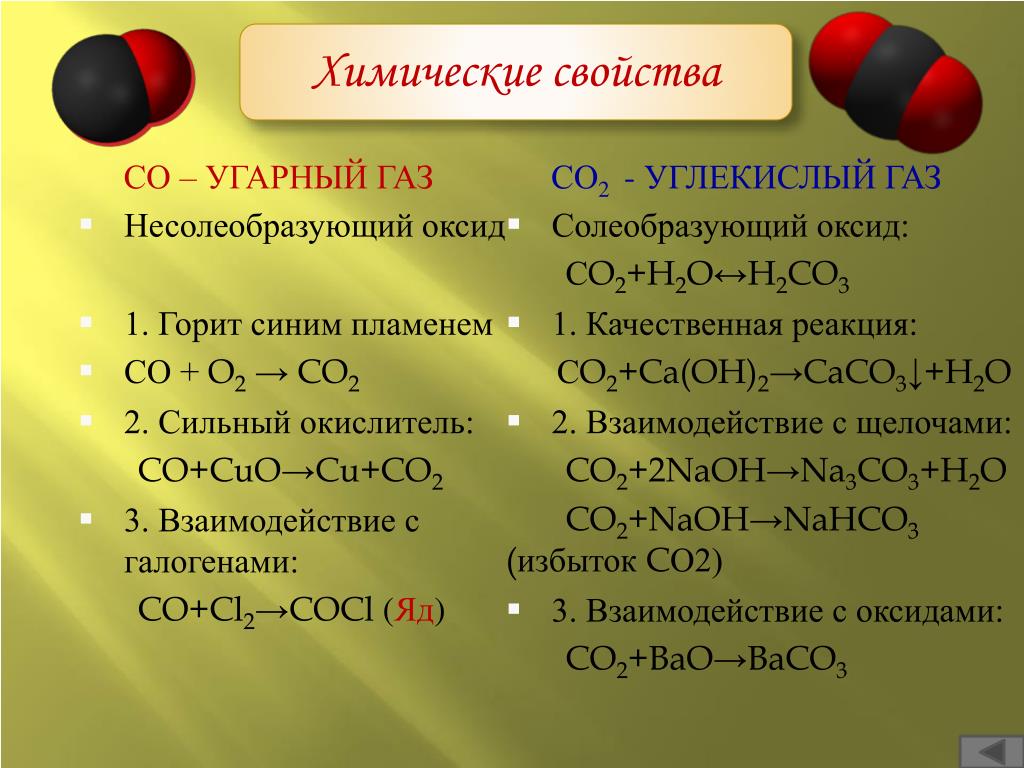
А что, если все-таки попробовать сохранять и углерод? Что, если выделять из углекислого газа кислород, связывая углерод не в метан, а в углеводы?
Углеводы, если смотреть только на количество составляющих химических элементов, это приблизительно равная смесь углерода и воды.
Вспомним атомные массы участников: водород — 1, углерод — 12, кислород — 16.
Давайте сравним эффективность рассмотренных способов связывания углерода, с точки зрения сбрасываемой в вакуум массы вещества (которое до этого надо поднять на станцию с земли!):
- При сбросе всего CH4 за борт (и туда же отправляется водород от электролиза), мы теряем две молекулы воды на каждый атом углерода, то есть на 1 массу углерода 3 массы воды.
- При реакции Сабатье (из-за нехватки водорода) мы теряем по молекуле воды на каждый атом углерода, то есть на 1 массу углерода 1,5 массы воды
- При переводе в углеводы, мы расходуем по молекуле воды на каждый атом углерода, то есть на 1 массу углерода 1,5 массы воды.

Как видим, у цикла электролиз+Сабатье эффективность такая же, как у цикла электролиз+углеводы.
Но! При реакции Сабатье мы сбрасываем это вещество со станции, теряем его безвозвратно. А углеводы — их же можно попробовать сделать пригодными в еду?
В пище астронавтов должны присутствовать не только углеводы (для простоты, 400 гр), но и жиры (100 гр) и белки (100 гр). Из-за этого замкнуть цикл по кислороду и питанию, делая из углекислого газа только углеводы, не выйдет. Но заменить хотя бы углеводную часть продуктов? Это 2/3, если по сухому составу!
Тогда итоговый баланс поменяется:
— с одной стороны, мы уменьшаем трату воды в 3 раза по сравнению с циклом через Сабатье (с 560 гр до 165, это на связывание в углеводах того углерода, который пришел из съеденных белков и жиров, его 110 гр; теоретически даже эти 165 граммов воды можно не списывать, а сохранять сахар на борту, но просто он будет не востребованным для цикла, будет копиться запас чистых углеводов),
— плюс к этому, расход еды (по сухому составу) становится меньше на 400 гр на чел/сут (мы замкнули цикл еды по углеводам).
В сумме выигрыш ~700 гр на чел/сут.
Чего ждать
Подводя итог: NASA, ESA видят перспективу в том, чтобы вернуться к предыдущей системе регенерации (через адсорберы без реактора Сабатье) — только теперь при разгрузке адсорбента использовать не открытый вакуум, а лабораторный. Закрытые вакуумные камеры, из которых углекислый газ откачивается и сохраняется, чтобы направить его на проивзодство углеводов.
И остается сущий пустячок: как перевести углекислый газ в углеводы?
- Можно попробовать делать это чисто химически. Но это сложно. Если бы это было просто, мы бы уже давно возили сахар и биокорма не с плантаций, а из пристроек к электростанциям.
- Можно попробовать делать это биологически, через фотосинтез, — но и тут не все гладко.
Хозяйке на заметку: сколько надо комнатных растений, чтобы можно было никогда не проветривать?
Иногда простые люди, любители домашних растений, вдруг задаются таким вопросом. А доброжелатели предлагают им простыни сбивчивых расчетов — которые начинаются с перемножения справочных данных: средний объем вдоха, среднее число вдохов в минуту, доля углекислого газа в выдыхаемом воздухе… На самом деле, пригодный для практического ума ответ очень прост. И напрочь лишает энтузиазма. Это должна быть плантация такого размера, чтобы вы ежедневно собирали с нее ~800 граммов сухих листьев (на одного человека, в зависимости от того, сколько он ест). А если этих человек шесть или десять? И плантацию надо соорудить не на заднем дворе, а на орбите? А потом разогнать ее к Марсу, а у Марса затормозить, и как-то спустить вниз; и снова поднять, чтобы лететь обратно к Земле?
И напрочь лишает энтузиазма. Это должна быть плантация такого размера, чтобы вы ежедневно собирали с нее ~800 граммов сухих листьев (на одного человека, в зависимости от того, сколько он ест). А если этих человек шесть или десять? И плантацию надо соорудить не на заднем дворе, а на орбите? А потом разогнать ее к Марсу, а у Марса затормозить, и как-то спустить вниз; и снова поднять, чтобы лететь обратно к Земле?
Здесь планы агенств то ли действительно разошлись, то ли руководства решили поиграть в здоровую конкуренцию, и не складывать все яйца в одну корзину. (Это всегда неплохой вариант, и особенно — когда перед глазами опыт с конкуренцией реакций Сабатье и Боша. Одно взлетело, другое нет.)
NASA объявляет конкурсы с миллионными призами, в которых предлагает произвести сахар чисто химическими путями.
ESA обещает уже в следующем году поднять на МКС бак с водорослями, и скармливать им тот углекислый газ, который сейчас избыточен для реактора Сабатье.
А если с углеводами из углекислоты ничего так и не выйдет?
Еще можно попробовать делать углеводы и водород из метана и воды.
 NASA выбрало отправной точкой углекислый газ, чтобы поймать двух зайцев: такое решение может пригодиться не только для замыкания цикла регенерации в полете, но и для активного прироста вещества на планете — в атмосфере Марса, где есть CO2. Да и здесь, на Земле, пригодилось бы.
NASA выбрало отправной точкой углекислый газ, чтобы поймать двух зайцев: такое решение может пригодиться не только для замыкания цикла регенерации в полете, но и для активного прироста вещества на планете — в атмосфере Марса, где есть CO2. Да и здесь, на Земле, пригодилось бы.Но скорее всего, схема с реактором Сабатье останется самой эффективной, — и, учитывая реальную скорость прогресса в технологиях пилотируемой космонавтики, на десятилетия.
Сравнительная таблица
| поколение | метод удаления CO2 | потери1 (/чел /сут) |
как штатная система | как запасная /дополн. |
|---|---|---|---|---|
| продув | 50 кг O2-сжатого2 | скафандры | ||
| I | шашки с LiOH | 1,1 кг воды 1,5 кг шашек |
скафандры, корабли доставки («Союз», будущие американские, в прошлом шаттлы) |
МКС |
| II | молекулярное сито, выпаривание в вакуум |
1,1 кг воды | МКС (в прошлом «Мир», Skylab — впервые) |
|
| III | молекулярное сито, разложение до графита |
03 | (экспериментальная, неудачно) для «Мира» |
|
| III | молекулярное сито, 50% в CH4 |
0,6 кг воды | МКС (амер. сегмент) сегмент) |
|
| ? | молекулярное сито, в сахара |
0,2 кг воды4 /прирост 0,2 кг воды5 | ||
1В идеале.
2Без учета тары.
3Без учета расходников на чистку/замену катализатора.
4При объединении с пищевым циклом по углеводам; 5при этом пищевой цикл становится замкнут по углеводам, то есть там массозатрат меньше на 0,4 кг (сухая масса углеводов в еде), что больше потерь воды в воздушном цикле (если рассматривать его потери отдельно от общего балланса), — и формально это можно трактовать как прирост полезной массы (если сравнивать с ситуацией, когда углеводы в пищевой цикл поступают с земли).
Что не было оговорено выше, но полезно понимать для полноты картины
Помимо потерь при регенерации цикла по дыханию (в современных системах это сводится, как видно, к некоторым потерям воды), потеря массы есть и в других циклах, связанных с людьми.

Прежде всего, это туалетный цикл. Даже когда на МКС по максимуму используются системы, пытающиеся замкнуть этот цикл, эффективность этих систем ограничена: из нескольких килограммов воды и еды, вернуть в цикл удается ~80% воды. То есть потери ~1 кг на человека в сутки. (Это не считая тары, в которой идет еда. Не вся она сублимированная в пакетиках. Есть и обычные консервные банки.)
Таким образом, бессмысленно прилагать совсем уж фантастические усилия, пытаясь далее совершенствовать систему регенерации по CO2, — пока не уменьшены потери в туалетном цикле.
Поэтому реальная цель, которую ставят перед собой NASA, это довести замкнутость системы с нынешних 40% до 75%.
Но даже если получится оба этих цикла замкнуть в ноль, или почти в ноль, и это еще не все. Это совсем не будет значить, что человек может полноценно работать в замкнутом цикле по кислороду и воде.
Каждый выход в открытый в космос — неизбежная потеря воды. Она используется для охлаждения скафандра.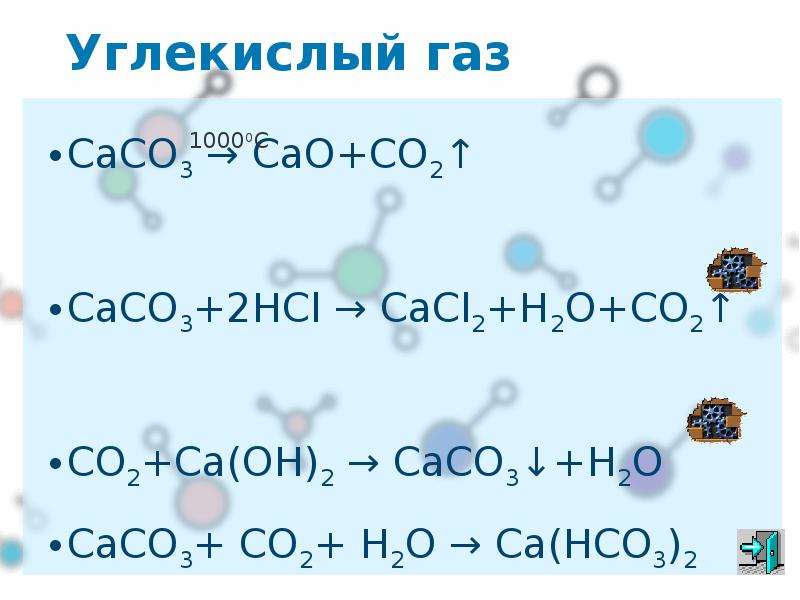 Хотя на первый взгляд может показаться, что и собственно скафандр, и «рюкзак» системы жизнеобеспечения полностью закрыты термоизоляцией, — нет. Нижний торец «рюкзака», который заканчивается под задницей космонавта, не прикрыт. Это радиатор охладителя, и в радиаторе поры, куда подводится вода внешнего контура — для испарения. За один выход, в зависимости от длительности, теряется ~1-2 кг на участника выхода.
Хотя на первый взгляд может показаться, что и собственно скафандр, и «рюкзак» системы жизнеобеспечения полностью закрыты термоизоляцией, — нет. Нижний торец «рюкзака», который заканчивается под задницей космонавта, не прикрыт. Это радиатор охладителя, и в радиаторе поры, куда подводится вода внешнего контура — для испарения. За один выход, в зависимости от длительности, теряется ~1-2 кг на участника выхода.
Как сжечь углекислый газ? | Наука и жизнь
Новые катализаторы помогут превратить диоксид углерода в топливо.
Чтобы получить энергию, как правило, необходимо что-нибудь сжечь: обычные автомобили сжигают топливо в двигателях внутреннего сгорания, электромобили заряжают свои батареи от электричества, поступающего, например, на ТЭЦ, где сжигают природный газ, и даже нам для мышечной или умственной работы надо «сжечь» внутри себя съеденный завтрак.
Пористая структура поверхности серебряного катализатора после удаления полистирольной матрицы. (Фото: MIT)
(Фото: MIT)‹
›
В любом органическом топливе, будь то бензиновые углеводороды или углеводы из шоколадки, содержатся атомы углерода, которые в конце своего энергетического пути превращаются в углекислый газ. Ну а газ, в свою очередь, отправляется в атмосферу, где он может накапливаться и вызывать всякие нехорошие эффекты вроде глобального потепления.
С энергетической точки зрения углекислый газ абсолютно бесполезен, поскольку углерод в нём полностью «сгорел», прочно и неразрывно связав себя с двумя атомами кислорода. Гореть он уже не горит, и единственное что с ним можно сделать – утопить или закопать. Утопить его можно, растворив в океане – и это действительно один из способов утилизации СО2. Другой способ – закачать его под высоким давлением под землю, желательно там, где есть нефтяные месторождения; это позволит повысить отдачу нефтяных пластов и поможет добыть больше нефти. Однако химики всё же нашли способ «сварить кашу из топора» – существует третий путь утилизации СО2, когда его превращают в топливо.
Чтобы превратить СО2 в топливо, нужно «похимичить» с молекулой углекислого газа, например, отобрать у неё один атом кислорода. Тогда углекислый газ превратится в угарный газ СО. Несмотря на то, что для большинства угарный газ – это «тот газ, от которого периодически погибают неаккуратные пользователи дровяных печей», в промышленности его используют в самых разных процессах: во-первых, его можно сжечь и получить энергию, во-вторых, его можно использовать в металлургических процессах, а в-третьих, из него можно синтезировать различные органические молекулы, в том числе и жидкое топливо. Как раз последний пункт и открывает перед углекислым газом нефтехимические перспективы.
Однако стоит заметить, что использование угарного газа в химических целях не есть что-то совсем новое. Ещё на заре ХХ века германские химики Франц Фишер и Ганс Тропш разработали способ, как из обычного угля получить жидкое топливо: сначала из каменного угля и воды получают синтез-газ – так называется смесь угарного газа и водорода, а затем с помощью катализатора из синтез-газа получают различные углеводороды. Этот способ был востребован, когда обычной нефти не хватало, однако со временем, во второй половине двадцатого века метод получения топлива из угля стала просто дорогой альтернативой «классическим» нефтеперерабатывающим технологиям. Но если в процессе Фишера-Тропша в качестве сырья используют каменный уголь, который сам по себе есть полезное ископаемое, то химики из Массачусетского технологического института для той же цели – получения синтез-газа – разработали способ, позволяющий делать его из «ненужного» углекислого газа.
Этот способ был востребован, когда обычной нефти не хватало, однако со временем, во второй половине двадцатого века метод получения топлива из угля стала просто дорогой альтернативой «классическим» нефтеперерабатывающим технологиям. Но если в процессе Фишера-Тропша в качестве сырья используют каменный уголь, который сам по себе есть полезное ископаемое, то химики из Массачусетского технологического института для той же цели – получения синтез-газа – разработали способ, позволяющий делать его из «ненужного» углекислого газа.
Такие вещи невозможны без использования катализаторов, и, чтобы получить работающий катализатор, химикам порой приходится идти на самые разные хитрости. Дело в том, что, кроме определённого химического состава, для катализатора очень важна его внутренняя структура. Если говорить упрощённо, катализатор, нанесённый на ровную поверхность, может оказаться нерабочим, а вот если его нанести на пористую поверхность, и если у пор при этом будет определённый размер, то тогда он сможет заработать в полную силу.
Для того чтобы создать такой катализатор, химики взяли электропроводящий материал в качестве подложки и нанесли на него слой из полистирольных шариков диаметром около 200 нанометров. После чего пустоты, оставшиеся в пространстве между шариками, заполнили атомами серебра. (В качестве аналогии можно представить, что мы насыпали на пол слой из бильярдных шаров, а потом всё сверху залили ровным слоем расплавленного парафина.) Теперь, чтобы получить пористый субстрат, нужно каким-то образом убрать из материала все шарики, оставив в целости оставшуюся структуру. В случае с бильярдными шарами это было бы весьма проблематично, а вот в случае с полистирольными шариками все оказалось намного проще – и в итоге после удаления полистирола на поверхности электрода получилась ячеистая структура из серебра с «сотами» определённого размера.
Подобный материал, как оказалось, хорошо превращает углекислый газ в синтез-газ, причём эффективность и селективность катализатора управляется за счёт размера сот: если на этапе синтеза катализатора взять полистирольные шарики покрупнее, то после реакции получится один состав продуктов, а если помельче – то другой.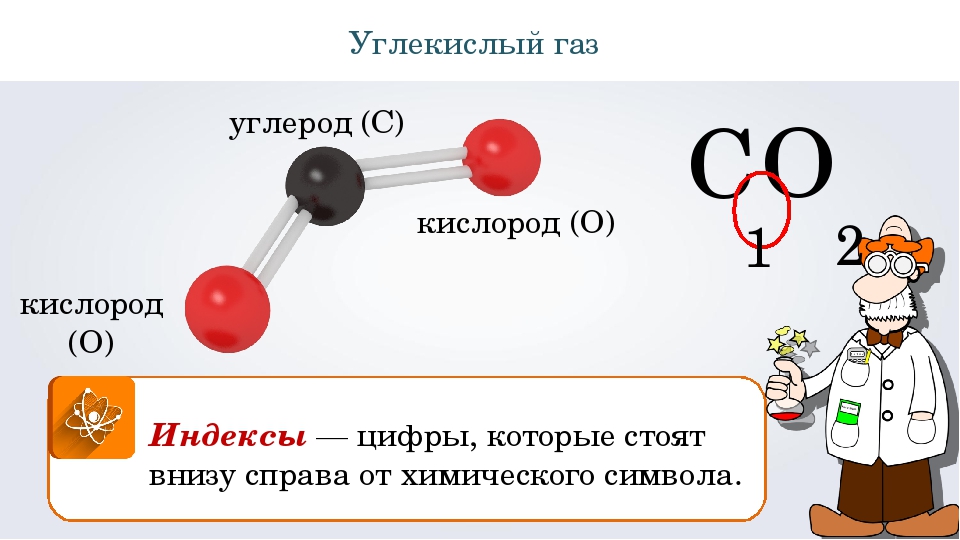 Подробно результаты исследований опубликованы в журнале Angewandte Chemie.
Подробно результаты исследований опубликованы в журнале Angewandte Chemie.
И вроде бы всё хорошо, и человечество должно бы праздновать победу над выбросами парниковых газов, а каждую трубу, чадящую в атмосферу продуктами сгорания, нужно оборудовать подобным серебряным катализатором, но всё-таки стоит сделать одно замечание. Один из важных законов, по которому живёт окружающий нас мир – закон сохранения: масса и энергия не возникают ниоткуда и не пропадают в никуда. Это справедливо и для атомов химических элементов, и для тепла, вырабатываемого при сжигании топлива, и для электрической энергии. Поэтому сколько энергии получается при сжигании угарного газа до углекислого, как минимум, столько же энергии нужно затратить (упрощённо), чтобы превратить молекулу углекислого газа обратно в молекулу угарного. И очевидно, что для такой, в общем-то, «зелёной» технологии по утилизации парникового газа нужен свой источник энергии, который как минимум не «начадил» бы в атмосферу столько СО2, сколько можно было бы превратить в полезный продукт.
Откуда взять энергию для превращения одного газа в другой? Например, от ветряных или солнечных энергоустановок, которые производят энергию, но не выбрасывают в атмосферу продукты сгорания топлива – в результате это позволило бы уменьшить общее количество углекислого газа.
Забавно, что похожей деятельностью занимались древние растения и бактерии, поглощавшие находившийся тогда в избытке в атмосфере углекислый газ, и преобразовывшие его в органические вещества, ставшие потом ископаемым топливом. Возможно, что человечеству в будущем придётся заниматься чем-то похожим, но только уже с использованием химических технологий.
учёные изобрели генератор кислорода и органических соединений для будущих покорителей Марса — РТ на русском
Американские учёные создали биогибридное устройство на основе наноматериалов и бактерий, которое, подобно растениям, преобразует солнечный свет, углекислый газ и воду в органические соединения и кислород. Предполагается, что такая технология может использоваться на других планетах будущими колонистами с Земли: с её помощью они смогут на месте производить множество необходимых органических материалов, в том числе топливо и медикаменты.
Предполагается, что такая технология может использоваться на других планетах будущими колонистами с Земли: с её помощью они смогут на месте производить множество необходимых органических материалов, в том числе топливо и медикаменты.
Группа исследователей из США представила устройство на основе наноматериалов и бактерий, которое, подобно растениям, преобразует солнечный свет, углекислый газ и воду в органические соединения и кислород. Учёные уверены, что эта технология пригодится для колонизации других планет, в первую очередь Марса. Новые данные опубликованы в журнале Joule.
Когда человечество дойдёт до создания колоний за пределами Земли, поселенцам потребуется огромное количество материалов на основе органических соединений — от топлива до медикаментов. Доставлять всё необходимое с нашей планеты будет слишком дорого, поэтому актуальным станет налаживание производства на месте, уверены исследователи.
- Бактерии Sporomusa ovata живут в «лесу» из нанопроволоки
- © UC Berkeley photo by Peidong Yang
Для решения этой проблемы в течение последних восьми лет коллектив учёных из Калифорнийского университета в Беркли и Национальной лаборатории имени Лоуренса в Беркли работал над созданием гибридной системы из бактерий Sporomusa ovata и наноматериала — проволоки из кремния, которая в сто раз тоньше человеческого волоса.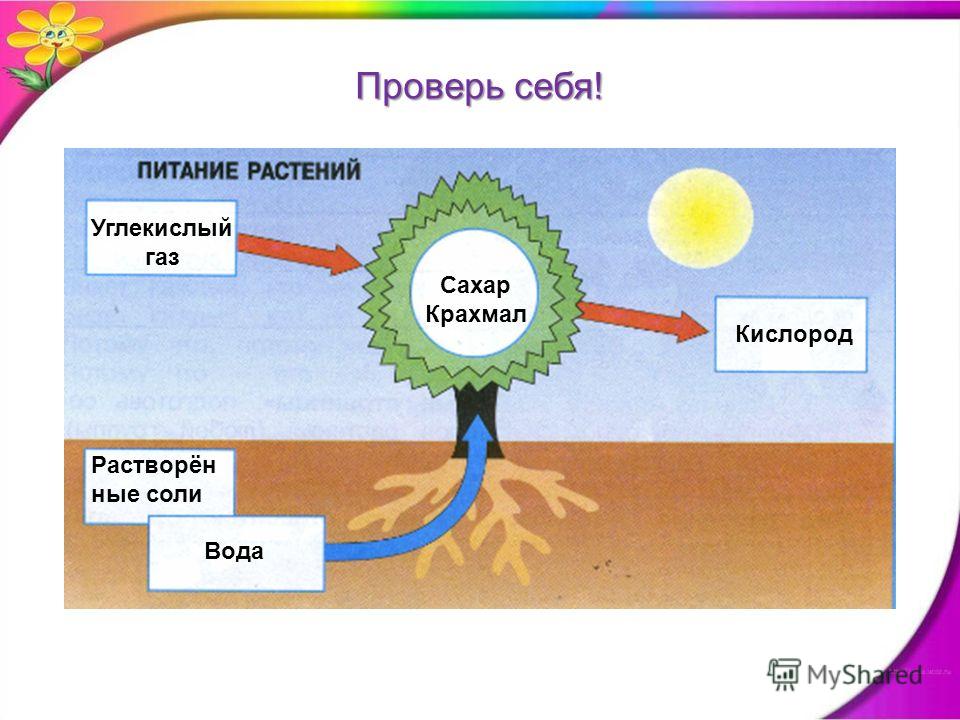 Такое устройство поглощает энергию солнечного света и превращает атмосферный CO2 и воду в органические молекулы и кислород, отмечают специалисты.
Такое устройство поглощает энергию солнечного света и превращает атмосферный CO2 и воду в органические молекулы и кислород, отмечают специалисты.
«Атмосфера Марса примерно на 96% состоит из углекислого газа. По сути, требуются только кремниевые полупроводниковые нанопровода для приёма солнечной энергии и передачи её этим бактериям, чтобы они провели всю химическую работу за вас», — заявил руководитель проекта, профессор химфака Калифорнийского университета Ян Пэйдун.
«При подготовке космических полётов особое внимание уделяется весу полезной нагрузки, а плюс биологических систем в том, что они самовоспроизводятся, то есть их не требуется высылать в больших количествах. Именно поэтому наш биогибридный проект очень интересен», — добавил специалист.
Также учёные выразили уверенность, что разработанное устройство найдёт применение и на Земле. Его способность поглощать углекислый газ и производить кислород может оказаться полезной для решения проблемы повышенной концентрации углекислого газа в атмосфере.
Изобретение представляет собой густой «лес» из нанопроволоки, в котором живут полезные микроорганизмы. Причём группе исследователей удалось добиться высокой эффективности: 3,6% поступающей на устройство солнечной энергии преобразуется и связывается в углеродные соединения в виде ацетата — уксусной кислоты.
- Устройство для улавливания углекислого газа из воздуха и превращения его в полезные органические продукты. Слева находится камера, содержащая гибрид нанопроволок и бактерий. Справа — камера, где производится кислород
- © UC Berkeley photo by Peidong Yang
Полученное вещество может служить строительным материалом для целого ряда органических соединений: от топлива и пластмасс до лекарств. В основе химического превращения веществ в устройстве лежит процесс фотосинтеза.
В проведённом учёными эксперименте наноматериалы использовались только в качестве проводов, а не солнечных батарей. Энергия подавалась на устройство извне. В реальной системе, по задумке учёных, проволока сама будет поглощать свет и передавать электроны бактериям.
Энергия подавалась на устройство извне. В реальной системе, по задумке учёных, проволока сама будет поглощать свет и передавать электроны бактериям.
«Эти кремниевые провода по своей сути похожи на антенну: они улавливают солнечные фотоны так же, как и солнечная панель», — отметил профессор Ян Пэйдун.
Учёные отмечают, что другие генетически модифицированные бактерии или дрожжи могут преобразовывать вырабатываемый Sporomusa ovata ацетат в целый спектр органических продуктов.
В Калтехе придумали, как добывать кислород на Марсе
Георгий ГоловановХотя в космосе полно кислорода, по большей части он не пригоден для дыхания. Американские ученые создали реактор, превращающий углекислый газ в молекулярный кислород, или О2. Он поможет бороться с изменением климата на Земле, а на других планетах обеспечит пригодным для дыхания воздухом космонавтов и колонистов.
4811
Кислород — одно из главных препятствий на пути к освоению космоса. Земля — единственное известное место, где этот жизненно важный газ присутствует в достаточных количествах, а брать его с собой дорого и непрактично. На МКС экипаж может дышать свободно благодаря электролизу, а на крайний случай имеется запас сжатого газа. Но в больших масштабах такая схема непрактична.
Земля — единственное известное место, где этот жизненно важный газ присутствует в достаточных количествах, а брать его с собой дорого и непрактично. На МКС экипаж может дышать свободно благодаря электролизу, а на крайний случай имеется запас сжатого газа. Но в больших масштабах такая схема непрактична.
Инженеры Калифорнийского технологического института решили найти другой способ производства кислорода. Их идея кажется довольно простой: взять СО2 и убрать углерод. Они обнаружили, что если направить углекислый газ на инертную поверхность вроде золотой фольги, молекулы могут разделиться, образуя молекулярный кислород и атомный углерод, пишет New Atlas.
Созданный ими реактор действует примерно так же, как ускоритель частиц. Молекулы СО2 сначала ионизируются, а затем ускоряются при помощи электрического поля, после чего ударяются о золотую поверхность.
В нынешней форме производительность реактора не высока — на каждые 100 молекул СО2 получается одна или две молекулы кислорода, но реактор заслуживает внимания как доказательство функциональности идеи, которую можно будет масштабировать.
Стоит отметить, что такая же реакция происходит и в природе. Ее заметили впервые при изучении найденного на кометах молекулярного кислорода. Сначала исследователи решили, что кислород был заперт внутри скалы, но в 2017 ученые из Калифорнийского технического университета предложили другое объяснение: кислород вырабатывался вследствие того, что какое-то другое соединение сталкивалось с кометой на высокой скорости. Например, молекулы воды или углекислого газа.
В будущем такой реактор мог бы вырабатывать кислород для космонавтов, летящих на Луну, Марс или еще дальше. А на Земле он пригодится для удаления из атмосферы СО2, выбросы которого, по подсчетам проекта Global Carbon Project, достигнут в этом году рекордных объемов — 37,1 млрд тонн.
Facebook48Вконтакте11WhatsAppTelegram
Почему уровень CO2 в атмосфере так встревожил ученых?
Автор фото, AFP
Средний уровень содержания углекислого газа в атмосфере нашей планеты в 2015 году впервые за время наблюдений достиг критической отметки в 400 долей на миллион, сообщила Всемирная метеорологическая организация.
Критический уровень содержания диоксида углерода зафиксировала станция мониторинга воздуха, расположенная на Гавайях.
По словам метеорологов, в последний раз уровень содержания СО2 в атмосфере Земли регулярно поднимался выше 400 долей на миллион в период от трех до пяти миллионов лет назад.
Как предполагают эксперты, содержание углекислого газа в атмосфере не опустится ниже 400 долей на миллион в течение всего 2016 года, а возможно, что и в ближайшие десятилетия.
Что это означает для нас с вами?
Ведущий программы «Пятый этаж» Александр Баранов обсуждает тему с директором программы «Климат и энергетика» Всемирного фонда дикой природы Алексеем Кокориным и старшим научным сотрудником Института экологии растений и животных уральского отделения Российской академии наук Евгением Зиновьевым.
Александр Баранов: 400 частей на миллион для простого человека, который не разбирается в климатических вопросах, но зато учил арифметику в школе, это очень мало. Так же мало, как 200, 100 или 500. Особенно, когда речь идет о газе без цвета и запаха. Почему вдруг так переполошились ученые?
Так же мало, как 200, 100 или 500. Особенно, когда речь идет о газе без цвета и запаха. Почему вдруг так переполошились ученые?
Алексей Кокорин: CO2 — это один из газов, создающих парниковый эффект, второй после водяного пара, и главный газ, на концентрацию которого в атмосфере оказывает влияние человек.
И то, что человек не оказывает влияние на содержание водяного пара, не сильно облегчает дело, потому что влияние на содержание CO2 велико, и изотопным анализом доказано, что этот CO2 именно от сжигания топлива. Это много.
Число очень маленькое, но это на 30% больше, чем 50-60 лет назад. А до этого уровень был постоянен в течение долгого времени, имеются данные прямых измерений.
А.Б.:Ученые сейчас согласны с тем, что CO2 влияет на изменение климата, а не наоборот? Какое-то время назад некоторые ученые говорили, что на рост выброса углекислого газа влияет нагревание океана. А человек, по сравнению с океаном, выбрасывает намного меньше CO2 в атмосферу. Каков сейчас консенсус по этому поводу?
Каков сейчас консенсус по этому поводу?
А.К.: Консенсус практически полный. Я упомянул изотопный анализ, потому что в прошлом, и это тоже доказано, сначала менялась температура, а потом концентрация CO2.
Это было в переходный период между ледниковыми периодами и в других случаях. Корреляция шла в такой последовательности. Здесь корреляция идет в другой последовательности. Но главное, есть доказательства изотопного анализа. Тут консенсус есть.
Евгений Зиновьев: Я не климатолог, я палеонтолог. У нас в институте мы наблюдаем на севере, в Арктике, повышение как содержания CO2, и это показано нашими коллегами дендрохронологами, так и сопутствующие изменения — это наступление границы леса. У нас проводится мониторинг ландшафтов северной части Западно-Сибирской равнины и Полярного и приполярного Урала, и на протяжении последних сорока лет северная граница леса смещается к северу.
Это еще не достигает границ, которые были в климатический оптимум голоцена, когда древесная растительность достигала среднего Ямала, но процесс идет в том направлении и опосредованно связан с потеплением климата. Древесные растения занимают постепенно территории, от которых они когда-то отступили.
Древесные растения занимают постепенно территории, от которых они когда-то отступили.
То потепление, которое мы сейчас наблюдаем — не самое значительное, сейчас не самый теплый климат. Я могу сравнивать с недавним геологическим прошлым — последние 130-140 тысяч лет. Этот период называется Микулинское межледниковье, и тогда растения и теплолюбивые животные продвигались к северу гораздо дальше, чем сейчас.
В наше время, по объективным данным, пока еще такие уровни не достигнуты. Но то потепление было очень кратковременным, всего около 5 тысяч лет. Потом оно сменилось похолоданием, потом опять потеплением, и потом наступил длительный холодный период, зырянское оледенение, которое тоже делилось на более теплые и более холодные эпохи. Тогда начал формироваться скандинавский ледниковый щит.
А.Б.:То есть вы говорите о похолодании в Средневековый период?
Е.З.: Это вы говорите про исторические времена, а я имею в виду более ранние границы. Это поздний плейстоцен.
Это поздний плейстоцен.
А.Б.:А какие выводы из этого делать нам, неспециалистам? Противники теории глобального потепления, вызванного человеческой деятельностью, говорят, что мы просто находимся в периоде определенного цикла и с этим связаны различные колебания концентрации CO2.
Углекислый газ — пища для растений. В процессе фотосинтеза растения поглощают углекислый газ, выделяют в атмосферу кислород, и чем выше содержание углекислого газа, тем активнее растения начинают его потреблять и тем быстрее они растут.
Е.З.: Развития древесной растительности не наблюдается, наоборот. В Северной Америке, южной Европе леса горят, лесная растительность деградирует, идет аридизация, осушение климата. Легкие планеты сокращаются.
А.Б.:А почему это происходит? По идее, они должны расширяться?
Е.З.: Климат — многовекторная система, могут быть разные факторы, которые мы не всегда можем учитывать. Существует точка зрения, что начнут таять ледники, что связано с потеплением климата, а это происходит.
Существует точка зрения, что начнут таять ледники, что связано с потеплением климата, а это происходит.
Деградирует и Гренландский ледниковый щит, и в Арктике то высвободившееся большое количество пресной воды может изменить направление движения Гольфстрима. Тогда эта печка для Европы перестанет обогревать север Европы, и там снова начнется образование ледников. Это будет очень плохо.
Резкое потепление может дать толчок резкому похолоданию. Ледниковая шапка аккумулирует воду, начинается иссушение климата. Исчезают сплошные леса, образуются редкостойные леса. Климат становится сухой, холодный, континентальный, и он таким становится не только в Сибири, но и в Европе тоже.
Все очень сложно и взаимосвязано. Я не стал бы это упрощать, надо учитывать и современный фактор — увеличение выбросов CO2, связанное с промышленной деятельностью человека, с наличием большого количества производств, машин и так далее — с этим не поспоришь. Особенно в крупных мегаполисах, где сосредоточены большие производства.
Но другой вопрос, какие последствия это будет иметь. Человечество привыкло жить в определенных комфортных условиях. Если начнется увеличение или уменьшение уровня мирового океана, то начнутся катастрофы. Их может спровоцировать антропогенное воздействие. Человечество не настолько мало, чтобы не влиять на природную обстановку. Оно стало геологическим фактором, а не только биологическим, оно меняет более фундаментальные вещи в биосфере, в земной коре.
А.Б.:Допустим, человечество сможет сократить выброс CO2. Но это лишь один из факторов, и не самый большой. Может ли это что-то изменить, привести к какому-то резкому улучшению ситуации?
А.К.:Очень важно, с точки зрения физики атмосферы и океана, понимать, что происходит. Происходят два процесса: это процесс естественной изменчивости климата — солнце, самое наглядное, сложные периодические процессы в океане, Атлантическом, Тихом.
Есть и более изученные вещи — перетоки тепла из атмосферы в океан и обратно, которые носят цикличный характер. Эти циклические процессы накладываются на постоянное воздействие, которое носит линейный характер.
Эти циклические процессы накладываются на постоянное воздействие, которое носит линейный характер.
За XXI век ожидается повышение температуры в лучшем случае на два градуса, но реально — на три или три с половиной. И при этом циклически будут происходит похолодания и потепления, причем потепления — гораздо быстрее. И совершенно не очевидно, что увеличение числа опасных гидрологических явлений при понижении температуры станет меньше.
А.Б.:Это очень сложно понять человеку, который не занимается этой проблемой и в основном смотрит научно-популярные передачи, где эти вопросы примитивизируются, упрощаются, но простые аргументы действуют на сознание простого человека, который смотрит на это со стороны.
Когда ему дают график изменения температуры в XX веке и говорят: смотрите, пока человек особенно не влиял на атмосферу, температура поднималась, а когда он начал влиять, когда индустриализация была более мощной после 1940 до 1970 года, когда ситуация должна была ухудшиться, мы наблюдали похолодание.
На основе таких графиков люди говорят, что человек на самом деле не влияет, есть какие-то более мощные факторы, не зависящие от нас. Поэтому разговоры про роль человека в глобальном потеплении — миф, за которым стоят те, кому это выгодно.
Е.З.: Начитает срабатывать кумулятивный эффект, воздействие человека идет по нарастающей. На каком-то этапе оно может не проявляться, но потом, по мере увеличения концентрации CO2, парниковых газов, оно рано или поздно проявляется фактически по всему земному шару. Как в развитых районах, так и на севере, в Арктике.
Антропогенный фактор накладывается на факторы астрономические, связанные с орбитой движения Земли, цикличность сильно проявляется и так далее. И когда все друг на друга накладывается, могут произойти совершенно непредсказуемые события.
И антропогенное воздействие будет все увеличиваться, даже если будут введены ограничения на производство и так далее. Очень много выпускается автомобилей, которые загрязняют атмосферу очень сильно. И другие факторы. Они никуда не уйдут.
Очень много выпускается автомобилей, которые загрязняют атмосферу очень сильно. И другие факторы. Они никуда не уйдут.
А травяная и древесная растительность не увеличивается, а, наоборот, происходит деградация лесного покрова.
А.Б.:Но мы видели и сообщения другого рода, что в Бразилии вдруг начали расти леса Амазонки.
Е.З.: Это есть, но вы посмотрите, что в Америке творится? На юго-западе, в Калифорнии? Там массовые лесные пожары. Нужно время, чтобы после пожара лес восстановился. После пожара несколько лет проходит, прежде чем лес начинает подрастать. А где сухо, он просто перестает расти. Лес превращается в степь, пустыню и так далее.
А.Б.:Это серьезные факторы, но для обыденного сознания трудно это совместить с его собственной деятельностью. Можно придерживаться теории, что деятельность человека — это последняя капля, которая может перевесить экологический баланс на фоне более серьезных факторов. Но когда говорят, что есть такой фактор, как пятна на Солнце, активизация Солнца, который представляет собой мощный источник энергии, по сравнению с которым вся наша деятельность — мелочь, даже сравнивать невозможно.
Но когда говорят, что есть такой фактор, как пятна на Солнце, активизация Солнца, который представляет собой мощный источник энергии, по сравнению с которым вся наша деятельность — мелочь, даже сравнивать невозможно.
Тоже показывают графики — когда Солнце активно, температура повышается, а когда менее активно — понижается, все это коррелируется. Потом говорят, что все зависит от того, по какой орбите Земля движется. Если орбита эллиптическая — становится холоднее. И когда все это человеку говорят, он думает: ну что по сравнению с такими космическими явлениями наши несчастные выбросы в атмосферу. Как можно убедить человека, что мы своими действиями можем этот баланс нарушить?
Е.З.:Надо как-то убеждать, потому что это действительно фактор не последний. Например, леса горят и без человека — сухие грозы и так далее. Но человеческая деятельность этому способствует. Каждый должен начинать с себя. Люди должны понимать, что от них многое зависит.
Один человек может сказать: я буду делать, что считаю нужным, все равно от меня ничего не зависит. Но людей — миллионы, и если каждый так будет считать, от этого лучше не будет. Косность человеческого мышления существует, к сожалению.
А.Б.:Как убедить человека, что его машина, на которой он проедет лишние пять километров, тоже влияет на климат, даже на фоне того, что Земля на эллиптической орбите, а не на какой-то другой?
А.К.: Российские климатологи, и не только российские, задумывались, как это наглядно показать. Вероятные реакции Солнца лет через 15-20 с высокой вероятностью снизят температуру на земном шаре примерно на 0,25 градуса. А антропогенное воздействие — как минимум на два градуса. Так же было и в 30-40 годы ХХ века.
И еще характерная вещь такая: прогреваются и стратосфера, и тропосфера. То есть у вас как бы пленка парниковая, и, если греется над пленкой и под пленкой, значит — лампочка стала греть сильнее. А если под пленкой греется, а над пленкой холодает — значит, пленка стала толще. Вот как-то так наглядно можно попытаться объяснить.
А если под пленкой греется, а над пленкой холодает — значит, пленка стала толще. Вот как-то так наглядно можно попытаться объяснить.
А.Б.:Вы допускаете вероятность, что мы действительно находимся между двумя ледниковыми периодами и что-то произойдет, и начнется похолодание на Земле?
Е.З.: Ваш вопрос говорит о том, что мы с коллегой говорим плохо. Безусловно, мы находимся между двумя ледниковыми периодами, тем, который закончился примерно 300 тыс лет назад, и тем, который начнется через несколько тысяч лет — может быть 20, может быть, 100. Об этом мой коллега как климатолог знает лучше. Но это будет абсолютно точно. Мы говорим об иных временных масштабах. В этих масштабах влияние человека на глобальное потепление не может рассматриваться, это сотни тысяч лет.
А.Б.:То есть мы можем до этого похолодания не дожить?
Е.З.: К сожалению, точно не доживем до глобального похолодания, даже из наших правнуков никто не доживет. Будут ли периоды похолодания в течение XXI века? Да, наверное будут. Мы живем в эпоху наложения различных вариаций, в том числе солнечных, на глобальный тренд.
Будут ли периоды похолодания в течение XXI века? Да, наверное будут. Мы живем в эпоху наложения различных вариаций, в том числе солнечных, на глобальный тренд.
_____________________________________________________________
Загрузить подкаст передачи «Пятый этаж» можно здесь.
Углекислый газ это кислород
Отличия кислорода от углекислого газа достаточно разнообразны, и одно из них известно всем – это то, что кислород потребляется человеком и другими животными при дыхании, а углекислый газ, напротив, является завершающим продуктом дыхания (наряду с водяным паром). Соответственно, дышать углекислотой нельзя.
С точки зрения химика, прежде всего, кислород считается химическим элементом, а углекислый газ – сложным веществом (имеющим в своём составе, кроме кислорода, ещё и 1/3 углерода). Кислород поддерживает процесс горения (выступает окислителем), СО2 образуется при горении и способен его эффективно подавлять.
О2 в воде только лишь растворяется, а диоксид углерода вступает с нею в химическую реакцию, образуя так называемую угольную кислоту.
Оба вещества не имеют цвета, аромата, тяжелее чистого воздуха.
Без углекислого газа и кислорода жизнь человека невозможна. Углекислота и углекислый газ в организме стимулируют его защитные системы, помогая справляться с физическими и интеллектуальными нагрузками. Но только в определенных дозах. Когда же наступает момент, при котором углекислый газ начинает нас медленно убивать?
Углекислый газ в жизни человека
Мало кто знает, что свежий морской или загородный воздух содержит около 0,03-0,04% углекислого газа и это тот уровень, который необходим для нашего дыхания. Углекислый газ в крове тоже выполняет свою функцию, однако его концентрация должна быть предельно низка. Одновременно большинству из нас знакомо ощущение духоты в помещении и симптомы связанные с этим т.е. усталость, сонливость, раздражительность. Такое состояния многие связывают с нехваткой кислорода. На самом деле, это симптомы вызваны превышением уровня углекислого газа в воздухе. Кислород и угдекислый газ взаимосвязаны: первого еще достаточно, а последнего уже в избытке.
На самом деле, это симптомы вызваны превышением уровня углекислого газа в воздухе. Кислород и угдекислый газ взаимосвязаны: первого еще достаточно, а последнего уже в избытке.
Предельно допустимой нормой содержания углекислого газа в воздухе внутри помещений считается 0,1-0,15%. Исследования, проведенные в Великобритании в 2007г., выявили, что при уровне углекислого газа 0,1% (т.е. в два с небольшим раза выше, чем нормальный атмосферный уровень) в офисном помещении сотрудники испытывают головную боль, усталость, не могут сконцентрировать внимание. Все это в конечном итоге приводит к увеличению числа больничных листов и не способности продуктивно работать. Особенно страдают носоглотка и верхние дыхательные пути.
Группа итальянских ученых в 2006г. представила результаты своих исследований на Конгрессе Европейского Респираторного Общества. В результате исследований было выявлено, что два школьника из трех в Европе испытывают на себе негативное воздействие повышенного уровня углекислого газа в классе. У них наблюдалось тяжелое дыхание, отдышка, сухой кашель, ринит и проблемы с носоглоткой гораздо чаще, чем у их сверстников.
У них наблюдалось тяжелое дыхание, отдышка, сухой кашель, ринит и проблемы с носоглоткой гораздо чаще, чем у их сверстников.
В США, Канаде и ЕЭС в настоящее время качеству воздуха и, в частности, концентраций кислорода/углекислого газа в школах уделяется большое внимание, есть организации, которые занимаются замерами уровня содержания углекислого газа в школьных помещениях. В России таких организаций практически нет, а точнее сказать, не видны плоды их деятельности. Исследования того, как влияет повышенный уровень СО2 в классе на здоровье и успеваемость детей не проводились, хотя нужно понимать, что эта проблема в школах России стоит не менее остро, чем в Европе или США.
Другие интересные статьи раздела:
Вы можете приложить к своему отзыву картинки.
В сварочном производстве используется термин «углекислый газ» см. ГОСТ 2601. В «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением» принят термин «углекислота», а в ГОСТ 8050 – термин «двуокись углерода».
Существует множество способов получения углекислого газа, основные из которых рассмотрены в статье Способы получения углекислого газа.
Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. При атмосферном давлении и температуре -78,5°С углекислый газ, минуя жидкое состояние, превращается в белую снегообразную массу «сухой лед».
Под давлением 528 кПа и при температуре -56,6°С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Двуокись углерода термически устойчива, диссоциирует на окись углерода и кислород только при температуре выше 2000°С.
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля.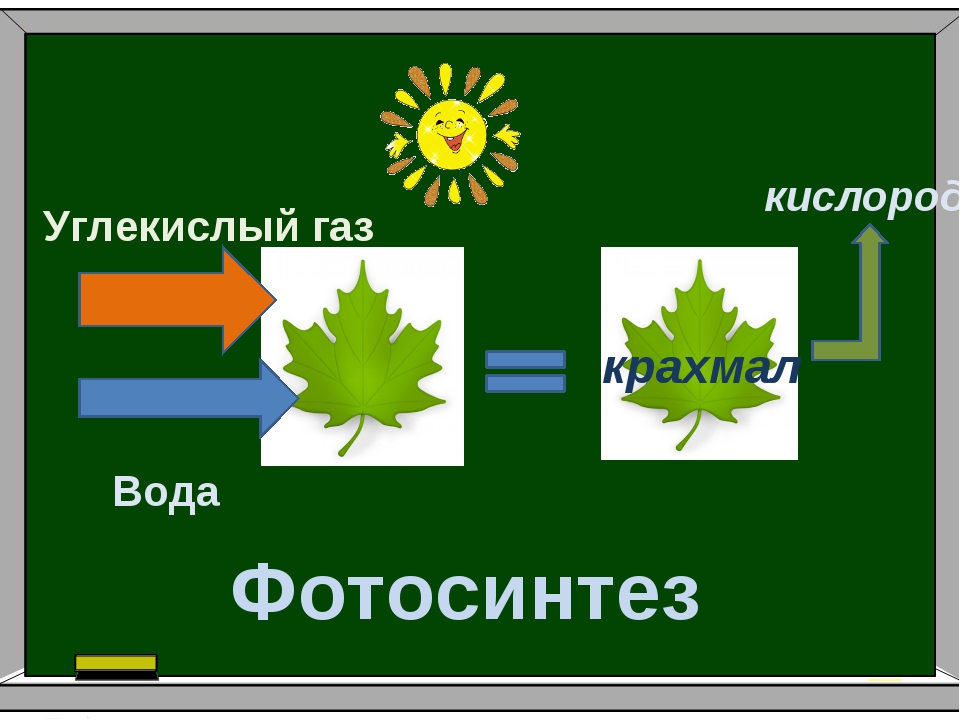 Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3. Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
Жидкая двуокись углерода бесцветная жидкость без запаха, плотность которой сильно изменяется с изменением температуры. Она существует при комнатной температуре лишь при давлении более 5,85 МПа. Плотность жидкой углекислоты 0,771 г/см 3 (20°С). При температуре ниже +11°С она тяжелее воды, а выше +11°С – легче.
Плотность жидкой углекислоты 0,771 г/см 3 (20°С). При температуре ниже +11°С она тяжелее воды, а выше +11°С – легче.
Удельная масса жидкой двуокиси углерода значительно изменяется с температурой, поэтому количество углекислоты определяют и продают по массе. Растворимость воды в жидкой двуокиси углерода в интервале температур 5,8-22,9°С не более 0,05%.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При нормальных условиях (20°С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается. При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние. Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода – поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
Впервые жидкую двуокись углерода получили в 1823 г. Гемфри Дэви (Humphry Davy) и Майкл Фарадей (Michael Faraday).
Твердая двуокись углерода «сухой лед», по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое – 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры. Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке металлов;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- для чистки поверхностей сухим льдом.
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Углекислый газ является активным газом, в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Ранее препятствием для применения углекислоты в качестве защитной среды являлись поры в швах. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения оксиси углерода (СО) вследствие недостаточной его раскисленности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
где Мэ – металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное – кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом – только в ванне. Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м 3 ) углекислый газ оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией. Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м 3 (0,5%).
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы. В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м 3 углекислого газа. В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10. 15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух. Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги
Баллон с двуокисью углерода окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Ученые нашли новый способ получения пригодного для дыхания кислорода на Марсе
Марсианскую атмосферу сложно назвать дружелюбной: давление в 170 раз меньше, чем на Земле, и состоит она на 95% из углекислого газа. Кислорода в ней всего 0.15%, так что без защитных средств выжить на Марсе человеку невозможно. Поэтому в будущих марсианских миссиях кислород придется везти с Земли, что не эффективно, так что одной из первоочередных задач является получение этого газа прямо на Марсе, при этом, желательно, с наименьшей тратой ресурсов. И ученые нашли новый способ, который будущие колонисты могут использовать для генерации своего собственного кислорода.
Исследовательская группа обнаружила эту новую реакцию генерации кислорода, изучая кометы. Большинство этих маленьких ледяных миров происходят из далекой области Солнечной системы, известной как Облако Оорта, находящейся далеко за пределами орбиты Нептуна — последней планеты нашей звездной системы. Когда кометы, двигаясь по орбите, приближаются к Солнцу, его тепло заставляет лед испаряться (сублимировать). Эта реакция производит длинные кометные хвосты, которые могут простираться на тысячи километров, и, в некоторых случаях, быть заметными с Земли даже невооруженным глазом.
Когда кометы, двигаясь по орбите, приближаются к Солнцу, его тепло заставляет лед испаряться (сублимировать). Эта реакция производит длинные кометные хвосты, которые могут простираться на тысячи километров, и, в некоторых случаях, быть заметными с Земли даже невооруженным глазом.
Группа исследователей из Калифорнийского технологического института (КТИ) в Пасадене нашла новое объяснение тому, как кометы генерируют молекулярный кислород, то есть два атома кислорода, которые объединяются вместе и находятся в таком виде в привычном нам воздухе.
Один из уже известных методов — через кинетическую энергию. Сублимирующая комета — это занятая среда, где солнечный ветер (постоянный поток частиц, исходящих от Солнца) может сильно ускорять молекулы воды на ее поверхности. И если на поверхности есть кислородсодержащие соединения, разогнанные молекулы воды могут отрывать от них атомы кислорода и производить молекулярный кислород.
Комета Галлея 8 марта 1986 года.
Исследователи обнаружили, что молекулярный кислород также может быть получен в результате реакций с углекислым газом: он содержит один атом углерода и два атома кислорода. Бывший сотрудник докторантуры КТИ Юньси Яо и нынешний профессор химической инженерии Константинос Гиапис смоделировали эту реакцию, направив разогнанные молекулы двуокиси углерода на золотую фольгу. Поскольку золотая фольга не может быть окислена, сама по себе она не должна производить молекулярный кислород. Но когда углекислый газ проникает в фольгу с высокой скоростью, на поверхности золота начинает образовываться молекулярный кислород.
Бывший сотрудник докторантуры КТИ Юньси Яо и нынешний профессор химической инженерии Константинос Гиапис смоделировали эту реакцию, направив разогнанные молекулы двуокиси углерода на золотую фольгу. Поскольку золотая фольга не может быть окислена, сама по себе она не должна производить молекулярный кислород. Но когда углекислый газ проникает в фольгу с высокой скоростью, на поверхности золота начинает образовываться молекулярный кислород.
«Это означает, что оба атома кислорода происходят из одной и той же молекулы CO2 при ее эффективном расщеплении таким необычным образом», — говорится в заявлении представителей Калифорнийского технологического института. Чтобы лучше понять, как углекислый газ может разлагаться на молекулярный кислород, профессор химии КТИ Том Миллер и его научный сотрудник Филипп Шушков создали компьютерную симуляцию.
Исследователи утверждают, что одной из проблем при моделировании реакции является то, что реагирующие молекулы очень сильно возбуждены, то есть они колеблются и вращаются сложным образом.
 «В общем, возбужденные молекулы часто могут привести к необычной химии, поэтому мы решили начать именно с этого», — говорится в заявлении Миллера. «Но, к нашему удивлению, возбужденное состояние не создавало молекулярный кислород. Вместо этого молекула распадалась на другие продукты». Но вскоре ученые поняли, в чем дело — для производства молекулярного кислорода требуются необычные «изогнутые» молекулы углекислого газа с нетипичный геометрией. Правда, есть одна проблема — в естественной среде они встречаются достаточно редко.
«В общем, возбужденные молекулы часто могут привести к необычной химии, поэтому мы решили начать именно с этого», — говорится в заявлении Миллера. «Но, к нашему удивлению, возбужденное состояние не создавало молекулярный кислород. Вместо этого молекула распадалась на другие продукты». Но вскоре ученые поняли, в чем дело — для производства молекулярного кислорода требуются необычные «изогнутые» молекулы углекислого газа с нетипичный геометрией. Правда, есть одна проблема — в естественной среде они встречаются достаточно редко.Для существенного разгона молекул углекислого газа в своем эксперименте по столкновению CO2 с золотой фольгой Яо и Гиапис использовали электрическое поле. Тем не менее, они утверждают, что реакция может происходить и при меньших скоростях, что может объяснить, почему в марсианской атмосфере присутствует некоторое количество кислорода.
Продукты столкновения углекислого газа с золотой фольгой включают в себя и необходимый для дыхания молекулярный кислород.
«Вы можете бросить камень с достаточной скоростью в емкость с углекислым газом и достичь того же», — сказал Гиапис в своем заявлении. «Скорость должна быть сравнима с той, с которой кометы или астероиды путешествуют в космосе».
Раньше ученые думали, что крошечная концентрация кислорода в атмосфере Марса, вероятно, генерируется после того, как ультрафиолетовое излучение Солнца расщепляет молекулы двуокиси углерода в воздухе Красной планеты. Однако Гиапис полагает, что марсианский кислород может также генерироваться, когда частицы пыли, ускоренные в атмосфере до высокой скорости, врезаются в молекулы углекислого газа.
Экспериментальная установка Гиаписа имеет очень низкий КПД, генерируя только одну или две молекулы кислорода на каждые 100 молекул углекислого газа, проходящих через ускоритель. Однако, по словам ученого, возможно, его реактор можно будет модифицировать, чтобы создавать пригодный для дыхания кислород астронавтам на Марсе. А на Земле реактор может быть полезен для выведения углекислого газа (который также является мощным парниковым газом и основным фактором глобального потепления) из атмосферы и превращения его в кислород.
«Это конечное устройство? Нет. Это устройство, которое может решить проблему с кислородом на Марсе? Пока что тоже нет», — сказал Гиапис. «Но это устройство, которое может делать что-то очень сложное. Мы проводим на нем сумасшедшие эксперименты».
Кстати, реактор Гиаписа — не единственное устройство по получению молекулярного кислорода. НАСА в 2020 году собирается отправить на Красную планету новый ровер, оснащенный инструментом MOXIE. Он будет вытягивать углекислый газ из тонкой марсианской атмосферы и электрохимически превращать его в чистый кислород и окись углерода. И если этот эксперимент окажется удачным, то колонизировать Марс станет существенно проще.
СМЕСЬ ДИОКСИДА УГЛЕРОДА И КИСЛОРОДА | CAMEO Chemicals
Химический лист данных
Химические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз Знаки опасности Министерства транспорта США и общие описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.| Номер CAS | Номер ООН / NA | Знак опасности DOT | USCG CHRIS Код |
|---|---|---|---|
|
| никто | |
| Карманное руководство NIOSH | Международная карта химической безопасности | ||
| никто | |||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 3 | Может вызвать серьезные или необратимые травмы. | |
| Воспламеняемость | 0 | Не горит в обычных условиях пожара. | |
| Нестабильность | 0 | Обычно стабильно даже в условиях пожара. | |
| Специальный | OX | Обладает окислительными свойствами. |
(NFPA, 2010)
Общее описание
Смесь двуокиси углерода с кислородом — это бесцветный газ без запаха.И углекислый газ, и кислород негорючие; однако кислород может ускорить возгорание. При длительном воздействии огня или сильной жары контейнеры могут сильно разорваться и взорваться.
Опасности
Оповещения о реактивности
Реакции воздуха и воды
Двуокись углерода растворима в воде и образует в воде угольную кислоту, мягкую кислоту.
Пожарная опасность
Выдержка из руководства ERG 122 [Газы — Окисляющие (включая охлажденные жидкости)]:Вещество не горит, но поддерживает горение.Некоторые могут взрывоопасно реагировать с топливом. Может воспламенить горючие вещества (дерево, бумага, масло, одежда и т. Д.). Пары сжиженного газа изначально тяжелее воздуха и распространяются по земле. Сток может создать опасность пожара или взрыва. Емкости могут взорваться при нагревании. Разорванные цилиндры могут взорваться. (ERG, 2016)
Опасность для здоровья
Выдержка из руководства ERG 122 [Газы — окисляющие (включая охлаждаемые жидкости)]:Пары могут вызвать головокружение или удушье без предупреждения. Контакт с газом или сжиженным газом может вызвать ожоги, тяжелые травмы и / или обморожения.При пожаре могут выделяться раздражающие и / или токсичные газы. (ERG, 2016)
Профиль реактивности
Чистый кислород — мощный окислитель. CO2 инертен, поэтому реакционная способность этой смеси во многом зависит от% содержания каждого компонента. Чем выше процентное содержание инертного газа, тем менее реакционноспособен он как окислитель. Пыль магния, лития, калия, натрия, циркония, титана и некоторых магниево-алюминиевых сплавов, а также нагретого алюминия, хрома и магния во взвешенном состоянии в двуокиси углерода горючая и взрывоопасная.Это особенно актуально в присутствии сильных окислителей, таких как перекиси. Присутствие диоксида углерода в растворах гидрида алюминия в эфире может вызвать сильное разложение при нагревании остатка [J. Амер. Chem. Soc., 1948, 70, 877]. Рассмотрены опасности, возникающие при использовании углекислого газа в системах пожаротушения замкнутых объемов воздуха и легковоспламеняющихся паров. Опасность, связанная с его использованием, заключается в том, что могут возникать большие электростатические разряды, которые инициируют взрыв, [Quart.Saf. Сумма, 1973, 44 (1740, 10).
Чем выше процентное содержание инертного газа, тем менее реакционноспособен он как окислитель. Пыль магния, лития, калия, натрия, циркония, титана и некоторых магниево-алюминиевых сплавов, а также нагретого алюминия, хрома и магния во взвешенном состоянии в двуокиси углерода горючая и взрывоопасная.Это особенно актуально в присутствии сильных окислителей, таких как перекиси. Присутствие диоксида углерода в растворах гидрида алюминия в эфире может вызвать сильное разложение при нагревании остатка [J. Амер. Chem. Soc., 1948, 70, 877]. Рассмотрены опасности, возникающие при использовании углекислого газа в системах пожаротушения замкнутых объемов воздуха и легковоспламеняющихся паров. Опасность, связанная с его использованием, заключается в том, что могут возникать большие электростатические разряды, которые инициируют взрыв, [Quart.Saf. Сумма, 1973, 44 (1740, 10).
Принадлежит к следующей реактивной группе (группам)
Потенциально несовместимые абсорбенты
Соблюдайте осторожность: жидкости с данной классификацией реактивной группы
известно реагировать с
абсорбенты
перечислено ниже. Дополнительная информация о абсорбентах, включая ситуации, на которые следует обратить внимание …
Дополнительная информация о абсорбентах, включая ситуации, на которые следует обратить внимание …
- Абсорбенты на основе целлюлозы
- Вспененные полимерные абсорбенты
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь.В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Выдержка из Руководства ERG 122 [Газы — Окисляющие (включая охлаждаемые жидкости)]:В качестве немедленной меры предосторожности изолировать место разлива или утечки на расстоянии не менее 100 метров (330 футов) во всех направлениях.
БОЛЬШОЙ РАЗЛИВ: Рассмотрите возможность начальной эвакуации с подветренной стороны на расстояние не менее 500 метров (1/3 мили).
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ВЫКЛЮЧИТЕСЬ на 800 метров (1/2 мили) во всех направлениях; также рассмотрите возможность начальной эвакуации на 800 метров (1/2 мили) во всех направлениях. (ERG, 2016)
(ERG, 2016)
Пожарная
Выдержка из Руководства ERG 122 [Газы — Окисляющие (включая охлаждаемые жидкости)]:Используйте средства пожаротушения, подходящие для данного типа окружающего пожара.
МАЛЫЙ ПОЖАР: Сухие химикаты или CO2.
БОЛЬШОЙ ПОЖАР: водяная струя, туман или обычная пена. Уберите контейнеры из зоны пожара, если это можно сделать без риска. С поврежденными цилиндрами должны обращаться только специалисты.
ПРОТИВОПОЖАРНЫЕ ТАНКИ: тушите огонь с максимального расстояния или используйте автоматические держатели шлангов или контрольные сопла.После того, как огонь полностью погаснет, охладите емкости затопленным количеством воды. Не направляйте воду на источник утечки или предохранительные устройства; может возникнуть обледенение. Немедленно удалиться в случае появления шума из вентиляционных устройств безопасности или изменения цвета бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При сильном пожаре используйте автоматические держатели для шлангов или контрольные сопла; если это невозможно, отойдите с территории и дайте огню загореться. (ERG, 2016)
(ERG, 2016)
Без огня
Выдержка из руководства ERG 122 [Газы — окисляющие (включая охлаждаемые жидкости)]:Храните горючие вещества (дерево, бумага, масло и т. Д.)) вдали от пролитого материала. Не касайтесь пролитого материала и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. По возможности поверните протекающие емкости так, чтобы выходил газ, а не жидкость. Не направляйте воду на пролитую или источник утечки. Используйте водяное распыление, чтобы уменьшить испарения или отвести облако пара. Не допускайте попадания сточных вод на разлитый материал. Не допускайте попадания в водные пути, канализацию, подвалы или закрытые пространства. Дайте веществу испариться. Изолируйте зону, пока газ не рассеется. ВНИМАНИЕ: При контакте с охлаждаемыми / криогенными жидкостями многие материалы становятся хрупкими и могут внезапно разрушиться.(ERG, 2016)
Защитная одежда
Выдержка из руководства ERG 122 [Газы — окисляющие (включая охлаждаемые жидкости)]: Надеть автономный дыхательный аппарат с положительным давлением (SCBA). Носите химическую защитную одежду, специально рекомендованную производителем. Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом.При работе с охлажденными / криогенными жидкостями всегда надевайте теплозащитную одежду. (ERG, 2016)
Носите химическую защитную одежду, специально рекомендованную производителем. Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом.При работе с охлажденными / криогенными жидкостями всегда надевайте теплозащитную одежду. (ERG, 2016)
Ткани для костюмов DuPont Tychem®
Нет доступной информации.
Первая помощь
Выдержка из Руководства ERG 122 [Газы — Окисляющие (включая охлаждаемые жидкости)]: Убедитесь, что медицинский персонал осведомлен о задействованном материале (материалах) и принимает меры предосторожности, чтобы защитить себя. Переместите пострадавшего на свежий воздух. Позвоните в службу 911 или в скорую медицинскую помощь. Сделайте искусственное дыхание, если пострадавший не дышит.Дайте кислород, если дыхание затруднено. Снимите и изолируйте загрязненную одежду и обувь. Примороженную к коже одежду перед снятием следует разморозить. В случае контакта со сжиженным газом разморозить обмерзшие детали теплой водой. Сохраняйте спокойствие и тепло жертвы. (ERG, 2016)
Примороженную к коже одежду перед снятием следует разморозить. В случае контакта со сжиженным газом разморозить обмерзшие детали теплой водой. Сохраняйте спокойствие и тепло жертвы. (ERG, 2016)
Физические свойства
Точка воспламенения: данные недоступны
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: данные недоступны
Точка плавления: данные недоступны
Давление пара: данные недоступны
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес: данные недоступны
Точка кипения: данные недоступны
Молекулярный вес: данные недоступны
Растворимость в воде: данные отсутствуют
Потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендуемые уровни острого воздействия)
Информация AEGL отсутствует.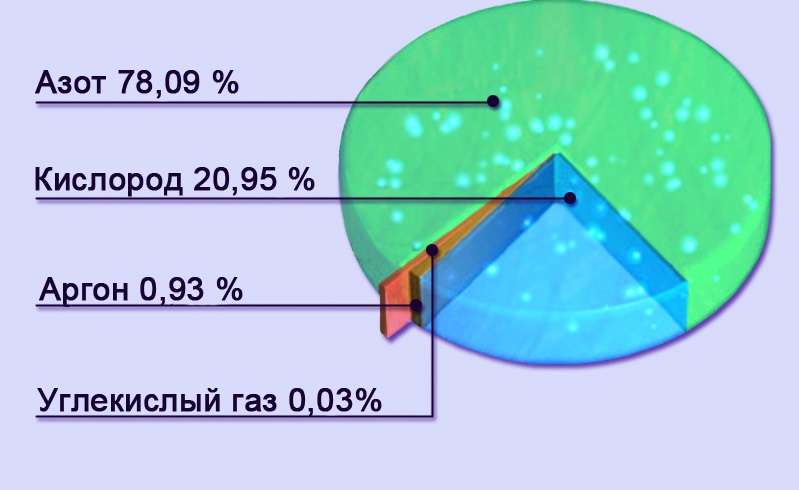
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация по ERPG отсутствует.PAC (Критерии защитного действия)
Информация о PAC недоступна.Нормативная информация
В Поля нормативной информации включать информацию из Сводный список раздела III Агентства по охране окружающей среды США Списки, химический объект Министерства внутренней безопасности США Стандарты борьбы с терроризмом, и U.S. Администрация по охране труда и здоровья Стандартный список управления производственной безопасностью особо опасных химических веществ (подробнее об этих источники данных).Сводный список списков EPA
Нет нормативной информации.Стандарты по борьбе с терроризмом для химических объектов Министерства здравоохранения США (CFATS)
Нет нормативной информации.Список стандартов управления безопасностью процессов (PSM) OSHA
Нет нормативной информации.
Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества, включая торговые наименования и синонимы.
- КАРБОГЕН
- КАРБОГЕН 240
- СМЕСЬ ДИОКСИДА УГЛЕРОДА И КИСЛОРОДА
- СМЕСЬ ДИОКСИДА УГЛЕРОДА И КИСЛОРОДА, СЖАТЫЕ
- СМЕСЬ ДИОКСИД УГЛЕРОДА-КИСЛОРОД.
- СМЕСЬ ДИОКСИД УГЛЕРОДА-КИСЛОРОД
- СМЕСЬ КИСЛОРОДА И ДИОКСИДА УГЛЕРОДА
- СМЕСЬ КИСЛОРОДА И ДИОКСИДА УГЛЕРОДА, СЖАТЫЕ
- КИСЛОРОД СМЕСЬ. СОДЕРЖИТ
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Оценка 8Б
8 класс (A и B вместе)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими организациями, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Уровни насыщения кислородом и влияние двуокиси углерода
Лорен Карлстром, член команды O + |
Как считывать уровень насыщения кислородом
Каждой клетке вашего тела необходим кислород для нормального функционирования, и даже небольшое снижение уровня кислорода в вашем теле может повлиять на ваше самочувствие и производительность.Чтобы максимально использовать ваши долгие дни и поздние ночи, вам важно знать, как отслеживать уровень кислорода и убедиться, что у вас есть весь кислород, который вы хотите чувствовать и работать на пике.
Что такое хороший уровень SpO2?
Для подавляющего большинства людей «нормальный» или «здоровый» уровень насыщения крови кислородом (SpO2) составляет от 94 до 99 процентов. Упражнения, алкоголь, полеты, поездки на работу, поездки на возвышенности или вдыхание загрязненного воздуха могут временно снизить уровень кислорода в вашем организме. Если вы подозреваете, что у вас низкий уровень кислорода, есть два основных теста, чтобы определить, может ли вам помочь кислородная добавка.
Если вы подозреваете, что у вас низкий уровень кислорода, есть два основных теста, чтобы определить, может ли вам помочь кислородная добавка.
(ВНИМАНИЕ: любой человек с любым типом здоровья или заболеванием должен проконсультироваться со своим врачом перед использованием продуктов Oxygen Plus (O +). Продукты O + предназначены только для отдыха, периодического использования, а не для использования в медицинских целях или в целях спасения жизни. Для получения дополнительной информации см. раздел Правовая информация.)
Пульсоксиметр
Пульсоксиметр прикрепляется к пальцу руки или ноги пользователя и посылает инфракрасный свет в капилляры, одновременно измеряя количество отраженного света.Это неинвазивное устройство — самый простой и распространенный метод тестирования SpO2. Однако он не измеряет уровни концентрации углекислого газа, и более дешевые устройства оказались менее точными (как работает пульсоксиметр). Вы можете приобрести проверенный и одобренный покупателями беспроводной пульсоксиметр iHealth Wireless Pulse Oximeter прямо здесь, в магазине O +.
Анализ газов артериальной крови
В этом тесте на SpO2 врач берет кровь прямо из артерии на вашем запястье. Хотя он гораздо более инвазивный, он также гораздо более точен и позволяет врачам определять уровень углекислого газа и других газов в дополнение к кислороду.Он также может определить уровень кислотности вашей крови (ногтей).
CO2, эффект Бора и показания оксиметра
Иногда низкий уровень насыщения кислородом связан с высоким уровнем углекислого газа. Это может повлиять на ваши показания SpO2 двумя способами. Во-первых, когда ваше тело не может адекватно утилизировать этот отработанный газ или подвергается воздействию большого количества углекислого газа, он накапливается в крови и взаимодействует с водой с образованием угольной кислоты. Этот процесс, известный как эффект Бора, заставляет кровь высвобождать кислород, одновременно повышая кислотность крови (Voet et al.).
Во-вторых, присутствие окиси углерода полностью исключает показания пульсоксиметра.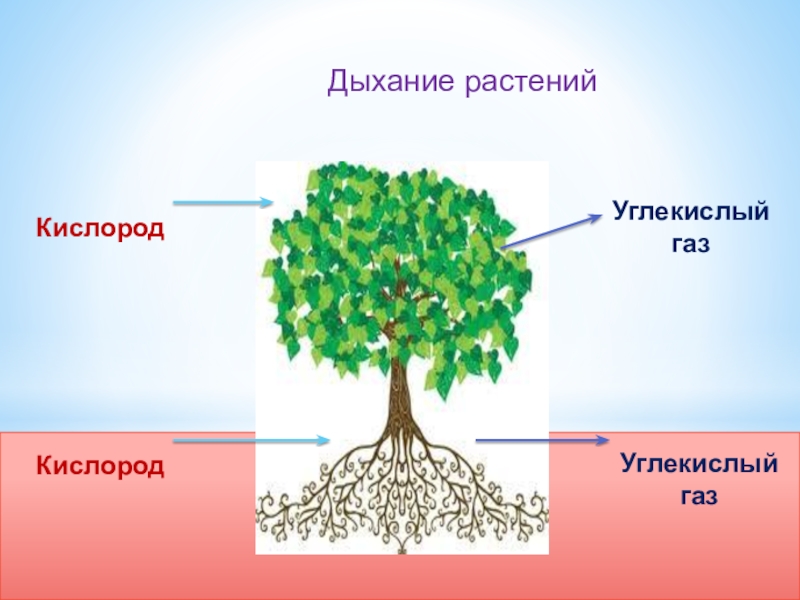 Это связано с тем, что молекулы CO2 могут прикрепляться к гемоглобину человека и успешно имитировать молекулы кислорода. Пульсоксиметр не может определить разницу между этими молекулами, а это означает, что вы получите комбинированное показание насыщения диоксида углерода / кислорода, а не просто измерения кислорода (Шиппи и др.). В любом случае анализ газов артериальной крови поможет определить, является ли углекислый газ причиной низкого уровня кислорода.
Это связано с тем, что молекулы CO2 могут прикрепляться к гемоглобину человека и успешно имитировать молекулы кислорода. Пульсоксиметр не может определить разницу между этими молекулами, а это означает, что вы получите комбинированное показание насыщения диоксида углерода / кислорода, а не просто измерения кислорода (Шиппи и др.). В любом случае анализ газов артериальной крови поможет определить, является ли углекислый газ причиной низкого уровня кислорода.
Использование Oxygen Plus для повышения уровня SpO2
Многочисленные исследования показали преимущества кислородных добавок при низких уровнях насыщения (Stoller et al). Многие люди с низким SpO2 используют обычные режимы лечения, такие как концентраторы или барокамеры с кислородом, но для активного, здорового человека всегда возможно неожиданное падение при внутренних изменениях (например, тренировках, стрессе) или изменениях окружающей среды (например, высота, загрязнение).
Для использования в рекреационных целях Oxygen Plus предлагает быстрый заряд кислорода «верни меня обратно» по запросу. Вот почему переносной баллон с кислородом O + в рюкзаке или кармане может быть именно тем, что вам нужно в следующий раз, когда вы подниметесь на самую высокую гору или достигнете своей следующей умственной или физической цели.
Вот почему переносной баллон с кислородом O + в рюкзаке или кармане может быть именно тем, что вам нужно в следующий раз, когда вы подниметесь на самую высокую гору или достигнете своей следующей умственной или физической цели.
О + О + О + О +
«Как работает пульсоксиметр». Блог Фонда ХОБЛ. Фонд ХОБЛ. Интернет. 4 мая 2017.
Kent BD, Mitchell PD, McNicholas W.T., «Гипоксемия у пациентов с ХОБЛ: причина, последствия и прогрессирование заболевания», Международный журнал хронической обструктивной болезни легких, март 2011; 2011 (6): 199-208
Наиль Р.«Анализ газов крови». Линия здоровья. 7 января 2016 г. Web. 4 мая 2017.
Шиппи М.Б., Петтерсон М.Т., Уитман Р.А., Шиверс С.Р., «Клиническая оценка ушного оксиметра BTI Biox II», Respir Care, 1984; 29 (7): 730-5Stoller JK, Panos RJ, Krachman S, Doherty DE, Make B, Исследовательская группа по долгосрочному лечению кислородом, «Кислородная терапия для пациентов с ХОБЛ: текущие данные и испытания по долгосрочному лечению кислородом», Chest, июль 2010 г .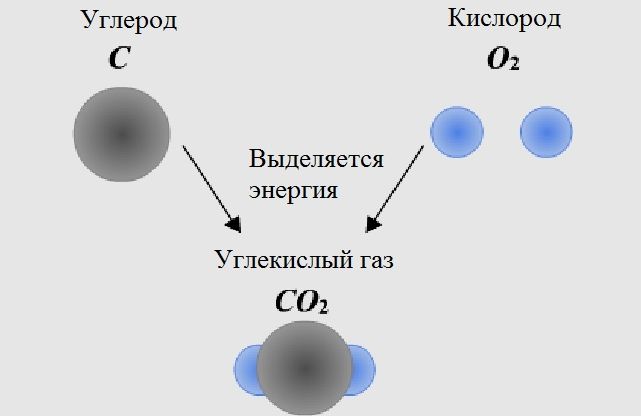 ; 138 (1): 179-87
; 138 (1): 179-87
Воет, Дональд, Джудит Г. Воет и Шарлотта В.Пратт. Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2013. Печать.
Исследование «Человеческое чудо: углекислый газ и огонь»
Исследование «Человеческое чудо: двуокись углерода и огонь» Для указанной выше версии требуется Quicktime 7
Чтобы воспроизвести уменьшенную версию видео, щелкните здесь левой кнопкой мыши; чтобы загрузить видео, щелкните здесь правой кнопкой мыши (ПК) и «сохранить ссылку как» или щелкните, удерживая клавишу Control (Mac), и «сохранить цель как»
Большие идеи
Горение (горение) — это химическая реакция, при которой топливо вступает в реакцию с окислителем, обычно с кислородом, обычно выделяя как тепло, так и свет.В отсутствие окислителя, например, в чистой двуокиси углерода, горение прекращается.
Газообразный кислород выделяется в результате химической реакции отбеливателя и перекиси водорода. (См. Вопросы безопасности ниже!) При смешивании кислоты (например, уксусной кислоты в уксусе) с бикарбонатом натрия (пищевой содой) выделяется газообразный диоксид углерода. Двуокись углерода более плотная, чем воздух, поэтому ее можно «переливать».
(См. Вопросы безопасности ниже!) При смешивании кислоты (например, уксусной кислоты в уксусе) с бикарбонатом натрия (пищевой содой) выделяется газообразный диоксид углерода. Двуокись углерода более плотная, чем воздух, поэтому ее можно «переливать».
Детали
Когда горит кусок дерева, молекулы дерева — в основном целлюлоза — распадаются на части и соединяются с кислородом в химической реакции, которая высвобождает энергию в виде тепла и света.Высвобождаемая энергия начиналась с энергии света, которая падала на растение по мере его роста; эта энергия улавливается в процессе фотосинтеза и сохраняется в связях между атомами в молекулах целлюлозы. Чтобы начать горение, нам часто приходится подавать внешнее тепло, например спичку или искру в зажигалке, чтобы реакция началась. Это тепло начинает испарять молекулы топлива и облегчает их реакцию с кислородом. Возникающее тепло поддерживает процесс до тех пор, пока есть кислород и топливо.Ниже приводится основное уравнение быстрого сгорания углеводорода, такого как древесина, бутан или бензин:
Углеводородное топливо + Кислород => Тепло + Свет + Двуокись углерода + Вода
Поскольку для протекания реакции требуется кислород, ее можно остановить, поместив горящий объект в среду без кислорода — или заменив кислород в окружающей среде на газ, который не будет окислять топливо, например двуокись углерода.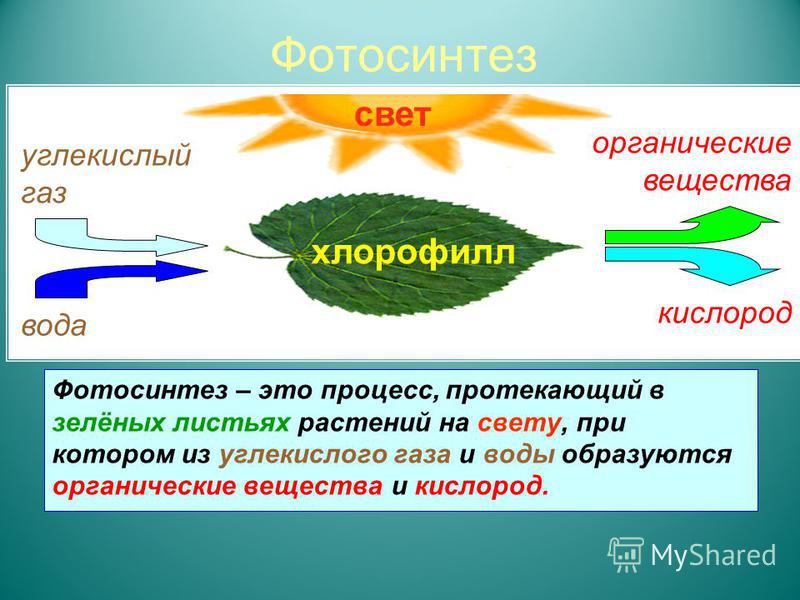 Так работают огнетушители C0 2 .На видео, когда горящая шпажка помещается в стакан с CO 2 , пламя гаснет. Поскольку он сразу же удаляется из газа, процесс горения не остановился полностью, и кончик шампура все еще светится, когда его вынимают; в присутствии достаточно высокой концентрации кислорода вертел снова воспламеняется. В этом случае остаточного тепла от раскаленного вертела достаточно для возобновления реакции быстрого горения, если вокруг достаточно кислорода для его реакции.Хотя светящийся шампур не загорается в воздухе, где содержится всего 20% кислорода, очень высокая концентрация кислорода во втором стакане делает свое дело.
Так работают огнетушители C0 2 .На видео, когда горящая шпажка помещается в стакан с CO 2 , пламя гаснет. Поскольку он сразу же удаляется из газа, процесс горения не остановился полностью, и кончик шампура все еще светится, когда его вынимают; в присутствии достаточно высокой концентрации кислорода вертел снова воспламеняется. В этом случае остаточного тепла от раскаленного вертела достаточно для возобновления реакции быстрого горения, если вокруг достаточно кислорода для его реакции.Хотя светящийся шампур не загорается в воздухе, где содержится всего 20% кислорода, очень высокая концентрация кислорода во втором стакане делает свое дело.
В этой демонстрации мы генерируем кислород по следующей реакции:
Отбеливатель + перекись водорода => соль + вода + кислород
или точнее
NaOCl + H 2 0 2 => NaCl + H 2 0 + O 2
В результате этой реакции образуется диоксид углерода:
Пищевая сода + уксус => Ацетат натрия + вода + диоксид углерода
или точнее
NaHCO 3 + CH 3 COOH => CH 3 COONa + H 2 O + CO 2
Двуокись углерода обычно составляет менее одного процента атмосферы (всего около. 038 процентов или около 380 частей на миллион в среднем в 2007 году). Двуокись углерода более плотная, чем окружающий воздух (больше массы в данном объеме или больше «вещества» на «пространство»), поэтому, когда мы выделяем газообразный углекислый газ в этой реакции, он не поднимается из стакана. Таким образом, можно «полить» ряд свечей газом и потушить их. Когда невидимая волна CO 2 катится по долине картона, она вытесняет весь кислород, прекращая горение воска в свечах и гасит их.
038 процентов или около 380 частей на миллион в среднем в 2007 году). Двуокись углерода более плотная, чем окружающий воздух (больше массы в данном объеме или больше «вещества» на «пространство»), поэтому, когда мы выделяем газообразный углекислый газ в этой реакции, он не поднимается из стакана. Таким образом, можно «полить» ряд свечей газом и потушить их. Когда невидимая волна CO 2 катится по долине картона, она вытесняет весь кислород, прекращая горение воска в свечах и гасит их.
Материалы и установка
- два стакана емкостью 1 л или банки для консервирования емкостью 1 литр
- пищевая сода
- уксус
- отбеливатель
- перекись водорода
- бамбуковые шпажки
- зажигалка
- 1 двух- или трехлитровая бутылка из-под газировки или двухлитровая колба
- 50 см пластиковой трубки 1/4 «или 1/2»
- малая воронка
- свечей на день рождения сгорело до половины длины
- плакат
- глина для лепки
Смешайте пищевую соду и уксус в одном стакане, а отбеливатель и перекись водорода — в другом.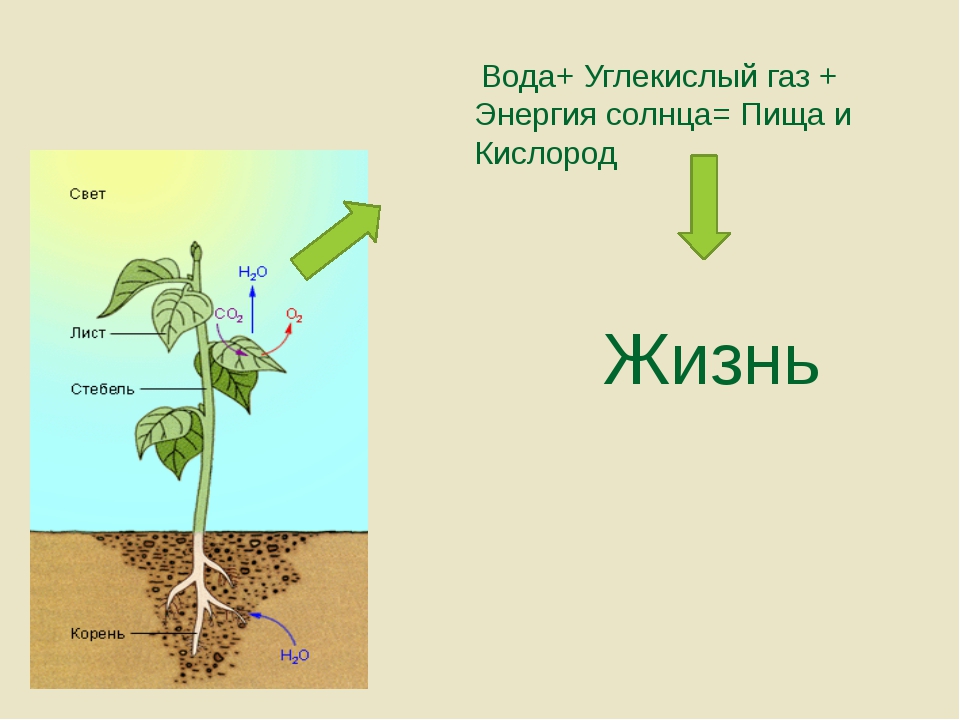 Потренируйтесь подбирать нужные количества, чтобы газа было достаточно, но мензурки не пузырились. Зажгите шампур и поместите его в газ, образовавшийся в результате реакции пищевой соды и уксуса; он погаснет. Быстро переместите шампур в другой стакан и удерживайте его в газе, образовавшемся в результате реакции отбеливателя и перекиси водорода; он снова загорится. Это можно повторить несколько раз.
Потренируйтесь подбирать нужные количества, чтобы газа было достаточно, но мензурки не пузырились. Зажгите шампур и поместите его в газ, образовавшийся в результате реакции пищевой соды и уксуса; он погаснет. Быстро переместите шампур в другой стакан и удерживайте его в газе, образовавшемся в результате реакции отбеливателя и перекиси водорода; он снова загорится. Это можно повторить несколько раз.
Чтобы произвести углекислый газ и поместить его в стакан, на дне которого нет жидкости, используйте установку, подобную той, что показана на видео.Обратите внимание, что вы можете использовать бутылку с содовой вместо стеклянной колбы. Насыпьте на дно колбы немного пищевой соды. Поместите воронку и трубку рядом друг с другом через верхнюю часть бутылки и, используя пластилин, создайте пробку, чтобы закрыть трубку и воронку. Трубка должна едва проходить сквозь глину, а не в область, где происходит реакция. (В противном случае в вашем стакане будет пузыриться жидкость с диоксидом углерода, чего вы делаете в этом аппарате, чтобы избежать этого. ) Поместите свободный конец трубки в емкость для сбора и налейте уксус через воронку в бутылку. Диоксид углерода, образующийся в результате реакции, будет вытеснен через трубку в емкость для сбора.
) Поместите свободный конец трубки в емкость для сбора и налейте уксус через воронку в бутылку. Диоксид углерода, образующийся в результате реакции, будет вытеснен через трубку в емкость для сбора.
Свечи на день рождения можно установить в ряд в «долине», сделанной из картона для плакатов, используя пластилин, чтобы прикрепить их к доске. Попросите вашего помощника держать эту долину под углом, а затем зажгите свечи. (Учтите, что демонстрация работает лучше всего, если свечи короткие, поэтому перед началом сожгите их до половины длины.Вылейте образовавшийся углекислый газ в долину и наблюдайте, как свечи гаснут по одной, пока плотный CO 2 скатывается вниз и заменяет кислород вокруг каждой свечи.
Проблемы безопасности
Никогда не смешивайте отбеливатель с аммиаком! В зависимости от смешанного количества будет образовано одно или несколько из нескольких различных токсичных и / или взрывоопасных соединений.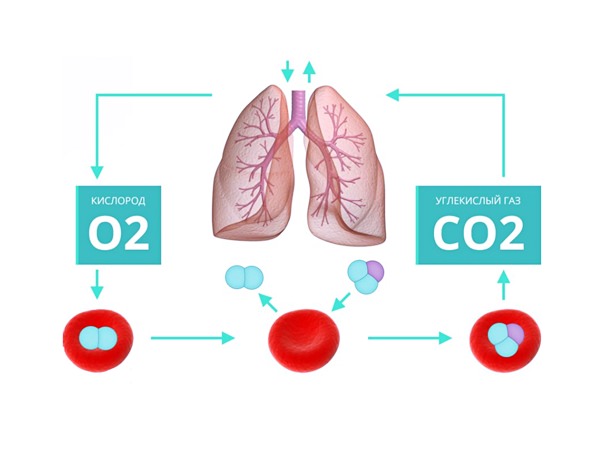
Каждый раз, когда вы работаете с огнем, обязательно имейте поблизости огнетушитель.
Реакционная способность: термодинамика
Реакционная способность: термодинамикаРеакционная способность в химии
Термодинамика
TD8. Закон Гесса
Иногда мы можем использовать имеющуюся информацию о энергетика реакций для предсказания энергетики новой реакции. Чтобы понять, как это сделать, мы рассмотрим относительно простую реакцию: горение углерод.
Когда мы сжигаем углерод, может произойти несколько вещей. Горение обычно приводит к объединению элементов в материале с кислород. Итак, мы просто говорим об объединении углерода с кислородом для получения новое соединение.
Есть две возможности. Либо реакция образует окись углерода или двуокись углерода.
Первая реакция:
2 С + О 2 → 2 CO
Эта реакция экзотермическая. Выпущено около 25
ккал на моль произведенного CO.
Выпущено около 25
ккал на моль произведенного CO.
Обратите внимание, что реакция была сбалансирована, чтобы отслеживать точное количество атомов, участвующих в транзакции. Потому что только один атом кислорода необходим, а молекулы кислорода имеют два атома кислорода, Молекула кислорода может фактически преобразовать два атома углерода в окись углерода.
Вторая реакция:
C + О 2 → CO 2
Эта реакция также экзотермическая.Он выпускает о 90 ккал на моль произведенного CO 2 .
Поскольку энергия выделяется или производится каждым реакции, мы можем рассматривать энергию как еще один продукт реакции. Мы просто перечислим его на стороне продукта уравнения с другими продуктами.
2 С + О 2 → 2 CO + 50 ккал / моль
и
C + О 2 → CO 2 + 90 ккал / моль
Есть третья реакция, связанная с этими двумя
реакции.Это горение окиси углерода.
2 CO + O 2 → 2 СО 2
Опять же, реакция экзотермическая, с выделением около 65 ккал на моль произведенного CO 2 . Он высвободит 130 ккал на реакция, как написано, потому что мы показываем производство двух молей СО 2 . Переписываем уравнение, чтобы включить произведенную энергию:
2 CO + O 2 → 2 CO 2 + 130 ккал / моль
А если бы мы проводили эту реакцию поэтапно? Что если мы сожгли углерод до окиси углерода, то взяли окись углерода и позволили ему прореагировать дальше, чтобы получить углекислый газ?
2 С + О 2 → 2 CO + 50 ккал / моль
2 CO + O 2 → 2 CO 2 + 130 ккал / моль
Представьте, что это пара алгебраических уравнений.Что произошло бы, если бы мы сложили их вместе?
2 С + О 2 = 2 CO + 50 ккал / моль
2 CO + O 2 = 2 CO 2 + 130 ккал / моль
Сумма: 2 C + 2 CO + 2 O 2 = 2 CO + 2 CO 2 + 180 ккал / моль
Обратите внимание, что CO появляется с обеих сторон и отменяется.
2 С + 2 О 2 = 2 CO 2 + 180 ккал / моль
Мы можем отбросить множитель 2:
К + О 2 = CO 2 + 90 ккал / моль
Таким образом, две реакции, одна за другой, в сумме дают в третьих.Кроме того, энергии этих двух реакций, вместе взятые, дать энергию третьего.
Этот результат является очень важным аспектом термодинамика. Энтальпия — это функция состояния. это означает, что это не так независимо от того, как выполняется реакция. Преобразуем ли мы углерод напрямую в углекислый газ или мы конвертируем его в окись углерода, затем продолжаем, e нервозность в целом такая же. Это потому, что энергия реакция является свойством только продуктов и реагентов.это независимо от того, как мы переходим от одного к другому.
Еще одно замечание по поводу приведенных выше реакций. В
энтальпии этих реакций при правильном измерении иногда
называется теплотой образования соединений. Теплота образования
относится к изменению энергии, когда соединения образуются из элементов
в стандартных условиях.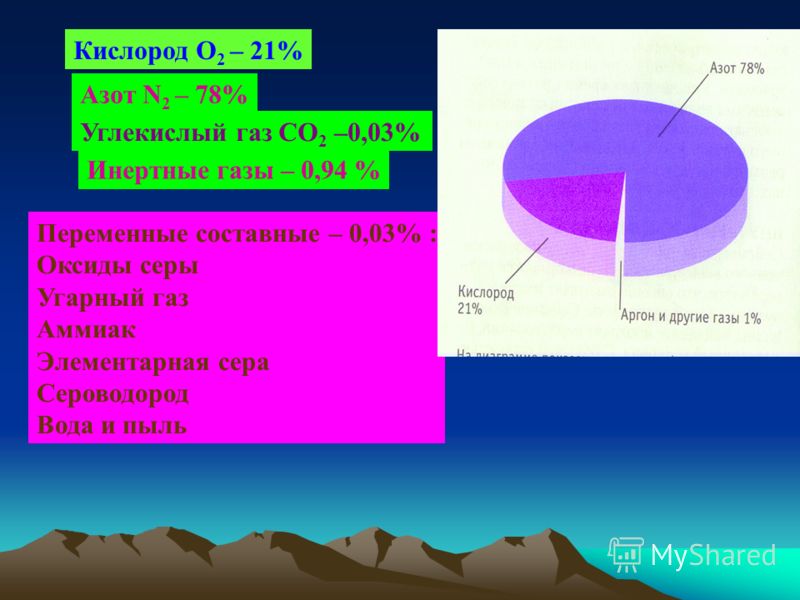 Мы не будем слишком углубляться в то, что
стандартные условия здесь. Однако, поскольку C является элементарной формой
углерода, а O 2 — это элементарная форма кислорода, мы бы свободно
Считайте перечисленные выше энергии теплотой образования.
Мы не будем слишком углубляться в то, что
стандартные условия здесь. Однако, поскольку C является элементарной формой
углерода, а O 2 — это элементарная форма кислорода, мы бы свободно
Считайте перечисленные выше энергии теплотой образования.
Проблема TD6c.1.
а) Если теплота образования хлорида калия, KCl, составляет -104 ккал / моль, а теплота образования хлорита калия KClO 2 , составляет -95 ккал / моль, тогда какова теплота реакции, когда хлорид калия реагирует с кислородом с образованием хлорита калия?
б) Если теплота образования оксида тантала (IV), TaO 2 , составляет -40 ккал / моль, а теплота образования тантала (V) оксида, Ta 2 O 5 , составляет -490 ккал / моль, тогда какова теплота реакция горения TaO 2 до Ta 2 O 5 ?
c) Если теплота образования окиси углерода CO, составляет -25 ккал / моль и теплота образования тетракарбонил никеля, Ni (CO) 4 , составляет -145 ккал / моль, то какова теплота реакции образования тетракарбонил никель из никеля и окиси углерода?
Этот сайт написан и поддерживается Крисом П. Шаллер, доктор философии, Колледж Святого Бенедикта / Сент-Джонс
Университет (при участии других авторов, как указано). Это свободно
доступны для использования в образовательных целях.
Шаллер, доктор философии, Колледж Святого Бенедикта / Сент-Джонс
Университет (при участии других авторов, как указано). Это свободно
доступны для использования в образовательных целях.
Структура и реакционная способность в органической, биологической и неорганической химии, , автор:
Крис Шаллер имеет лицензию на
Лицензия Creative Commons Attribution-NonCommercial 3.0 Unported.
Присылайте исправления на [email protected]
Этот материал основан на работе, поддержанной Национальным научным фондом. по гранту №1043566.
Любые мнения, выводы и заключения или рекомендации, выраженные в данном материалы принадлежат авторам и не обязательно отражают точку зрения Национальный научный фонд.Навигация:
Назад к термодинамике
Вернуться к веб-материалам о структуре и реакционной способности
Ручной детектор углекислого газа (CO2), окиси углерода (CO) и кислорода (O2)
GasLab Plus CM-505 — мультигазовый детектор, предназначенный для измерения диоксида углерода (CO2), оксида углерода (CO), кислорода (O2), относительной влажности и температуры в различных областях применения.
При долгосрочном хранении данных пользователь может измерять уровни окружающего газа по отображаемым данным и получать индикацию с помощью настроек визуальной и звуковой сигнализации.
Характеристики
- NDIR (CO2), EC (CO) и тушение флуоресценции кислородом (O2)
- Измеряет относительную влажность и температуру
- Большой ЖК-дисплей для удобного чтения
- Звуковой сигнал
- Регистрация данных с SD-картой 16 ГБ
- Несколько устройств, подключенных через интерфейс RS485
- Подсветка ЖК-дисплея для удобного чтения в темноте
- Литий-ионные аккумуляторные батареи
О КОДАХ БЕЗОПАСНОСТИ ПРИ ХРАНЕНИИ CO2
Это устройство НЕ будет соответствовать требованиям к контролю безопасности CO2, для которого требуется фиксированная / настенная, проводная сигнализация в соответствии с правилами NBIC, NFPA или IFC.Обратитесь к нашей странице продуктов безопасности CO2 для устройств, которые соответствуют вашим потребностям.
Позвоните нам по бесплатному телефону (877) 678-4259 или напишите нам по электронной почте, чтобы поговорить с нашим техническим отделом продаж о покупке подходящего устройства.
Приложения
- Продукты питания и напитки
- Пивоварение
- Сельское хозяйство
- Домашняя птица
- Криогеника
- Научный
- Медицинский
- Безопасность и многие другие.
Технические характеристики
- Меры: CO2, CO, O2, PM2.5, PM10, температура, относительная влажность%
- Метод измерения: NDIR, EC и гашение флуоресценции кислородом
- Диапазон измерения CO2: 0 ~ 9999 ppm
- CO Диапазон измерения: 0 ~ 1000 ppm
- O2 Диапазон измерения: 0 ~ 25%
- Температура: 0 ~ 50 ° C
- PM2,5,10 Диапазон измерений: 999 мкг / м3 (в зависимости от того, что больше)
- Точность CO2: ± 50 ppm, ± 5% от показания (0 ~ 5000 ppm)
- CO Точность: ± 5% ~ ± 10%
- Точность O2: <2% полной шкалы / 0,1 мбар
- PM2.
 5,10 Точность: ± 15% или ± 15 мкг / м³
5,10 Точность: ± 15% или ± 15 мкг / м³ - RH — 0-100%
- Источник питания: 3 аккумуляторные батареи — литий-ионный 18650 3,7 В
- Срок службы батареи: проверено до 24+ часов
- Вес: 305 г (без батарей)
- Срок службы: NDIR: 15 лет, EC: 2 года, гашение флуоресценции кислородом: 5 лет
Включает
- Детектор газа CO2, CO, O2, PM2,5, PM10
- Руководство
- USB-кабель для зарядки SD-карта
- (16 г), возможность регистрации данных
- Три (3) литий-ионных аккумуляторных батареи
Гарантия
- 1 год — см. Условия использования CO2Meter.
Опции программного обеспечения
Это устройство имеет журналы данных, которые хранятся на карте памяти micro SD. Программное обеспечение GasLab® несовместимо с этим устройством.
Бесплатное простое в использовании программное обеспечение GasLab®
В этом устройстве используется программное обеспечение GasLab® для настройки, калибровки, регистрации данных и анализа данных в реальном времени. GasLab® позволяет легко экспортировать данные в файл CSV, который можно импортировать в любое стандартное программное обеспечение или электронную таблицу. GasLab® работает под управлением Windows XP или более поздней версии и может использоваться бесплатно с нашими продуктами.
GasLab® позволяет легко экспортировать данные в файл CSV, который можно импортировать в любое стандартное программное обеспечение или электронную таблицу. GasLab® работает под управлением Windows XP или более поздней версии и может использоваться бесплатно с нашими продуктами.
Системные требования для регистрации данных или изменения значений по умолчанию
- Windows XP SP2 или новее
- Библиотеки времени выполнения Microsoft .Net 3.5
Окись углерода Vs. Двуокись углерода: давайте сравним
В чем разница между оксидом углерода и диоксидом углерода? Если вы их перепутаете, вы не одиноки. Вы, наверное, знаете, что это два разных газа, но какой из них хороший, а какой плохой? Правильно ли вообще их так классифицировать? Прежде чем разбираться в том, как и где оксид углерода (CO) и диоксид углерода (CO2) влияют на людей и окружающую среду и как их проводить, давайте разберемся, откуда они берутся.
Оба газа представляют собой комбинацию углерода и кислорода, поэтому их названия похожи. Но эти газы образуются в результате различных химических реакций.
Откуда берется углекислый газ?
Наугад
Из обнаружения газа
Нужны дополнительные указания? Ознакомьтесь с технологией
, которая упрощает обнаружение газа.
Загрузить информационный документ
Двуокись углерода является результатом полного сгорания. Полное сгорание — это химическая реакция, в которой углеводород реагирует с кислородом с образованием диоксида углерода и воды.Полное сгорание часто (но не всегда) связано с пламенем. Когда вы наблюдаете за горением свечи, вы наблюдаете полное сгорание: воск свечи — это углеводород, который вступает в реакцию с кислородом воздуха и теплом зажженного фитиля. Двуокись углерода выделяется в воздух в виде газа без цвета и запаха. Это в значительной степени нереактивный газ, и после выпуска он быстро смешивается с атмосферой.
Двуокись углерода также производится в промышленных процессах. Промышленные предприятия, производящие водород или аммиак из природного газа, угля или из крупномасштабных операций ферментации, являются одними из крупнейших коммерческих производителей диоксида углерода.Двуокись углерода находит множество применений в пищевой промышленности и производстве напитков, включая газированные напитки.
Откуда берется окись углерода?
Окись углерода, с другой стороны, является результатом неполного сгорания. Неполное сгорание происходит, когда поступление воздуха ограничено, поэтому к углероду добавляется только половина кислорода, образуя монооксид углерода (CO = один атом кислорода, CO2 = два атома кислорода).
В отличие от двуокиси углерода, окись углерода не встречается в атмосфере в естественных условиях.Он создается в результате неполного сгорания угля, природного газа и нефти. Низкий уровень кислорода и низкие температуры приводят к образованию оксида углерода в смеси сгорания.
Опасный уровень окиси углерода может быть произведен любым устройством сжигания топлива, включая газовые печи, газовые плиты, газовые осушители, газовые водонагреватели, камины и автомобили. Это газ без цвета и запаха, который невозможно идентифицировать без детекторов газа.
В промышленных условиях двигатель внутреннего сгорания является основным источником окиси углерода.Многие печи и духовки производят большое количество газа, особенно когда они не обслуживаются должным образом. Водители грузовиков, операторы вилочных погрузчиков или люди, работающие рядом с этим типом оборудования, подвергаются более высокому риску воздействия. Рабочие рядом или в закрытых помещениях или замкнутых пространствах, таких как люки, гаражи, туннели, погрузочные платформы, склады, мастерские по ремонту автомобилей и машины для сращивания, также подвергаются риску.
Хотя монооксид углерода обычно является нежелательным побочным продуктом, упакованный монооксид углерода используется в различных отраслях промышленности, включая производство металлов, химическое производство, фармацевтику, электронные и полупроводниковые приложения, а также для восстановления руд при производстве карбонилов металлов.
Риски для здоровья, связанные с оксидом углерода и диоксидом углерода
ДЕТЕКТОРЫ УГЛЕРОДА
Поговорите с экспертом
Хотя отравление углекислым газом случается редко, его высокая концентрация в замкнутом пространстве может быть токсичной. Избыток углекислого газа использует пространство в воздухе вместо кислорода, создавая среду для удушья. Симптомы легкого отравления углекислым газом включают головные боли и головокружение при концентрациях менее 30 000 ppm. При 80 000 ppm CO2 может быть опасным для жизни.В качестве справки OSHA (Управление по безопасности и гигиене труда) установило допустимый предел воздействия CO2 (PEL) на уровне 5000 ppm в течение восьмичасового периода и 30 000 ppm в течение 10-минутного периода.
Окись углерода — гораздо более опасный газ. Окись углерода, также называемая «тихим убийцей», представляет собой газ без цвета, запаха, вкуса и раздражения, поэтому ранние признаки отравления трудно обнаружить. По оценкам Центров по контролю и профилактике заболеваний, более 50 000 человек в США.С. госпитализируются с симптомами отравления угарным газом, при этом ежегодно более 430 человек умирают от газа. [3] Окись углерода настолько опасна, потому что она связывается с частями вашей крови, которые переносят молекулы кислорода, поэтому он химически блокирует ваше тело и органы от получения необходимого кислорода. Текущий допустимый предел воздействия (PEL) OSHA для окиси углерода составляет 50 ppm, усредненных за восемь часов, что намного ниже, чем PEL для двуокиси углерода. Уровень воздействия, который считается непосредственно опасным для жизни и здоровья (IDLH), составляет 1500 ppm.
По оценкам Центров по контролю и профилактике заболеваний, более 50 000 человек в США.С. госпитализируются с симптомами отравления угарным газом, при этом ежегодно более 430 человек умирают от газа. [3] Окись углерода настолько опасна, потому что она связывается с частями вашей крови, которые переносят молекулы кислорода, поэтому он химически блокирует ваше тело и органы от получения необходимого кислорода. Текущий допустимый предел воздействия (PEL) OSHA для окиси углерода составляет 50 ppm, усредненных за восемь часов, что намного ниже, чем PEL для двуокиси углерода. Уровень воздействия, который считается непосредственно опасным для жизни и здоровья (IDLH), составляет 1500 ppm.
Использование газоанализаторов для измерения содержания окиси углерода и двуокиси углерода
Когда дело доходит до выбора промышленного газового детектора для рабочего места, одногазовый детектор угарного газа не измеряет уровни углекислого газа, и не работает наоборот.


 5,10 Точность: ± 15% или ± 15 мкг / м³
5,10 Точность: ± 15% или ± 15 мкг / м³