Как определить металл по плотности
Во всех сферах человеческой деятельности применяются изделия из металлов. Металлы в научном смысле представляют собой простые вещества, обладающие специфическими свойствами (металлическим блеском, ковкостью, высокой электропроводностью). В быту и на производстве часто используют их сплавы с другими элементами. Эти затвердевшие расплавы также обычно называют металлами.
Определение и использование плотности
Как известно, чтобы найти плотность вещества, его массу делят на объем. Плотность является физико-химической характеристикой вещества. Она постоянна. Материалы для промышленного производства должны соответствовать этому показателю. Для её обозначения принято использовать греческую букву ρ.
Плотность железа равна 7874 кг/м³, никеля — 8910 кг/м³, хрома — 7190 кг/м³, вольфрама — 19250 кг/м³. Конечно, это относится к твёрдым сплавам. В расплавленном состоянии веществам присущи другие характеристики.
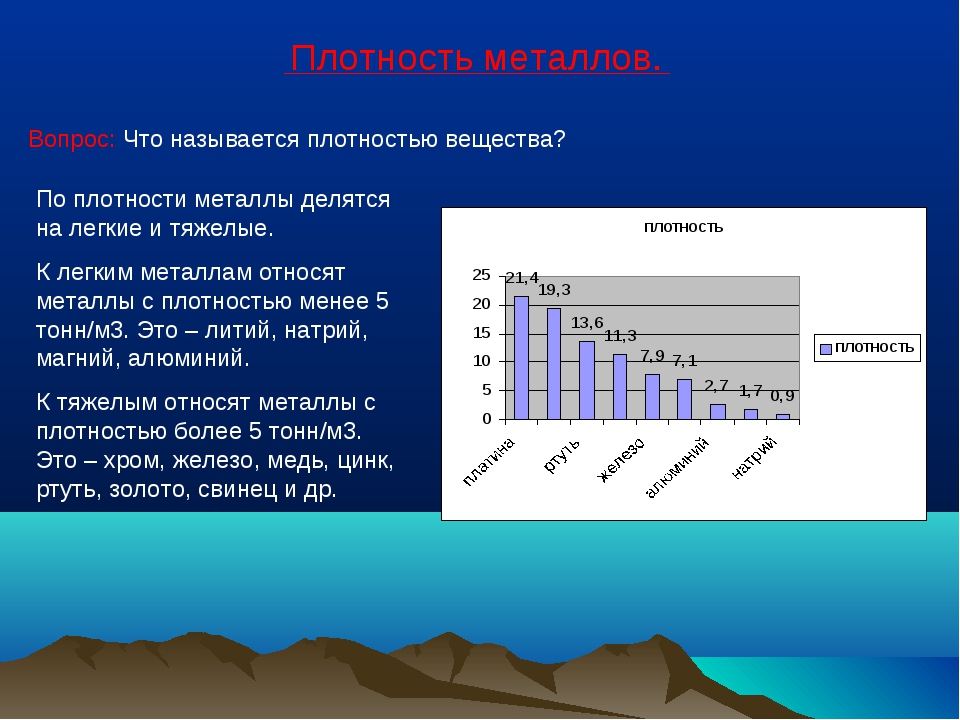
В природе лишь некоторые металлы присутствуют в большом количестве.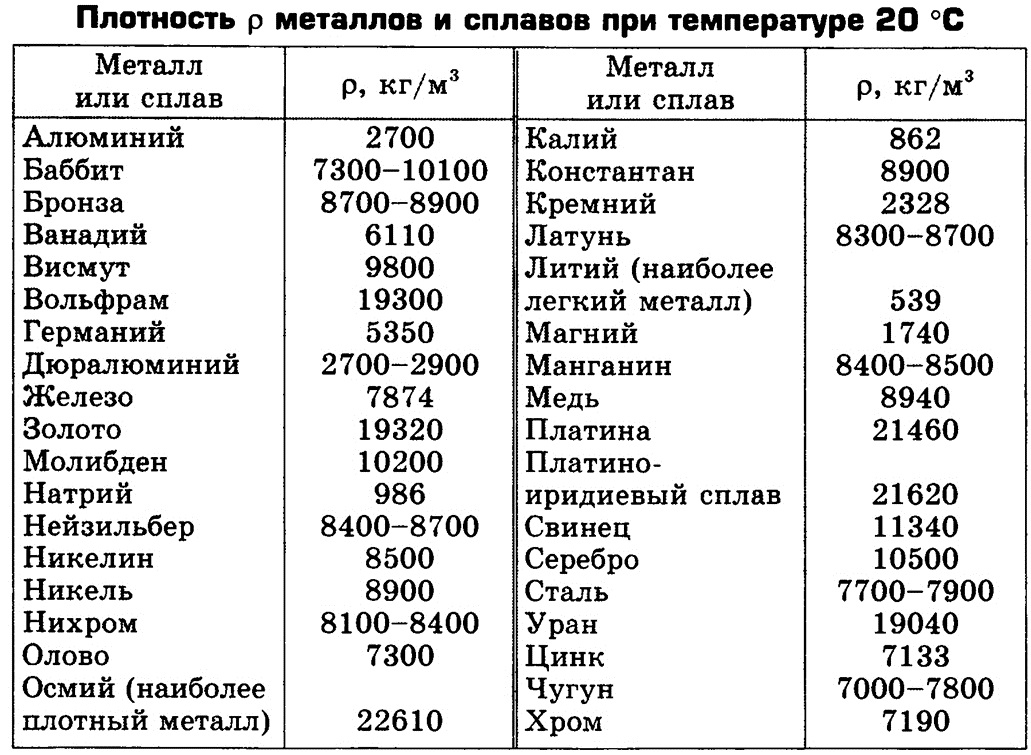
Железо и его сплавы
Чёрными металлами принято называть стали и чугуны разных марок. Сплав железа и углерода считается сталью, если железа не менее 45%, а содержание углерода 0,1%—2,14%. Чугуны, соответственно, углерода содержат больше.
Для получения необходимых свойств сталям и сплавам их легируют (присаживают при переплаве легирующие добавки). Таким образом плавят заданные марки. Все марки металла строго соответствуют определённым техническим условиям. Свойства каждой марки регламентированы государственными стандартами.
В зависимости от состава плотность стали варьируется в диапазоне 7,6—8,8 (г/см³) в СГС или 7600—8800 (кг/м³) в СИ (это видно из таблицы 1).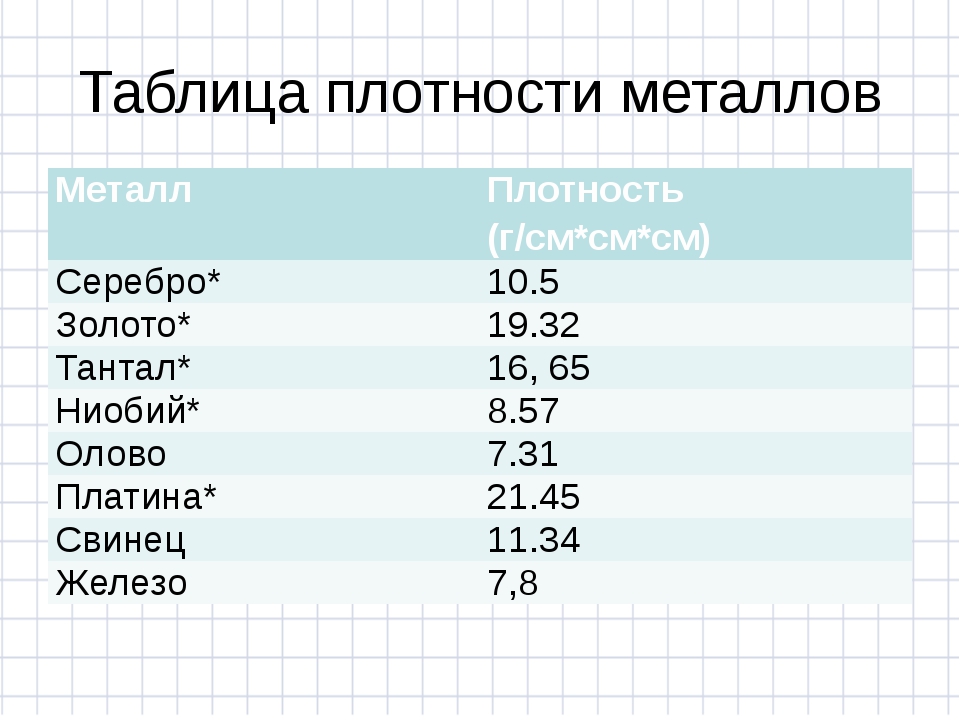 Конечно, сталь имеет сложную структуру, это не смесь различных веществ. Однако присутствие этих веществ и их соединений изменяют свойства, в частности, плотность. Поэтому самыми большими плотностями обладают быстрорежущие стали с высоким содержанием вольфрама.
Конечно, сталь имеет сложную структуру, это не смесь различных веществ. Однако присутствие этих веществ и их соединений изменяют свойства, в частности, плотность. Поэтому самыми большими плотностями обладают быстрорежущие стали с высоким содержанием вольфрама.
Цветные металлы и их сплавы
Изделия из бронзы, латуни, меди, алюминия широко применяются на производстве:
- Обычно бронзы это сплавы меди с оловом, алюминием, свинцом и бериллием. Однако в бронзовом веке, когда удельный вес бронзы в общей массе металлических изделий составлял почти 100%, это были сплавы медь — мышьяк.
- Сплавы на основе цинка — латуни. В латуни может присутствовать олово, но его количество меньше, чем цинка. Чтобы получить сыпучую стружку, иногда добавляют свинец. Кроме ювелирных сплавов латуни и бронзы, они нужны для деталей машин и морских судов, скобяных изделий, пружин. Некоторые сорта применяют в авиации и ракетостроении.

- Дюралюминий (дюраль) — сплав алюминия с медью (меди 4,4%) — это высокопрочный сплав. Главным образом применяется в авиации.
- Титан по прочности превосходит многие марки стали. Одновременно он вдвое легче. Эти качества сделали его незаменимым в большинстве отраслей промышленности. А также он широко применяется в медицине (протезировании). Удельный вес титана в производстве летательных аппаратов достигает 70% от всего выплавляемого в мире. Около 15% титана идёт для химического машиностроения.
- Серебро и золото — первые металлы, с которыми познакомился человек. За всю историю существования человечества эти металлы, по большей части, шли на ювелирные изделия. И в настоящее время тенденция сохраняется.
- Вольфрам из-за высокой тугоплавкости незаменим в приборостроении. Большая плотность позволяет применять его, как защиту от радиации.
- Никель и хром образуют нихром — жаропрочный пластичный сплав, очень долговечный и надёжный.
youtube.com/embed/oKUBkfjVH-4″/>
Различные марки сталей и чугунов, бронз и других металлов имеют разный химический состав и разную плотность. Плотности всех востребованных материалов измерены и систематизированы. Таблицы, содержащие эти данные доступны пользователям. С их помощью можно легко найти массу изделия заданной формы.
Определение массы изделия
Все современные справочные материалы, ГОСТ и технические условия предприятий скорректированы в соответствии с международной классификацией.
Пользуясь справочными таблицами плотностей различных материалов, легко определить их массу. Это особенно актуально, когда предметы тяжёлые или отсутствуют соответствующие весы. Для этого требуется знать их геометрические параметры. Чаще всего узнать требуется массу предмета в форме цилиндра, трубы или параллелепипеда:
- Металлические прутки имеют форму цилиндра. Зная диаметр и длину, легко узнать массу.

- Массу трубы получаем аналогично. При нахождении площади берём разницу между внешним и внутренним диаметром сечения.
- Чтобы определить массу листа, блюма, сляба или прутка прямоугольного сечения, определяем объём, перемножая длину, высоту и толщину. Умножаем на плотность из справочника.
При таких вычислениях всегда допускается маленькая погрешность, ведь формы не идеальны. На практике ей можно пренебречь. Производители металлоизделий разработали специальные калькуляторы вычисления массы для пользователей. Достаточно ввести уникальные размеры в соответствующие окна и получить результат.
Что такое удельный вес
Удельным весом называют плотность, умноженную на ускорение свободного падения (силу тяжести) или отношение веса тела к его объёму. Путать его с плотностью недопустимо. Однако часто это происходит из-за смешения понятий массы и веса. Вес тела, а следовательно и удельный вес, изменяется в зависимости от силы тяжести. Он не является постоянной величиной. В зависимости от места, где находится предмет, он имеет разные значения. Эта физическая величина будет разной даже в разных точках Земли. Ускорение свободного падения на экваторе больше, чем на полюсах. Масса и плотность постоянны.
Путать его с плотностью недопустимо. Однако часто это происходит из-за смешения понятий массы и веса. Вес тела, а следовательно и удельный вес, изменяется в зависимости от силы тяжести. Он не является постоянной величиной. В зависимости от места, где находится предмет, он имеет разные значения. Эта физическая величина будет разной даже в разных точках Земли. Ускорение свободного падения на экваторе больше, чем на полюсах. Масса и плотность постоянны.
К примеру, можно вычислить удельный вес серебра. На Земле эта величина будет составлять 10500 кг/м³ (плотность чистого металла). Умножив на 9,81м/с 2 (сила тяжести), можно получить 103005 Н/м³. А на Луне 10500 кг/м³ умножается на 1,62м/с 2 (сила тяжести на Луне). Результат уже другой — 17,01Н/м³. В кабине корабля, вращающегося вокруг Земли — невесомость, ускорение равно нулю. Следовательно, и вес любого материала здесь ноль.
Все значения будут разными. Самое большое значение будет в первом случае, потому что на Земле ускорение свободного падения имеет самое большое значение. В невесомости вещь не весит ничего. Плотность одного и того же материала в любом месте будет одинаковой. Она является константой.
В невесомости вещь не весит ничего. Плотность одного и того же материала в любом месте будет одинаковой. Она является константой.
Для того, чтобы составить таблицы удельного веса металлов на различных планетах (или в других условиях), необходимо знать ускорение свободного падения и плотность.
Перевозки изделий из металлов
В системе грузоперевозок задействовано такое понятие, как «объёмный вес». Если масса предмета в одном кубическом метре 167 кг, то такой вес считается физическим, а если меньше — объёмным. Например, масса куба стали углеродистой — 7750 кг. Другими словами, объёмный вес стали 7750 кг. Эти расчёты нужны, чтобы определить, какой объем займёт перевозимый груз.
Однако в зависимости от того, какие металлические изделия перевозятся, объем будет меняться. Предположим, что есть несколько различных метизов одной и той же марки стали. По идее, они обладают одинаковой плотностью. Однако слитки, крупносортные изделия и бунты проволоки обладают различным объёмом, а следовательно, при их перевозке займут больше или меньше места на транспорте. Таким образом, они обладают разным объёмным весом. При любых условиях кубометр стали больше 167 кг, следовательно, его не назовёшь объёмным.
Однако слитки, крупносортные изделия и бунты проволоки обладают различным объёмом, а следовательно, при их перевозке займут больше или меньше места на транспорте. Таким образом, они обладают разным объёмным весом. При любых условиях кубометр стали больше 167 кг, следовательно, его не назовёшь объёмным.
Предлагается единый метод определения плотности сталей, из которых изготовлены детали и узлы теплоэнергетического оборудования.
Методика относится к элементам, которые эксплуатируются при рабочих напряжениях и повышенных температурах:
для углеродистой стали tраб–больше или равна 400°С;
для аустенитной, мартенситной и мартенсито-ферритной стали tраббольше или равна 525°С.
Методика определения плотности стали в исходном состоянии и после эксплуатации позволяет выявить динамику ее изменения на разных этапах работы теплоэнергетического оборудования. Плотность стали на каждом этапе эксплуатации оборудования определяется структурным и фазовым составом материала, а также уровнем его поврежденности.
Плотность стали на каждом этапе эксплуатации оборудования определяется структурным и фазовым составом материала, а также уровнем его поврежденности.
9.1. Сведения о методе
9.1.1. Прецизионный метод определения плотности основан на гидростатическом взвешивании и заключается в последовательном взвешивании образца на воздухе и в жидкости, плотности которых известны. Метод позволяет определять плотность материала без фиксации его объема, что дает возможность оценить плотность образцов любой геометрической формы с заданной относительной погрешностью, не превышающей ±0,01%.
9.1.2. Схема установки для прецизионного определения плотности металлов представлена на рис. 6.
9.1.3. Установка включает в себя:
аналитические весы с погрешностью не более ±10 -7 кг;
ультратермостат, поддерживающий температуру рабочей среды с точностью не ниже ±0,05°С.
Рис. 6. Установка для прецизионного измерения плотности:
1 – аналитические весы; 2 – система подвесок образцов; 3 – сосуды с рабочей жидкостью;
4 – термометр для контроля температуры рабочей жидкости;
5 – вытяжной шкаф; 6 – ультратермостат
9. 1.4. Рабочая среда, в которой производится взвешивание, должна обладать стабильной во времени плотностью; в течение 6 мес. плотность не должна изменяться более чем на ±0,1 кг/м 3 . При большем изменении плотности жидкость должна быть заменена.
1.4. Рабочая среда, в которой производится взвешивание, должна обладать стабильной во времени плотностью; в течение 6 мес. плотность не должна изменяться более чем на ±0,1 кг/м 3 . При большем изменении плотности жидкость должна быть заменена.
9.1.5. Контроль плотности рабочей среды следует проводить не реже одного раза в месяц. В температурном интервале производства измерений должен соблюдаться линейный закон зависимости плотности от температуры.
9.1.6. Температура кристаллизации рабочей жидкости должна быть меньше 10 °С. Температура кипения рабочей жидкости должна значительно превышать температуру окружающего пространства при проведении взвешивания.
9.1.7. Рабочая жидкость должна обладать вязкостью менее 0,5 Па/с.
9.1.8. Система подвесок, состоящая из капроновых нитей, крепится к нижней поверхности чашек весов. На концах капроновых нитей закрепляются корзинки из платиновой проволоки. Масса подвесок правой и левой чашек весов не должна отличаться более чем на 10 -5 кг. Корзинки, погруженные в сосуды с рабочей жидкостью, не должны касаться дна сосудов, их стенок или выступать над поверхностью жидкости.
Корзинки, погруженные в сосуды с рабочей жидкостью, не должны касаться дна сосудов, их стенок или выступать над поверхностью жидкости.
9.1.9. Сосуды с рабочей жидкостью представляют собой стеклянные цилиндры с двойными стенками, между которыми циркулирует вода.
9.1.10. Постоянство температуры жидкости в ультратермостате обеспечивается с точностью ±0,05 °С. Ультратермостат поддерживает температуру рабочей жидкости в сосудах за счет циркуляции воды между стенками цилиндров.
9.1.11. Контроль температуры воды и рабочей жидкости осуществляется термометрами с точностью ±0,05 ° С.
Химическая лаборатория ИЦ «Композит-Тест» проводит определение плотности металлических образцов и других твердых непористых веществ.
Плотность является одной из важнейших физических величин, характеризующих свойства вещества.
Плотностью вещества называется отношение массы тела к его объему и выражается в г/см 3 . Плотность является постоянной величиной для каждого химически однородного вещества при данной температуре.
Для определения плотности металлических, пластмассовых образцов нами применяется гидростатический метод, который обеспечивает наиболее точное измерение плотности.
Гидростатический метод определения плотности в твердых образцах описан в:
- ГОСТ 20018-74 «Сплавы твердые спеченые»;
- ГОСТ 25281-82 «Металлургия порошковая. Метод определения плотности формовок»;
- ГОСТ 15139-69 «Пластмассы. Методы определения плотности (объемной массы)» ;
- ТУ 48-19-76-90 «Вольфрам металлический для металлургических целей. Технические условия»
Для определения плотности применяются жидкости, хорошо смачивающие материалы, которые не должны растворять и пропитывать образец или вступать с ним в реакцию, а также не должны улетучиваться во время определения (например, этиловый спирт, ацетон и другие).
В качестве жидкости для взвешивания мы применяем дистиллированную воду.
Гидростатический метод определения плотности материала состоит во взвешивании образца в воздухе, а затем в воде и вычислении его плотности.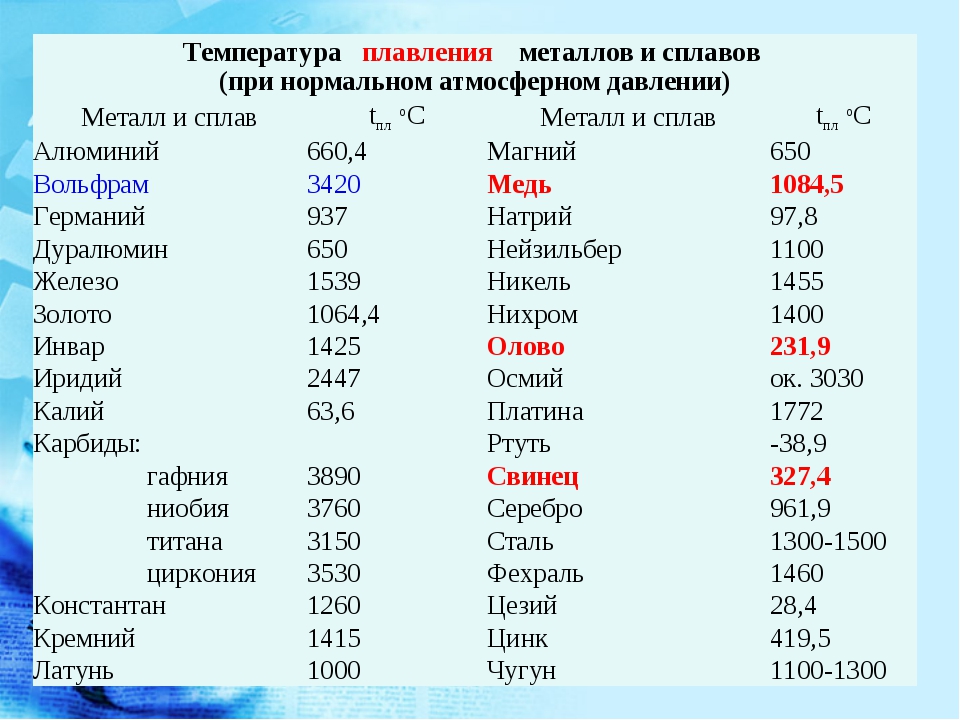 Метод предназначен для определения плотности формованных изделий (стержни, бруски, трубки, твердые спеченые сплавы, штабики и пластины металлического вольфрама и молибдена).
Метод предназначен для определения плотности формованных изделий (стержни, бруски, трубки, твердые спеченые сплавы, штабики и пластины металлического вольфрама и молибдена).
При взвешивании температура испытуемого образца, жидкости и окружающего воздуха должна быть одинаковой. Температуру дистиллированной воды, в которую помещаем образец, поддерживаем постоянной, или, если это невозможно, измеряем температуру до и после каждого взвешивания, принимая в расчет среднее из полученных значений.
Значения плотности дистиллированной воды в зависимости от температуры воздуха приводятся в нормативных документах на испытуемый материал.
Имеются и другие методы определения плотности веществ, которые приводятся в ГОСТ 15139-69 «Пластмассы. Методы определения плотности (объемной массы)».
Пикнометрический метод заключается в сравнении масс одинаковых объемов испытуемого вещества и жидкости известной плотности. Жидкость должна смачивать испытуемое вещество и стенки пикнометра, а ее плотность не должна быть выше плотности исследуемого вещества.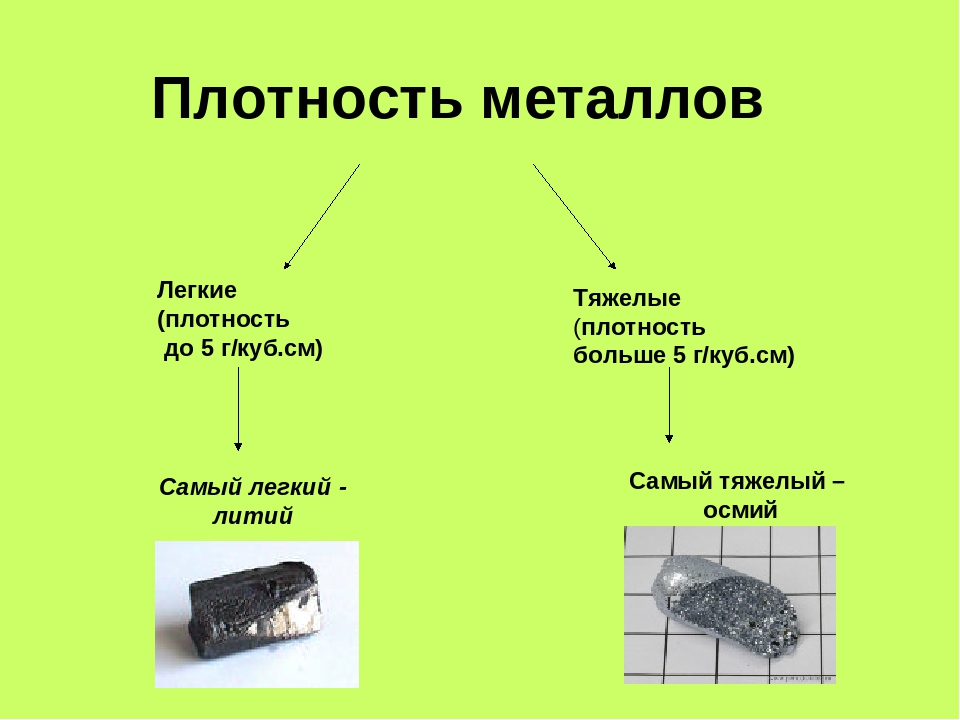 В качестве такой жидкости применяют бензин, толуол, ксилол и другие органические жидкости. Метод применяется для определения плотности формованных изделий, порошков, гранул, хлопьев.
В качестве такой жидкости применяют бензин, толуол, ксилол и другие органические жидкости. Метод применяется для определения плотности формованных изделий, порошков, гранул, хлопьев.
Метод обмера и взвешивания заключается в определении плотности вещества по отношению массы к его объему, определяемым непосредственно взвешиванием и обмером.
Допускается измерять объем другими методами, например по вытесненному объему жидкости для образцов неправильной или трудно измеряемой формы. Метод применяется для определения плотности изделий, полуфабрикатов (стержни, бруски, трубы, отливки).
Заявку на выполнение работ по определению плотности различных металлов и сплавов можно сделать по телефону (495) 513-20-71
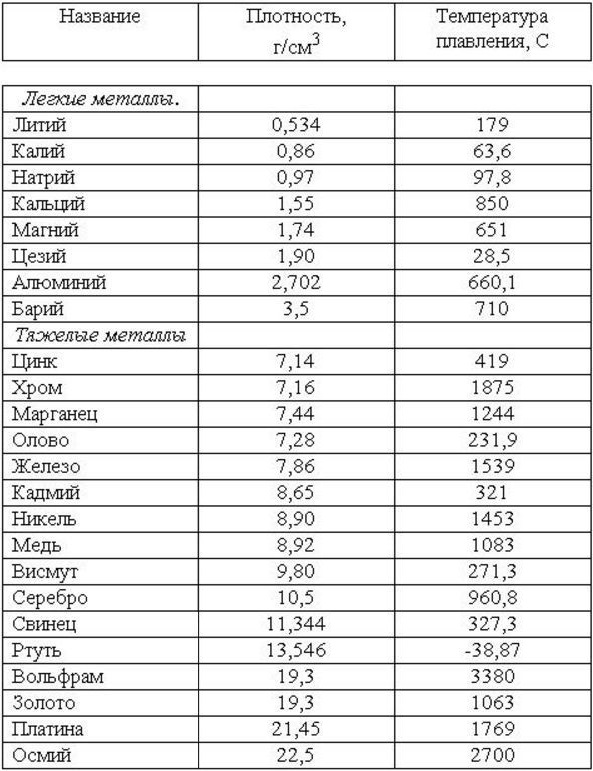
Таблица плотности металлов химия — Морской флот
/
/
Таблица плотности металлов химия
Главной характеристикой влияющей на вес металла, является его плотность.
Что означает плотность металла?
Под плотностью металла, подразумевается его вес на единицу занимаемого объёма.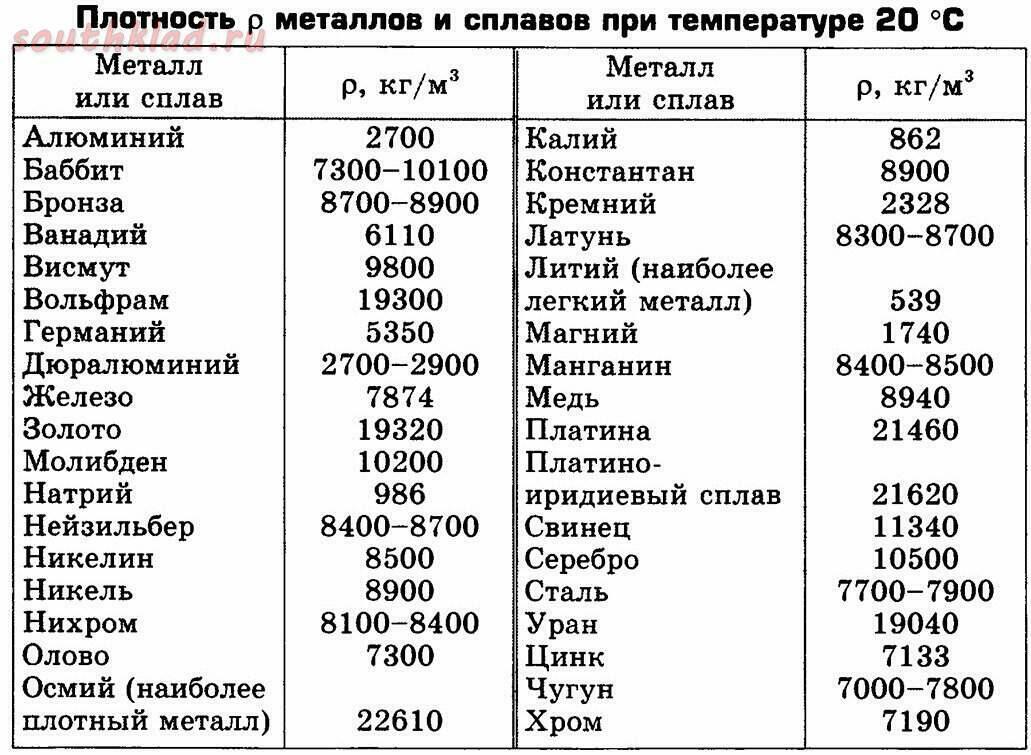 Часто объём измеряют в метрах кубических и сантиметрах в кубе. Чем же обусловлены такие большие, по земным меркам, вес и плотность? Плотность металла и его вес, зависит от того, насколько мал радиус атома и велик при том его вес.
Часто объём измеряют в метрах кубических и сантиметрах в кубе. Чем же обусловлены такие большие, по земным меркам, вес и плотность? Плотность металла и его вес, зависит от того, насколько мал радиус атома и велик при том его вес.
Плотность металлов таблица
| Метал | г/см 3 | кг/м 3 | Метал | г/см 3 | кг/м 3 |
| Литий | 0,534 | 534 | Самарий | 7,536 | 7536 |
| Калий | 0,87 | 870 | Железо | 7,87 | 7874 |
| Натрий | 0,968 | 9680 | Гадолиний | 7,895 | 7895 |
| Рубидий | 1,53 | 1530 | Тербий | 8,272 | 8272 |
| Кальций | 1,54 | 1540 | Диспрозий | 8,536 | 8536 |
| Магний | 1,74 | 1740 | Ниобий | 8,57 | 8570 |
| Бериллий | 1,845 | 1845 | Кадмий | 8,65 | 8650 |
| Цезий | 1,873 | 1873 | Гольмий | 8,803 | 8803 |
| Кремний | 2,33 | 2330 | Никель | 8,9 | 8900 |
| Бор | 2,34 | 2340 | Кобальт | 8,9 | 8900 |
| Стронций | 2,6 | 2600 | Медь | 8,94 | 8940 |
| Алюминий | 2,7 | 2700 | Эрбий | 9,051 | 9051 |
| Скандий | 2,99 | 2990 | Тулий | 9,332 | 9332 |
| Барий | 3,5 | 3500 | Висмут | 9,8 | 9800 |
| Иттрий | 4,472 | 4472 | Лютеций | 9,842 | 9842 |
| Титан | 4,54 | 4540 | Молибден | 10,22 | 10220 |
| Селен | 4,79 | 4790 | Серебро | 10,49 | 10490 |
| Европий | 5,259 | 5259 | Свинец | 11,34 | 11340 |
| Германий | 5,32 | 5320 | Торий | 11,66 | 11660 |
| Мышьяк | 5,727 | 5727 | Таллий | 11,85 | 11850 |
| Галлий | 5,907 | 5907 | Палладий | 12,02 | 12020 |
| Ванадий | 6,11 | 6110 | Рутений | 12,4 | 12400 |
| Лантан | 6,174 | 6174 | Родий | 12. 44 44 | 12440 |
| Теллур | 6,25 | 6250 | Гафний | 13,29 | 13290 |
| Цирконий | 6,45 | 6450 | Ртуть | 13,55 | 13550 |
| Церий | 6,66 | 6660 | Тантал | 16,6 | 16600 |
| Сурьма | 6,68 | 6680 | Уран | 19,07 | 19070 |
| Празеодим | 6,782 | 6782 | Вольфрам | 19,3 | 19300 |
| Иттербий | 6,977 |
Металлы Плотность — Определение — Энциклопедия по машиностроению XXL
Напряжения, вызывающие смещение атомов в новые положения равновесия, могут уравновешиваться только силами межатомных взаимодействий. Поэтому под нагрузкой при пластическом деформировании деформация состоит из упругой и пластической составляющих, причем упругая составляющая исчезает при разгрузке (при снятии деформирующих сил), а пластическая составляющая приводит к остаточному изменению формы и размеров тела. В новые положения равновесия атомы могут переходить в результате смещения в определенных параллельных плоскостях, без существенного изменения расстояний между этими плоскостями. При этом атомы не выходят из зоны силового взаимодействия и деформация происходит без нарушения сплошности металла, плотность которого практически
[c.53]
В новые положения равновесия атомы могут переходить в результате смещения в определенных параллельных плоскостях, без существенного изменения расстояний между этими плоскостями. При этом атомы не выходят из зоны силового взаимодействия и деформация происходит без нарушения сплошности металла, плотность которого практически
[c.53] Результаты экспериментов [44], проведенных на слитках диаметра 30 и высотой 70 мм и закристаллизованных под поршневым давлением, показали, что при увеличении давления плотность дислокаций, определенная методом ямок травления, возрастает (рис. 12). При этом наибольшее изменение плотности дислокаций наблюдается при приложении давления до 200 МН/м . В этом же интервале давлений наиболее существенно измельчается структура сплавов и металлов, а также происходит изменение и других структурных характеристик [c.30]
Даже хорошо отожженные металлы содержат большую плотность дислокаций, оцениваемую приблизительно 10 —10 см 2. При пластических деформациях металлов плотность дислокаций значительно возрастает и может достигать 10 —10 см- и выше. Однако плотность дислокаций увеличивается не только при пластических деформациях статического нагружения. Большинство экспериментальных работ, посвященных исследованию дислокационной структуры при усталости и ультразвуковых колебаниях, показывает, что, несмотря на относительно малые амплитуды напряжений (деформаций), плотность дислокаций возрастает в процессе циклического нагружения. После некоторого числа циклов нагружения она достигает определенной величины насыщения и в дальнейшем остается практически постоянной. Большей амплитуде напряжения (деформации) циклического нагружения соответствует и большая величина насыщения плотности дислокаций. Полученная при этом дислокационная структура зависит не только от величины амплитуды напряжения (деформации) циклического нагружения, но и от кристаллического строения материала и температуры, при которой проводится эксперимент.
При пластических деформациях металлов плотность дислокаций значительно возрастает и может достигать 10 —10 см- и выше. Однако плотность дислокаций увеличивается не только при пластических деформациях статического нагружения. Большинство экспериментальных работ, посвященных исследованию дислокационной структуры при усталости и ультразвуковых колебаниях, показывает, что, несмотря на относительно малые амплитуды напряжений (деформаций), плотность дислокаций возрастает в процессе циклического нагружения. После некоторого числа циклов нагружения она достигает определенной величины насыщения и в дальнейшем остается практически постоянной. Большей амплитуде напряжения (деформации) циклического нагружения соответствует и большая величина насыщения плотности дислокаций. Полученная при этом дислокационная структура зависит не только от величины амплитуды напряжения (деформации) циклического нагружения, но и от кристаллического строения материала и температуры, при которой проводится эксперимент.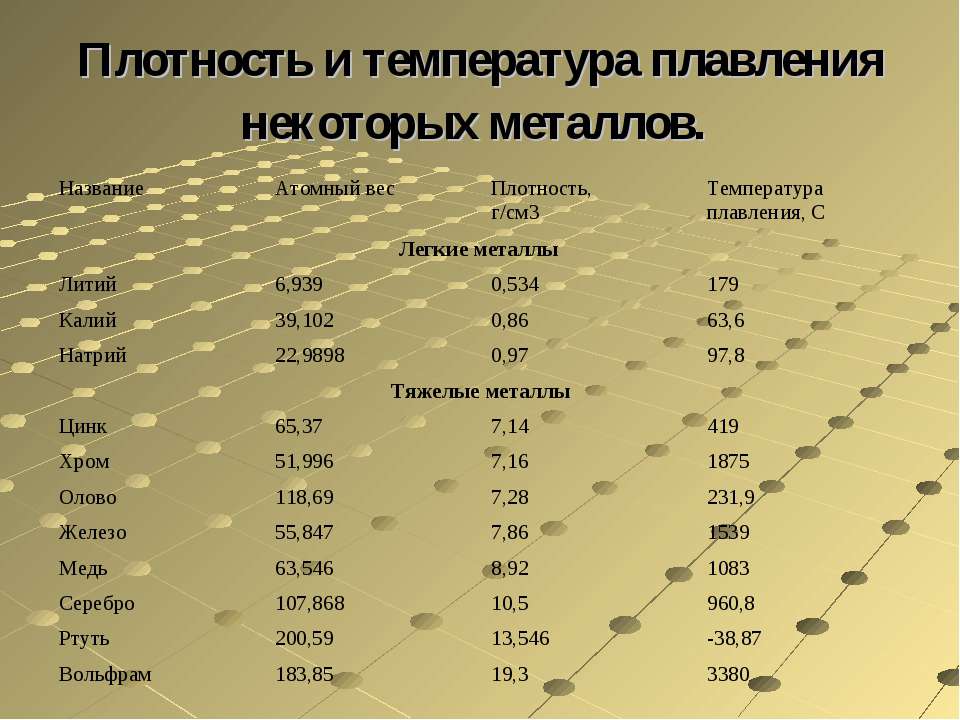 [c.176]
[c.176]
Уравнение Тафеля выводится с учетом процессов активации, управляющих растворением чистого металла. При точном выдерживании условий эксперимента константа Тафеля Ь может быть определена по величине наклона прямолинейного участка экспериментальной поляризационной кривой, а плотность тока обмена to — экстраполированием прямой линии до — О, что соответствует величине стандартного электродного потенциала металла. Если для определения констант Тафеля и получения сопутствующей информации используются экспериментальные данные, то необходимо обеспечить отсутствие посторонних факторов, способных исказить результаты. Это весьма сложная задача. Имеются два основных фактора, препятствующие экспериментальному определению наклона Тафеля, а именно концентрационная и омическая поляризации. Рассмотрим их ниже. [c.78]
Компоненты сплава или название сплава Химическая формула Плотность Опытно определенное процентное содержание компонентов Модули упругости (кгс/мм ) Отношение скорости звука в металле к скорости звука в воздухе из опытов на s s E > 1 a С Ф s s 1 о 0 s Л 4 Q z s S3 1 = 5 a u u i s a С [c.
 308]
308]При температуре 7 , составляющей около 40 / абсолютной температуры плавления и дальнейшем ее повышении в деформированном металле происходит с определенной скоростью явление рекристаллизации. Оно состоит в том, что искаженная за счет деформации кристаллическая решетка восстанавливается, исчезают микродефекты металла, возрастает его плотность. Происходит это за счет избыточной энергии деформации искаженной структуры и вследствие того, что при высокой температуре значительно облегчается диффузия атомов. Пластичность в результате рекристаллизации заметно увеличивается, т. е. при прочих равных условиях металл имеет повышенную способность деформироваться без разрушения, сопротивление (предел текучести, прочности) уменьшается. [c.192]
При определении массы наплавленного металла плотность р принята для сталей 7,8 г/сж (табл. 30—32 39—42) для алюминиевых сплавов 2,7 г/с,и (табл. 43) для титановых сплавов 4,5 г/с.и (табл. 45). [c.36]
Уже более осторожно можно сказать об уменьшении размера зерна с увеличением перенапряжения (или плотности тока) при получении металла из вполне определенного электролита. Здесь при изменении плотности тока в результате изменения ситуации в приэлектродном слое и условий кристаллизации структура может изменяться не столь простым образом. Итак, общая тенденция уменьшения размера зерна с ростом поляризации при выделении металла не всегда оказывается справедливой.
[c.41]
Здесь при изменении плотности тока в результате изменения ситуации в приэлектродном слое и условий кристаллизации структура может изменяться не столь простым образом. Итак, общая тенденция уменьшения размера зерна с ростом поляризации при выделении металла не всегда оказывается справедливой.
[c.41]
При механизированной сварке под флюсом глубина проплавления основного металла в определенных пределах не зависит от формы подготовки кромок и величины зазора, что объясняется высокой плотностью тока и концентрированностью теплового действия дуги при этом способе сварки, [c.13]
При разности потенциалов на электродах происходит ионизация межэлектродного промежутка. Когда напряжение достигнет определенного значения, в среде между электродами образуется канал проводимости, по котор
№ ва-риа-нта | Наименование и характеристика металла | Синго-ния | Кристал-лическая решетка | Парамет-ры элементарной ячейки | Основные свойства и область применения |
1 | 2 | 3 | 4 | 5 | 6 |
1 | Золото – Au, благородный металл желтого цвета | Куби-ческая | ГЦК | а=4,0783 Å | Основной валютный и денежный металл, используется на украшения, предметы роскоши, в физических и химических приборах |
2 | Медь — Cu, металл медно-красного цвета | Куби-ческая | ГЦК | а=3,6153 Å | Ковкий, пластичный, электропроводный, диамагнитный; широко применяется в электротехнике, машиностроении, для изготовления различных приборов, посуды и др . |
3 | Платина — Pt, металл серебристо-белого цвета | Куби-ческая | ГЦК | а=3,924 Å | Температура плавления 1773˚C; твердость 4; электропроводен, парамагнитен; используется в электротехнике, в физических и химических приборах, в том числе для изготовления термопар |
4 | Серебро — Ag, металл серебристо-белого цвета | Куби-ческая | ГЦК | а=4,0856 Å | Применяется в сплавах с медью для изготовления серебряных изделий, монет и др. Чистое серебро употребляется для филигранных работ, изготовления тиглей для плавления щелочей, серебрения и других целей |
5 | Алюминий — Al, металл серебристо-белого цвета | Куби-ческая | ГЦК | а=4,041 Å | Температура плавления 600˚C; высокая электропроводность; применяется для изготовления элементов конструкций и деталей (трубопроводы, кабели, электропровода, фольга) |
6 | Железо — Fe, металл серо-стального цвета | Куби-ческая | ОЦК | а=2,860 Å | Твердость
4-5; обладает ковкостью; до температуры
768˚C – магнитно. |
Продолжение таблицы 2 | |||||
1 | 2 | 3 | 4 | 5 | 6 |
7 | Никель — Ni, металл серебристо-белого цвета | Куби-ческая | ОЦК | а=3,489 Å | Электропроводен, магнитен; широко применяется в качестве добавки для получения сталей и сплавов с особыми физическими свойствами (магнитно-твердые стали и сплавы) |
8 | Магний — Mg, металл светло-серого цвета | Гекса-гональ-ная | ГПУ | а=3,103 Å с=5,200 Å | Температура
плавления 650˚C; на воздухе легко
воспламеняется. |
9 | Литий — Li, металл серебристо-белого цвета | Куби-ческая | ОЦК | а=3,509 Å | Относится к щелочным металлам. Самый легкий из металлов, химически очень активен. Используется для раскисления, легирования и модифицирования сплавов, как теплоноситель в ядерных реакторах, анод в химических источниках тока; в керамике, медицине |
10 | Бериллий — Be, металл светло-серого цвета | Гекса-гональ-ная | ГПУ | а=2,286 Å с=3,584 Å | Легкий, твердый. Применяют в электротехнике, самолето- и ракетостроении, для бериллизации, в ядерных реакторах |
11 | Натрий — Na, металл серебристо-белого цвета | Куби-ческая | ОЦК | а=4,291 Å | Относится
к щелочным металлам. |
12 | Калий — K, металл серебристо-белого цвета | Куби-ческая | ОЦК | а=5,247 Å | Относится к щелочным металлам. Мягкий легкоплавкий. Постоянная составляющая тканей растительных и животных организмов. Соли используют как удобрения. Сплавы калия и натрия – теплоносители в ядерных реакторах |
Продолжение таблицы 2 | |||||
1 | 2 | 3 | 4 | 5 | 6 |
13 | Кальций — Ca, металл серебристо-белого цвета | Куби-ческая | ГЦК | а=5,582 Å | Относится
к щелочноземельным металлам. |
14 | Титан — Ti, металл серебристо-белого цвета | Гекса-гональ-ная | ГПУ | а=2,950 Å с=4,683 Å | Легкий, тугоплавкий, прочный, пластичный. Очень стоек химически. Титан и его сплавы применяются в авиа-, ракето-, кораблестроении; в химической промышленности |
15 | Ванадий — V, металл серо-стального цвета | Куби-ческая | ОЦК | а=3,028 Å | Твердый,
устойчив к действию воды и многих
кислот. Легирующий компонент
конструкционных сталей и сплавов,
применяемых в авиационной и космической
технике, морском судостроении; компонент
сверхпроводящих сплавов. |
16 | Хром — Cr, металл голубовато-серебристого цвета | Куби-ческая | ОЦК | а=2,885 Å | На воздухе не окисляется. Обязательный компонент нержавеющих, кислотоупорных, жаростойких сталей. Применяют для хромирования |
17 | Кобальт — Co, металл серебристо-белого цвета с красноватым оттенком | Гекса-гональ-ная | ГПУ | а=2,505 Å с=4,089 Å | Ферромагнитен, химически стоек. Радиоактивный элемент используют как источник γ-излучения в медицине и технике. Входит в состав витамина В12 |
18 | Цинк — Zn, металл серебристо-белого цвета | Гекса-гональ-ная | ГПУ | а=2,665 Å с=4,947 Å | Температура
плавления 419,5˚C. |
19 | Цирконий — Zr, металл серебристо-белого цвета | Гекса-гональ-ная | ГПУ | а=3,231 Å с=5,731 Å | Твердый, тугоплавкий (температура плавления 1855˚C). Химически очнь стоек. Входит в состав сплавов для изготовления химической аппаратуры, хирургических инструментов; для жаростойкой керамики; для ядерной энергетики |
Окончание таблицы 2 | |||||
1 | 2 | 3 | 4 | 5 | 6 |
20 | Ниобий — Nb, металл светло-серого цвета | Куби-ческая | ОЦК | а=3,301 Å | Тугоплавкий
(температура плавления 2500˚C). |
21 | Молибден — Mo, металл светло-серого цвета | Куби-ческая | ОЦК | а=3,147 Å | Тугоплавкий (температура плавления 1890˚C), химически стоек. Применяется для легирования чугунов и сталей, используемых в авиа- и автомобилестроении. Важный конструкционый материал для изготовления нитей электрических ламп и катодов для лектровакуумных приборов |
22 | Кадмий — Cd, металл серебристого цвета с синеватым отливом | Гекса-гональ-ная | ГПУ | а=2,979 Å с=5,618 Å | Мягкий, легкоплавкий. Применяется для кадмирования; в мощных аккумуляторах; ядерной энергетике. Многие соединения кадмия ядовиты |
23 | Вольфрам — W, металл светло-серого цвета | Куби-ческая | ОЦК | а=3,165 Å | Наиболее
тугоплавкий из металлов. |
24 | Свинец – Pb, металл синевато-серого цвета | Куби-ческая | ГЦК | а=4,950 Å | Тяжелый, мягкий, ковкий. Используют для изготовления пластин для аккумуляторов, оболочек электрических кабелей, защиты от γ-излучения, как компонент типографских и антифрикционных сплавов, полупроводниковых материалов |
25 | Барий — Ba, металл серебристо-белого цвета | Куби-ческая | ОЦК | а=5,025 Å | Мягкий. Относится к щелочноземельным металлам. Химически очень активен, при нагревании воспламеняется. Применяют в вакуумной технике как газопоглотитель, в типографских и подшипниковых сплавах |
ФИЗИКА: Задачи на плотность, массу и объем
Задачи на плотность, массу и объем с решением
Формулы, используемые в задачах по физике на плотность, массу и объем.
Название величины | Обозначение | Единицы измерения | Формула |
Масса | m | кг | m = p * V |
Объем | V | м3 | V = m / p |
Плотность | p | кг/м3 | p = m / V |
Плотность равна отношению массы тела к его объёму. Плотность обозначают греческой буквой ρ (ро).
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Найдите плотность молока, если 206 г молока занимают объем 200 см3?
Задача № 2. Определите объем кирпича, если его масса 5 кг?
Задача № 3. Определите массу стальной детали объёмом 120 см3
Задача № 4.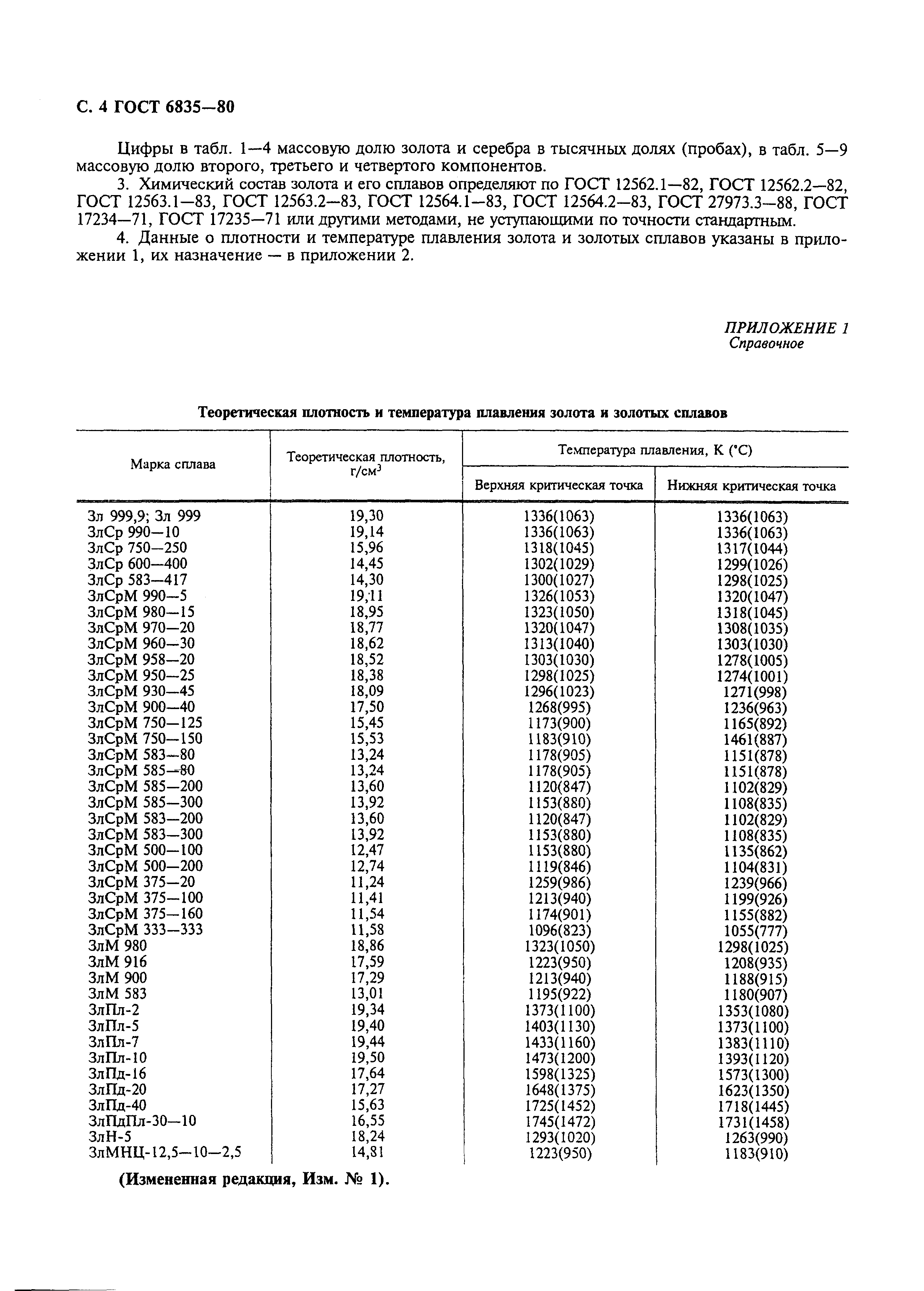 Размеры двух прямоугольных плиток одинаковы. Какая из них имеет большую массу, если одна плитка чугунная, другая — стальная?
Размеры двух прямоугольных плиток одинаковы. Какая из них имеет большую массу, если одна плитка чугунная, другая — стальная?
Решение: Из таблицы плотности веществ (см. в конце страницы) определим, что плотность чугуна (ρ2 = 7000 кг/м3) меньше плотности стали (ρ1 = 7800 кг/м3). Следовательно, в единице объема чугуна содержится меньшая масса, чем в единице объема стали, так как чем меньше плотность вещества, тем меньше его масса, если объемы тел одинаковы.
Задача № 5. Определите плотность мела, если масса его куска объемом 20 см3 равна 48 г. Выразите эту плотность в кг/м3 и в г/см3.
Ответ: Плотность мела 2,4 г/см3, или 2400 кг/м3.
Задача № 6. Какова масса дубовой балки длиной 5 м и площадью поперечного сечения 0,04 м2 ?
ОТВЕТ: 160 кг.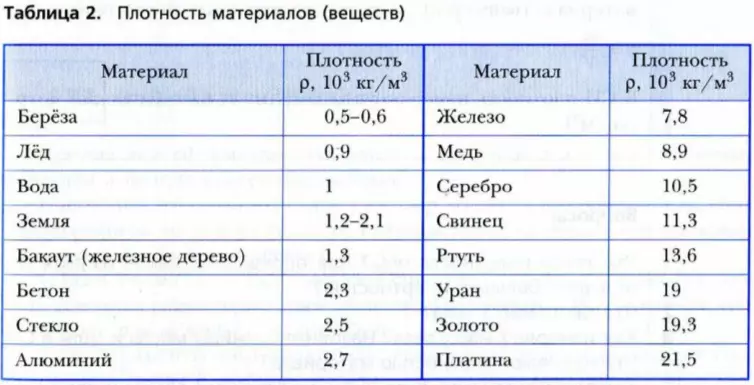
РЕШЕНИЕ. Из формулы для плотности получаем m = p • V. С учетом того, что объем балки V = S • l , получаем: m = p • S • l.
Вычисляем: m = 800 кг/м3 • 0,04 м2 • 5 м = 160 кг.
Задача № 7. Брусок, масса которого 21,6 г, имеет размеры 4 х 2,5 х 0,8 см. Определить, из какого вещества он сделан.
ОТВЕТ: Брусок сделан из алюминия.
Задача № 8 (повышенной сложности). Полый медный куб с длиной ребра а = 6 см имеет массу m = 810 г. Какова толщина стенок куба?
ОТВЕТ: 5 мм.
РЕШЕНИЕ: Объем кубика VK = а3 = 216 см3. Объем стенок VС можно вычислить, зная массу кубика mК и плотность меди р: VС = mК / р = 91 см3. Следовательно, объем полости VП = VK — VC = 125 см3.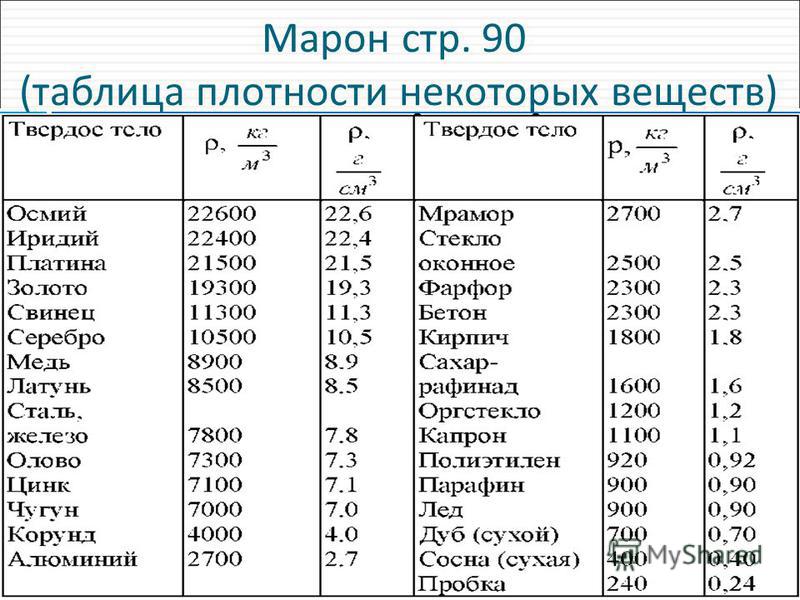 Поскольку 125 см3 = (5 см)3, полость является кубом с длиной ребра b = 5 см. Отсюда следует, что толщина стенок куба равна (а — b)/2 = (6 – 5)/2 = 0,5 см.
Поскольку 125 см3 = (5 см)3, полость является кубом с длиной ребра b = 5 см. Отсюда следует, что толщина стенок куба равна (а — b)/2 = (6 – 5)/2 = 0,5 см.
Задача № 9 (олимпиадный уровень). Масса пробирки с водой составляет 50 г. Масса этой же пробирки, заполненной водой, но с куском металла в ней массой 12 г составляет 60,5 г. Определите плотность металла, помещенного в пробирку.
ОТВЕТ: 8000 кг/м3
РЕШЕНИЕ: Если бы часть воды из пробирки не вылилась, то в этом случае общая масса пробирки, воды и куска металла в ней была бы равна 50 г + 12 г = 62 г. По условию задачи масса воды в пробирке с куском металла в ней равна 60,5 г. Следовательно, масса воды, вытесненной металлом, равна 1,5 г, т. е. составляет 1/8 массы куска металла. Таким образом, плотность металла в 8 раз больше плотности воды.
Задачи на плотность, массу и объем с решением.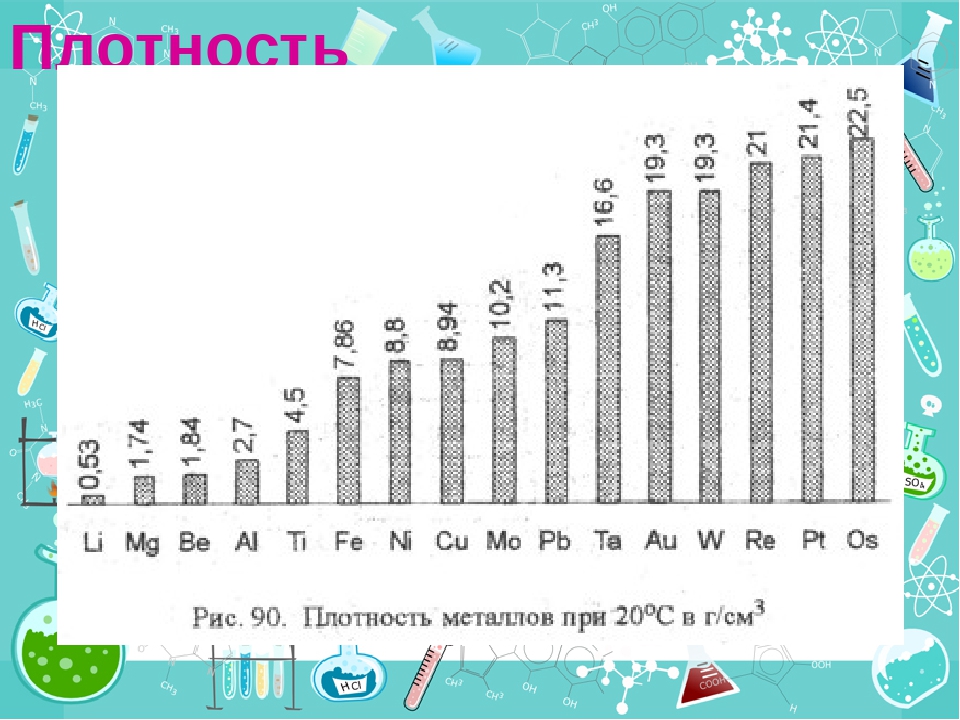 Таблица плотности веществ.
Таблица плотности веществ.
Справочный материал для «Задачи на плотность, массу и объем«
Как, зная только массу, рассчитать плотность?
- Если объем тела (вещества) неизвестен или не задан явно в условиях задачи, то попытайтесь его измерить, вычислить или узнать, используя косвенные (дополнительные) данные.
- Если вещество сыпучее или жидкое, то оно, как правило, находится в емкости, которая обычно имеет стандартный объем. Так, например, объем бочки обычно равен 200 литров, объем ведра – 10 литров, объем стакана – 200 миллилитров (0,2 литра), объем столовой ложки – 20 мл, объем чайной – 5 мл. Об объеме трехлитровых и литровых банок нетрудно догадаться из их названия.
- Если жидкость занимает не всю емкость или емкость нестандартная, то перелейте ее в другую тару, объем которой известен.Если подходящей емкости нет, перелейте жидкость с помощью мерной кружки (банки, бутылки). В процессе вычерпывания жидкости просто посчитайте количество таких кружек и умножьте на объем мерной тары.

- Если тело имеет простую форму, то вычислите его объем, используя соответствующие геометрические формулы. Так, например, если тело имеет форму прямоугольного параллелепипеда, то его объем будет равен произведению длин его ребер. То есть: Vпар. = a • b • c, где Vпар. – объем прямоугольного параллелепипеда, а a, b, c — значения его длины, ширины и высоты (толщины), соответственно.
- Если тело имеет сложную геометрическую форму, то попробуйте (условно!) разбить его на несколько простых частей, найти объем каждой из них отдельно и затем сложить полученные значения.
- Если тело невозможно разделить на более простые фигуры (например, статуэтку), то воспользуйтесь методикой Архимеда. Опустите тело в воду и измерьте объем вытесненной жидкости. Если тело не тонет, то «утопите» его с помощью тонкой палочки (проволоки).
- Если объем вытесненной телом воды посчитать проблематично, то взвесьте вылившуюся воду, или найдите разность между начальной и оставшейся массой воды.
 При этом, количество килограммов воды будет равняться количеству литров, количество граммов – количеству миллилитров, а количество тонн – количеству кубометров.
При этом, количество килограммов воды будет равняться количеству литров, количество граммов – количеству миллилитров, а количество тонн – количеству кубометров.
Конспект урока «Задачи на плотность, массу и объем с решением».
Следующая тема: «Задачи на силу тяжести и вес тела».
Металлы. Свойства, характеристики металлов
Содержание страницы
Металлы (от лат. metallum – шахта, рудник, копь) – наиболее широко используемый класс конструкционных материалов, применение которых наряду с неметаллами и композитами позволяет решать почти любые технологические задачи. К металлам принято относить элементы, обладающие характерными металлическими свойствами (высокой тепло- и электропроводностью, повышенной пластичностью и т. д.).
Число элементов, проявляющих свойства металлов, гораздо больше по сравнению с числом элементов, характеризующихся неметаллическими свойствами. Металлы расположены в I и II группах Периодической системы Д. И. Менделеева, а также образуют побочные подгруппы III–VIII групп. Ряд элементов проявляет амфотерные свойства (амфотерность – двойственность, способность некоторых соединений в зависимости от условий демонстрировать как кислотные, так и основные свойства).
Металлы расположены в I и II группах Периодической системы Д. И. Менделеева, а также образуют побочные подгруппы III–VIII групп. Ряд элементов проявляет амфотерные свойства (амфотерность – двойственность, способность некоторых соединений в зависимости от условий демонстрировать как кислотные, так и основные свойства).
Металлические свойства элементов определяются способностью атомов при взаимодействии с атомами других элементов частично или полностью смещать к ним электронные облака или «отдавать» электроны, т. е. проявлять при взаимодействии восстановительные свойства.
К самым активным металлам относятся элементы, обладающие:
- низкой энергией ионизации;
- большим радиусом атома;
- малым числом внешних электронов;
- небольшим значением электроотрицательности.
По мере заполнения внешнего энергетического уровня электронами их число на валентном уровне атомов элементов растет, а радиус атомов уменьшается, поэтому в большей степени проявляется склонность атомов к присоединению, а не к отдаче электронов. В связи с этим в периоде при движении слева направо металлические свойства элементов постепенно уменьшаются, а неметаллические – увеличиваются.
В связи с этим в периоде при движении слева направо металлические свойства элементов постепенно уменьшаются, а неметаллические – увеличиваются.
Имея больший радиус атома, металлы характеризуются, как было сказано выше, сравнительно низкими значениями энергии ионизации, сродства к электрону и электроотрицательности. Эти особенности влияют на преобладание у металлов восстановительных свойств, т. е. способности их атомов отдавать электроны. Ярче всего восстановительные свойства выражены у атомов металлов I и II групп главных подгрупп или у s-элементов. Самым сильным восстановителем является франций, а в водной среде – литий, выделяющийся за счет более высокого значения энергии гидратации образующихся катионов металла.
Число элементов, проявляющих металлические свойства, внутри периодов возрастает по мере увеличения номера периода. Так, во втором периоде это два элемента, в третьем – три, в четвертом – тринадцать и т. д.
В Периодической таблице металлические элементы отделены от неметаллических диагональной линией, проходящей от бора к астату. Вдоль этой границы располагаются элементы, одновременно проявляющие свойства и металлов, и неметаллов. К ним относятся бор, кремний, германий, мышьяк, сурьма, теллур и астат, которые называются полуметаллами или металлоидами. Таким образом, внутри каждого периода имеется «пограничная зона», где располагается элемент, имеющий двойственные свойства. Соответственно переход от типичного металла к типичному неметаллу в периоде происходит постепенно.
Вдоль этой границы располагаются элементы, одновременно проявляющие свойства и металлов, и неметаллов. К ним относятся бор, кремний, германий, мышьяк, сурьма, теллур и астат, которые называются полуметаллами или металлоидами. Таким образом, внутри каждого периода имеется «пограничная зона», где располагается элемент, имеющий двойственные свойства. Соответственно переход от типичного металла к типичному неметаллу в периоде происходит постепенно.
Начиная с 3-го периода у атомов появляются новые подуровни. Поэтому увеличивается число свободных орбиталей и, следовательно, возрастает между атомами количество связей, способствующих образованию сложных молекул, таких как комплексные соединения. В комплексных соединениях связь чаще всего образуется по донорно-акцепторному механизму. В роли акцептора, как правило, выступает положительно заряженный ион металла. Практически все элементы могут исполнять роль комплексообразователя, но наибольшее число комплексных соединений характерно для d-элементов 4-, 5- и 6-го периодов системы. Следовательно, элементы побочных подгрупп (В) более склонны к комплексообразованию, чем элементы главных подгрупп (А).
Следовательно, элементы побочных подгрупп (В) более склонны к комплексообразованию, чем элементы главных подгрупп (А).
1. Физические свойства металлов
Почти все металлы, за исключением франция и ртути, в стандартных условиях находятся в твердом состоянии. При нагревании до определенной температуры они плавятся, а при еще более высоких температурах переходят в газообразное состояние.
Твердость металлов, а также их температура плавления обусловлены прочностью пространственной кристаллической решетки. Самые мягкие – щелочные металлы, которые легко режутся ножом. Наиболее твердые – металлы VIВ группы, особенно хром; по твердости он приближается к алмазу и режет стекло.
Изменение температуры плавления можно проследить по таблице Д. И. Менделеева: каждый период начинается с металла, имеющего очень низкий показатель. По мере увеличения заряда ядра атома температура плавления растет и достигает максимума в группе хрома, где находится самый тугоплавкий металл – вольфрам (3390 °С). Далее она снижается
Далее она снижается
и достигает минимума в подгруппе цинка, где находится самый легкоплавкий металл – ртуть (–38,9 °С). Металлы, температуры плавления которых выше 1000 °С, называют тугоплавкими, а ниже 100 °С – легкоплавкими.
Металлический блеск является следствием отражения световых лучей, а его интенсивность определяется долей поглощаемого света. Большинство металлов почти полностью отражают свет всех длин волн спектра, в связи с чем имеют белый или серый цвет. Наиболее ярко блестят палладий и серебро. Некоторые металлы (медь, золото, цезий) поглощают зеленый или голубой свет сильнее, чем свет других длин волн, поэтому окрашены в желтый или красный цвета.
В мелкораздробленном состоянии многие металлы теряют блеск. Например, железо, платина, хром становятся черного или серого цвета, тогда как алюминий и магний в порошкообразном состоянии продолжают блестеть. Интенсивность блеска зависит от доли поглощенного света: чем меньше света поглощает металл, тем более интенсивным будет блеск.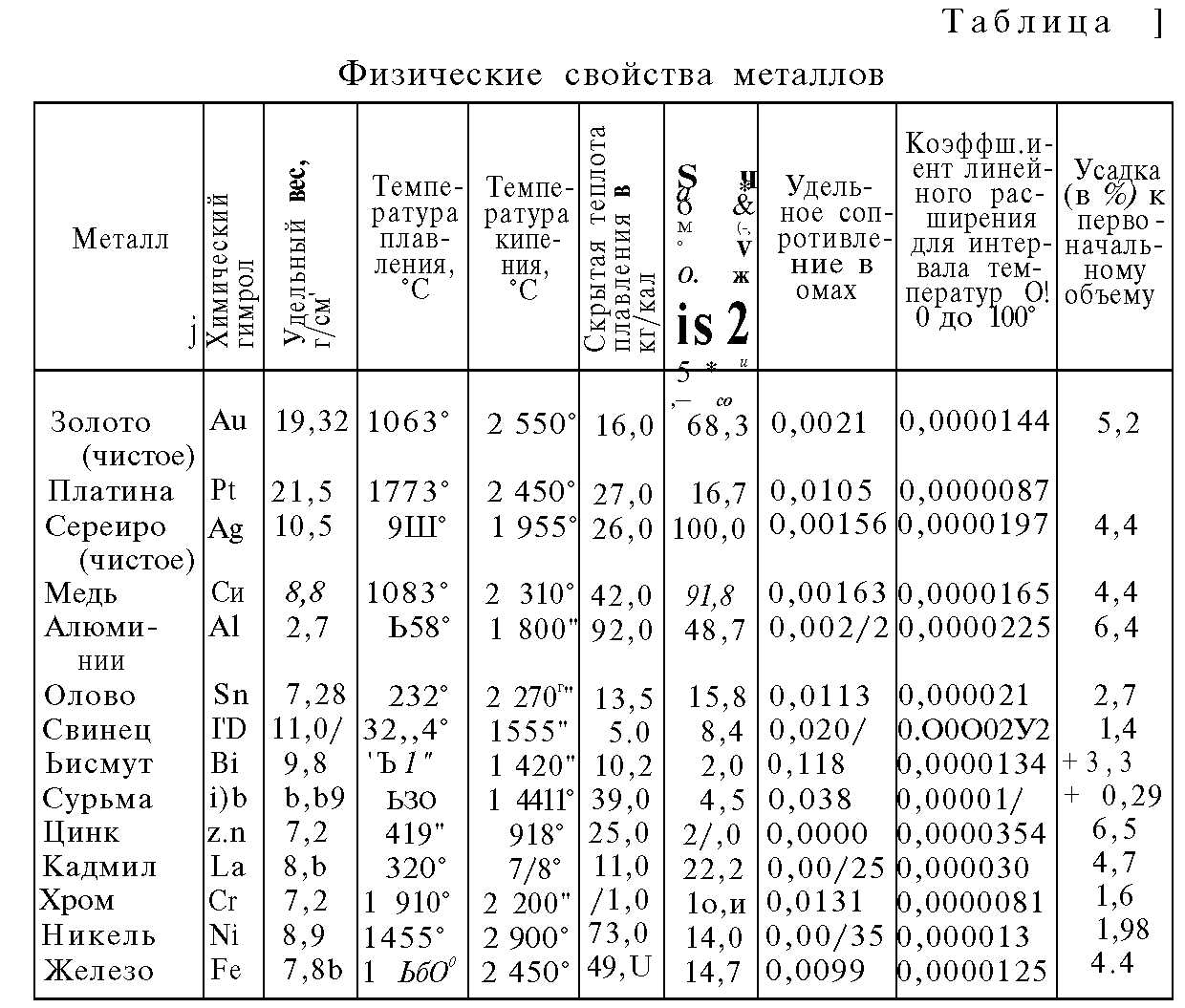
Все металлы полностью отражают радиоволны, что используется для обнаружения различных металлических объектов с помощью радиоволн (радиолокация).
Теплота сублимации – это характеристика, представляющая собой энергию, необходимую для перевода определенной массы металла в парообразное состояние. Теплота сублимации является мерой прочности связи в кристаллической решетке металла. В каждом периоде таблицы Д. И. Менделеева с увеличением порядкового номера теплота сублимации возрастает и достигает максимума для металлов подгруппы хрома, затем снижается до минимального значения в подгруппе цинка. Характер изменения значений теплоты сублимации в побочных подгруппах аналогичен изменению температур плавления и кипения металлов.
Электропроводность обусловлена присутствием в металле свободных электронов, которые направленно перемещаются при наложении электрического тока. Металлы – проводники 1-го рода, поскольку проводят электрический ток без изменений своей структуры. При нагревании электропроводность уменьшается, так как усиливается колебательное движение ионов, что затрудняет движение электронов. При охлаждении же электропроводность возрастает. Вблизи абсолютного нуля она стремится к бесконечности – это так называемое явление сверхпроводимости.
При нагревании электропроводность уменьшается, так как усиливается колебательное движение ионов, что затрудняет движение электронов. При охлаждении же электропроводность возрастает. Вблизи абсолютного нуля она стремится к бесконечности – это так называемое явление сверхпроводимости.
Теплопроводность – это свойство металлов, обеспечиваемое взаимодействием электронов проводимости с ионами, находящимися в узлах кристаллической решетки. Теплопроводность связана с электропроводностью: у металлов с высокой электропроводностью теплопроводность так же высока.
Пластичность металлов представляет собой легкость деформации, особенно проявляющуюся при высоких температурах. Обусловлена она тем, что под внешним воздействием одни слои в кристаллах легко перемещаются (скользят) относительно других без разрыва. Благодаря этому большинство металлов прокатывается в листы, вытягивается в проволоку, поддается ковке, прессованию и т. д. Наиболее пластичны золото, серебро и медь.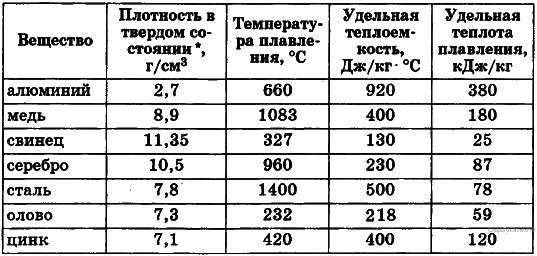 Механически прочные металлы деформируются только под воздействием больших нагрузок.
Механически прочные металлы деформируются только под воздействием больших нагрузок.
Плотность – это критерий, лежащий в основе разделения металлов на легкие и тяжелые. Металлы, плотность которых меньше 5 г/см3, условно принято называть легкими, а более 5 г/см3 – тяжелыми. Самый легкий из металлов – литий (плотность 0,53 г/см3), а самый тяжелый – осмий (плотность 22,6 г/см3). К легким относятся щелочные, щелочноземельные металлы, а также бериллий, алюминий, скандий, иттрий и титан, а к тяжелым – все остальные.
Плотность металлов связана с температурой их плавления. Легкие металлы обычно самые легкоплавкие, например, цезий с плотностью 1,87 г/см3 плавится при температуре +28 °С, а вольфрам с плотностью 19 г/см3 имеет температуру плавления, равную +3380 °С.
Фотоэлектрический эффект – это свойство металлов выбрасывать электроны с поверхности под действием электромагнитных волн, что обусловлено слабой связью валентных электронов с ядром. Чем слабее эта связь, тем меньше энергии необходимо для отрыва электрона. Именно поэтому в щелочных металлах фотоэлектрический эффект выражен сильнее.
На границе раздела двух металлов возникает контактная разность потенциалов, вызванная различной концентрацией электронов проводимости и разной работой выхода электронов у соприкасающихся поверхностей.
Полиморфизм – это явление существования металла в разных формах в твердом состоянии, или способность принимать различные кристаллические формы. Полиморфные модификации отличаются как внутренней структурой, так и физическими свойствами. Например, у железа известны α-, β-, γ-формы. Модификация α- железа устойчива при низких температурах, β– при более высоких.
Магнитные свойства присущи фактически всем металлам, поскольку они являются магнетиками – веществами, изменяющими или приобретающими магнитный момент под действием внешнего (стороннего) магнитного поля. Мерой измерения магнитных свойств металлов служат следующие величины: остаточная индукция, коэрцитивная сила и магнитная проницаемость (магнитная восприимчивость).
Металлы по магнитным свойствам могут быть разделены на три основные группы:
- диамагнетики – выталкиваются из магнитного поля и ослабляют его;
- парамагнетики – втягиваются магнитным полем, незначительно усиливая его;
- ферромагнетики – усиливают магнитное поле на порядки величин.
К диамагнетикам относятся такие металлы, как медь, серебро, золото, кремний, бериллий и металлы подгруппы цинка, галлия, германия. Им свойственна отрицательная магнитная восприимчивость, поскольку под действием внешнего магнитного поля в них возникает намагниченность, направленная ему навстречу. Парамагнетики – металлы с небольшой положительной восприимчивостью (в основном щелочные и щелочноземельные), которые намагничиваются в направлении внешнего поля. Ферромагнетики включают металлы, обладающие высокой магнитной восприимчивостью – это железо, кобальт, никель. Есть металлы и сплавы, которые не принадлежат трем упомянутым группам: антиферромагнетики (ряд редкоземельных металлов), ферриты (соединения оксида железа) и т. д.
Металлы, применяемые в технике, подразделяются на черные (железо и его сплавы), цветные (все остальные, включая магний и алюминий), драгоценные (золото, платина, палладий, иридий), редкие (цирконий, иттрий, лантан, церий и др.).
2. Типы кристаллических решеток
Все металлы в твердом состоянии представляют собой кристаллы. Кристалл – это совокупность атомов, расположенных в пространстве не хаотично, а в геометрически правильной последовательности. Пространственное расположение атомов и образует кристаллическую решетку.
В узлах пространственной кристаллической решетки металла правильно расположены положительно заряженные ионы, а между ними перемещаются свободные электроны – электронный газ. Переходя от одного катиона к другому, они осуществляют связь между ионами и превращают кристалл металла в единое целое. Эта связь, называемая металлической, возникает между атомами металлов за счет перекрывания электронных облаков внешних электронов. Металлическая связь отличается от неполярной ковалентной связи своей ненаправленностью. В кристалле металлического типа электроны не закреплены между двумя атомами, а принадлежат всем атомам данного кристалла, т. е. делокализованы. К особенности структуры металлических кристаллов относятся большие координационные числа – 8÷12, которым соответствует высокая плотность упаковки.
Кристаллическая решетка каждого металла состоит из положительно заряженных ионов одинакового размера, расположенных в кристалле по принципу наиболее плотной упаковки шаров одинакового диаметра.
Различают три основных типа упаковки, или кристаллической решетки.
1. Объемноцентрированная кубическая решетка с координационным числом, равным 8 (натрий, калий, барий). Атомы металла расположены в вершинах куба, а один – в центре объема. Плотность упаковки шарообразными ионами в этом случае составляет 68 %.
2. Гранецентрированная кубическая решетка с координационным числом, равным 12 (алюминий, медь, серебро). Атомы металла расположены в вершинах куба и в центре каждой грани. Плотность упаковки – 74 %.
3. Гексагональная решетка с координационным числом 12 (магний, цинк, кадмий). Атомы металла расположены в вершинах и центре шестигранных оснований призмы, а еще три – в ее средней плоскости. Плотность упаковки – 74 %.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Это явление, получившее название анизотропия, характерно для одиночных кристаллов – монокристаллов. Однако большинство металлов в обычных условиях имеют поликристаллическое строение, т. е. состоят из значительного числа кристаллов, или зерен, каждое из которых анизотропно. Разная ориентировка отдельных зерен приводит к усреднению свойств поликристаллического металла.
Особенности кристаллических решеток обусловливают характерные физические свойства металлов.
3. Характеристика химических свойств металлов
3.1. Восстановительная способность
Все металлы в свободном состоянии – восстановители, поэтому в соединениях их степени окисления всегда положительны. Химическая активность металлов, т. е. их способность отдавать электроны, может быть охарактеризована с помощью двух величин: энергии ионизации и стандартного электродного потенциала. Различие между этими величинами заключается в том, что энергия ионизации влияет на процесс отрыва электрона от атомов металлов в газовой фазе, а электродные потенциалы изменяют свойства металлов в растворах.
Энергия ионизации (Еи) – энергия, необходимая для удаления электрона из изолированного атома на бесконечно большое расстояние:
Ме(г) – ē + Еи → Ме+(г).
Электродный потенциал (Е0) количественно характеризует способность металла отдавать электроны в растворе, т. е. его восстановительные свойства:
Ме(т) + nН2О – nē → [Ме(Н2О)n(водн.)]n+.
Интенсивность взаимодействия металлов с элементарными окислителями определяется не только энергией ионизации атома металла, но и энергией сродства к электрону, и энергией диссоциации молекулярного окислителя. Последнее служит объяснением более легкого окисления металлов галогенами, чем кислородом или азотом, обладающими высокими значениями сродства к электрону.
Внутри каждого периода таблицы Д. И. Менделеева при движении слева направо энергия ионизации повышается: наименьшей энергией характеризуется щелочной металл, а наибольшей – благородный газ. Тогда как в пределах одной группы с возрастанием заряда ядра энергия ионизации, наоборот, уменьшается, так как радиус атома увеличивается, а притяжение электрона к ядру ослабевает. Следовательно, в периоде восстановительная способность атомов элементов уменьшается, а в группе увеличивается.
Все металлы окисляются фтором и могут окисляться хлором. Большинство из них, кроме золота и платины, окисляются бромом в кислой среде. Продуктами такого взаимодействия являются высшие галиды металлов.
С кислородом металлы взаимодействуют менее энергично, что объясняется высоким значением энергии диссоциации его молекулы. Продуктами такого взаимодействия являются, как правило, оксиды, хотя в некоторых случаях возможно образование пероксидов.
С азотом многие металлы вообще не взаимодействуют. Лишь некоторые, способные гореть в атмосфере азота, образуют нитриды. Такая устойчивость обусловлена высокой энергией диссоциации молекулы азота. Атомарный же азот легко взаимодействует со многими металлами с образованием нитридов.
С серой почти все металлы взаимодействуют при нагревании. Особенно легко они реагируют на расплавленную серу. Продуктами такого взаимодействия являются сульфиды металлов.
С водородом активные металлы взаимодействуют с образованием гидридов. Легкость перехода атомов металлов в гидратированные ионы зависит не только от химической активности металла, но и от энергии гидратации его иона.
Сравним свойства двух металлов: лития и цезия. Оба они относятся к s-элементам I группы, но литий находится во втором периоде, а цезий – в шестом. Поскольку радиус атома цезия больше, чем радиус атома лития, то энергия ионизации лития (5,39 эВ) больше, чем цезия (3,89 эВ). Ионы лития лучше гидратируются, благодаря чему в водных растворах он является более сильным восстановителем. А вот в твердом виде наиболее активным металлом и эффективным восстановителем становится цезий.
Металлы при взаимодействии с кислородом (прямом или косвенном) образуют основные оксиды, гидроксиды которых проявляют основные свойства: металл (Ме) → основной оксид (МехОу) → гидроксид или [Ме(ОН)х] основание. Например:
Са → СаО → Са(ОН)2;
2Са + O2 = 2 СаО; СаО + H2О = Са(ОН)2.
Оксид и гидроксид кальция проявляют основные свойства, поэтому могут взаимодействовать с кислотными оксидами и с кислотами:
СаO + N2O5 → Са(NO3)2; СаO + 2НNO3 = Са(NO3)2 + H2O; Са(OH)2 + SO3 = СаSO4 + Н2О; Са(OH)2 + H2SO4 = СаSO4 + 2 Н2О.
В периоде основные свойства оксидов и гидроксидов уменьшаются:
Na2O – MgO – Al2O3; NaOH – Mg(OH)2 – Al(OH)3.
В группе основные свойства соединений увеличиваются:
BeO – MgO – CaO – BaO; Be(OH)2 – Mg(OH)2 – Ca(OH)2 – Ba(OH)2.
Если металл может образовывать соединения с разными степенями окисления, то свойства соединений будут зависеть от степени окисления элемента.
С возрастанием степени окисления металла основные свойства соединений уменьшаются, а кислотные свойства увеличиваются:
Fe(ОH)2 – Fe(ОH)3; Sn(ОH)2 – Sn(ОH)4; MnO – Mn2O7; Mn(ОH)2 – HMnO4.
Взаимодействие металлов с водородными соединениями зависит от агрегатного состояния водородного соединения и от температуры. В основном галогенводороды реагируют с металлами при высокой температуре. При этом образуются соответствующие галиды металлов и выделяется водород:
Ме + nНГ = МеГn+ n/2 Н2.
С активными металлами данная реакция протекает при обычной температуре.
Взаимодействие металлов с водой определяется их активностью. Активные металлы вытесняют водород из воды при комнатной температуре:
Ме + n HOH = Me(OH)n+ n/2 H2.
Действие воды на металлы усиливается в присутствии кислорода. Если малоактивные металлы в обычных условиях с водой не взаимодействуют, то в присутствии растворенного кислорода достаточно легко окисляются:
Me + n/2 H2O + n/4 O2 = Me(OH)n.
Сероводород (H2S) взаимодействует с металлами преимущественно при высоких температурах с выделением водорода и образованием сульфидов, а в случае активных металлов – гидросульфидов.
Газообразный аммиак (NH3) действует на металлы также при высоких температурах, образуя при этом нитриды или гидронитриды (амиды) металлов. Однако жидкий аммиак активными металлами разлагается:
Me + n NH3 = Me(NH2) + n/2 H2.
Образование пассивных пленок. Взаимодействие многих металлов с фтором, хлором, бромом и кислородом тормозится пассивными пленками. Они образуются на поверхности металла и имеют особую структуру, благодаря которой обладают такими свойствами как прочность, высокая плотность, инертность и т. д. Наибольшая склонность к пассивации отличает алюминий, бериллий и d-металлы: титан, хром, железо.
Токсичность. Пыль и пары многих металлов являются токсичными. Примером могут служить бериллий, ртуть, свинец, кадмий, серебро, никель, таллий, радий, индий и т. д. Степень токсичности определяется значением предельно допустимой концентрации (ПДК). Так, для бериллия ПДК = 10–3 мг/м3, для таллия – 10–1 мг/м3.
Комплексообразование. Большинство металлов являются комплексообразователями за счет вакантных (свободных) орбиталей: [Cu(NH3)4]Cl2; K2[HgI4].
Способность к комплексообразованию возрастает с увеличением заряда иона-комплексообразователя и уменьшением его радиуса.
3.2. Отношение металлов к кислотам
Взаимодействие с серной кислотой – H2SO4
1. Разбавленная H2SO4. Окислителем в разбавленной серной кислоте является ион водорода Н+. Следовательно, в реакцию могут вступать металлы, чей
стандартный электродный потенциал меньше, чем у водорода (Е0Me > Е0H = 0) :
Ме Н
Zn + H2SO4 = ZnSO4 + H2. (1)
2. Концентрированная H2SO4. Окислителем в этом случае является атом серы со степенью окисления +6 – S+6. В зависимости от активности металла реакция может быть разной:
- металлы низкой активности (Е0Me < Е0H ) восстанавливают серную кислоту до диоксида серы:
Cu + H2SO4 → CuSO4 + SO2 + H2O; (2)
- металлы средней активности, для которых справедливо соотношение Е0Mn = – 1,05 ≤ Е0Me < Е0H , восстанавливают серу серной кислоты до простого вещества:
Zn + H2SO4 → ZnSO4 + S + H2O; (3)
- металлы высокой активности ( Е0Me < Е0Mn ) вытесняют из серной кислоты сероводород, в котором степень окисления серы минимальна и равна – 2:
Mg + H2SO4 → MgSO4 + H2S + H2O.
Взаимодействие с азотной кислотой – HNO3
1. Разбавленная HNO3. Окислителем в азотной кислоте всегда является атом N+5, поэтому при взаимодействии с металлами из нее никогда не выделяется водород. Возможны три варианта взаимодействия металлов разной активности с разбавленной HNO3:
- металлы низкой активности ( Е0Me > Е0H ) способны восстанавливать азот азотной кислоты до степени окисления +2:
Cu + HNO3 → Cu(NO3)2 + NO + H2O; (4)
- металлы средней активности ( Е0Mn = – 1,05 ≤ Е0Me < Е0H) восстанавливают азотную кислоту до простого вещества N2 (или до закиси азота N2O):
Ni + HNO3 → Ni(NO3)2 + N2 + H2O; (5)
- металлы высокой активности ( Е0Me < Е0Mn ) способны восстановить азот азотной кислоты до минимальной степени окисления –3:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O.
2. Концентрированная HNO3. В этом случае различают лишь два варианта взаимодействия с металлами:
- металлы низкой активности ( Е0Me > Е0H ) восстанавливают азотную кислоту до диоксида азота NO2, в котором степень окисления азота равна +4:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O; (6)
- активные металлы (Е0Ме < Е0Н) при растворении в концентрированной кислоте выделяют из нее оксид азота (II):
Mg + HNO3 → Mg(NO3)2 + NO + H2O. (7)
Такие металлы, как Fe, Al, Cr, Ti не взаимодействуют с концентрированной HNO3 вследствие явления пассивации.
Разложение нитратов металлов разной активности. От активности металла зависит состав продуктов разложения солей азотной кислоты. Возможны три варианта термического разложения нитратов металлов разной активности:
- стоящие в ряду напряжений до Mg при разложении образуют соответствующие нитриты и кислород: MeNO3 → MeNO2 + O2;
- расположенные в ряду напряжений в диапазоне «Mg – Cu» разлагаются с образованием соответствующих оксидов, диоксида азота и кислорода: MeNO3 → MeO + NO2 + O2;
- находящиеся в ряду напряжений после Cu разлагаются с выделением металла в виде простого вещества, диоксида азота и кислорода: MeNO3 → Me + NO2 + O2.
4. Металлические сплавы
В твердом состоянии металлы практически не взаимодействуют друг с другом, однако в расплавленном состоянии могут иметь место и растворение, и взаимодействие. Различные расплавленные металлы в большинстве случаев смешиваются друг с другом в любых соотношениях, образуя жидкие однородные системы. В отдельных случаях наблюдается неполная взаимная растворимость. Например, расплавленные цинк и свинец при смешивании образуют двухслойную жидкую систему, фазы которой представляют собой растворы цинка в свинце и свинца в цинке.
Отличительные признаки смешанных металлических расплавов проявляются в процессе их кристаллизации при охлаждении в некотором температурном интервале. Система при этом затвердевает, образуя металлический сплав.
Металлические сплавы – это вещества, обладающие свойствами металлов и состоящие из двух и более компонентов, из которых хотя бы один является металлом.
Природа затвердевших сплавов зависит от отношения друг к другу составляющих их компонентов. При сходстве кристаллических решеток они взаимно растворимы друг в друге даже в твердом состоянии. Из их расплавов при охлаждении кристаллизуются твердые растворы, представляющие собой кристаллы с решетками, в узлах которых попеременно располагаются ионы составляющих металлов, например, медь – серебро. При близости параметров кристаллических решеток составляющих металлов наблюдается их неограниченная растворимость друг в друге, т. е. могут образовываться твердые растворы с любым содержанием исходных веществ. Системы с полной взаимной растворимостью – это непрерывные твердые растворы: Ag – Au, Ni – Co, Cu – Ni, Mo – W.
Твердые растворы металлов обладают свойствами, качественно напоминающими свойства индивидуальных металлов, но количественно отличающимися от них в зависимости от состава. Например, латунь (сплав Cu – Zn) имеет прочность на разрыв, которая в 3 раза больше, чем у меди и в 6 раз, чем у цинка, а нержавеющая сталь (сплав Fe – Cr – Ni) устойчива в разбавленной H2SO4, тогда как чистый металл Fe в ней растворяется.
Среди компонентов твердого раствора различают металл-растворитель и растворенный металл. Растворителем считается металл, сохраняющий свою кристаллическую решетку при образовании раствора, и содержание которого в растворе должно быть не меньше определенного значения. Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла-растворителя (растворы замещения) или располагаются между ними (растворы внедрения). В том случае, когда различные металлы с близкими кристаллическими решетками способны образовывать твердые растворы в любых количественных соотношениях, отличить растворенный металл от металла-растворителя нет возможности: приходится считать, что они взаимно растворяют друг друга.
Ионы растворенного металла изменяют средние размеры элементарной ячейки металла-растворителя. При образовании твердых растворов замещения параметры решетки изменяются в зависимости от разности ионных диаметров растворенного металла и растворителя. При образовании твердых растворов внедрения параметры решетки увеличиваются, так как размеры ионов растворенного металла больше межионных помежутков, в которых они располагаются.
Однако чаще всего растворимость твердых металлов друг в друге ограничена, т. е. в твердой фазе содержание одного из металлов не может превысить некий предел. В этом случае при полном затвердевании расплава из двух металлов образуется неоднородный сплав, состоящий из двух твердых фаз, одна из которых представляет собой насыщенный раствор первого металла во втором, а другая – насыщенный раствор второго металла в первом. Иногда растворимость настолько ничтожна, что отдельные твердые фазы образовавшегося сплава можно считать состоящими практически из индивидуальных металлов.
Многие металлы, взаимно растворимые в расплавленном состоянии, при охлаждении образуют смесь кристаллов с различной кристаллической решеткой. Температура плавления (Тпл) такой смеси меньше Тплотдельных компонентов.
Состав, имеющий минимальную Тпл, называется эвтектикой. Эвтектический сплав состоит из мельчайших кристаллов индивидуальных компонентов. Его образуют металлы очень близкие по природе, но существенно отличающиеся по типу кристаллической решетки, например, Рb – Sn, Pb – Sb, Cd – Bi, Sn – Zn. Эвтектические сплавы имеют высокую твердость и прочность.
В некоторых случаях при взаимодействии двух металлов образуются химические соединения, именуемые интерметаллидами. Большинство этих соединений устойчивы только в твердом состоянии, так как их формульный состав не соответствует классическим представлениям о валентности элементов, например, TiBe12. Очень часто интерметаллиды имеют переменный состав, так как в твердом состоянии способны растворяться в металлах и других интерметаллических соединениях.
Интерметаллиды представляют собой соединения с металлической связью между входящими в их состав атомами. Термическая прочность таких соединений невысока: большинство из них при плавлении частично или полностью разлагается.
Интерметаллические соединения выглядят как металлоподобные вещества. Однако типичные для металлов физические свойства у интерметаллидов проявляются слабее. Обычно у них и электропроводность меньше, чем у компонента с низшей электрической проводимостью, и теплопроводность, и блеск, и пластичность существенно уступают соответствующим элементарным металлам. По химическим же свойствам интерметаллиды им подобны. Некоторые сравнительно прочные интерметаллические соединения в расплавленном состоянии могут подвергаться электролизу, причем на катоде выделяется более активный металл, на аноде – менее активный.
Металлические сплавы можно получить разными способами. Например, спеканием, суть которого заключается в том, что при высокой температуре и под большим давлением в смеси порошкообразных металлов осуществляется их взаимная диффузия.
Другой способ получения металлических сплавов – электролиз смеси электролитов, при котором на катоде одновременно восстанавливаются ионы двух или более металлов.
Кроме того, металлические сплавы образуются при возгонке нескольких металлов, когда из смеси паров происходит одновременная конденсация, сопровождающаяся взаимной диффузией компонентов друг в друга.
Композиционные материалы. Композиты получают путем объемного сочетания химически разнородных компонентов при сохранении между ними границы раздела. Свойства композитов существенно отличаются от свойств входящих в них компонентов.
Композиты состоят из основы (матрицы) и добавок (порошки, волокна, стружка). В качестве основы используют металлы, керамику, полимеры.
- Если основой служат металлы, то добавками могут быть металлические нитевидные кристаллы, неорганические волокна и порошки: Al2O3, SiO2 и т. д.
- Если основой является керамика, то добавками выступают металлы. Например, основа – Al2O3, Cr2O3, MgO, ZrO2 и т. д., добавки – Mo, W, Ta, Ni, Co. Такие композиты называются керамико-металлическими материалами (керметами).
Композиты характеризуются высокой прочностью, твердостью, износостойкостью, благодаря чему их используют в качестве конструкционных материалов, контактов, подшипников, инструментов и т. д.
5. Распространение в природе и способы получения металлов
Значительная часть металлов находится в земной коре в виде различных соединений, и только малоактивные (благородные) встречаются в свободном или самородном состоянии.
Содержание наиболее распространенных металлов в земной коре можно представить следующим образом (масс. %): алюминий – 8,45; железо – 4,4; кальций – 3,3; натрий – 2,6; калий – 2,5; магний – 2,1; титан – 0,61.
Из природных соединений металлов в большей степени распространены оксиды, входящие в состав горных пород, и сульфиды (железа, никеля, меди, цинка и др.). Встречаются также фториды и хлориды – преимущественно щелочных и щелочноземельных металлов. Некоторые металлы присутствуют в виде солей кислородсодержащих кислот (карбонаты, силикаты, сульфаты, фосфаты и т. д.).
Главным источником получения металлов являются руды – скопления металлосодержащих минералов, входящих в состав горных пород. Металлы в составе руд находятся в окисленном состоянии, поэтому основным способом их получения является процесс восстановления. Если в руде содержатся разные металлы, ее подвергают расщеплению на отдельные соединения металлов путем химической обработки. Так, при воздействии на полиметаллические руды хлора (в присутствии восстановителя) образуются хлориды нескольких металлов, которые благодаря разной степени летучести могут быть отделены друг от друга и от непрохлорированной части руды. Чистые хлориды ряда металлов восстанавливают активными металлами до свободных металлов.
Иногда сложные полиметаллические руды с целью получения сложных сплавов подвергают восстановлению без предварительного разделения. Поскольку они бывают загрязнены так называемой пустой породой, которая затрудняет восстановление, то процессу получения металла предшествует очистка руды или ее обогащение механическими, химическими, физико-химическими и другими методами. Из физико-химических наибольшее распространение получил метод флотации, основанный на различной смачиваемости водой частиц смеси различных материалов.
Чистые оксиды металлов легче и удобнее поддаются процессу восстановления. В связи с этим водные оксиды обезвоживают, а сульфидные руды переводят в оксидные путем окислительного обжига.
Руды с небольшим содержанием металлов подвергают гидрометаллургической переработке водными растворами кислот или щелочей. При этом соединения некоторых металлов переходят в раствор.
Таким образом, наиболее распространенными способами получения металлов являются пирометаллургия и гидрометаллургия.
1. Пирометаллургия – восстановление металлов, при котором в качестве восстановителей используют углерод (карботермия), водород, металлы-восстановители (металлотермия):
WO3 + 3H2 = W + 3H2O; CuS + O2 = CuO + SO2; CuO + H2 = Cu + H2O; BeF2 + Mg = Be + MgF2.
Если при восстановлении соединений металлов используется алюминий, метод получения называется алюмотермией. Алюмотермические методы применяют при извлечении из оксидов тугоплавких металлов (ванадий, хром, молибден и др.). Иногда в качестве восстановителя требуется магний. Метод магнийтермии нашел применение при получении титана, циркония, тантала из хлоридов этих металлов.
Углерод по своей восстановительной активности уступает многим металлам. Тем не менее, карботермия имеет широкое распространение при восстановлении металлов малой активности (медь) и средней (железо, цинк, свинец).
2. Гидрометаллургия – восстановление металлов, протекающее из водных растворов их солей при обычной температуре. При этом восстанавливаемый металл находится в мелкораздробленном состоянии. В качестве восстановителей используют активные металлы.
3. Электрометаллургия – процесс получения металлов под воздействием постоянного электрического тока, протекающего через раствор или расплав соли металла:
AgNO3 + H2O → Ag + O2 + HNO3.
Электролизом водных растворов получают сравнительно малоактивные металлы (медь, серебро, никель и т. д.). А электролизом расплавов солей – высокоактивные (щелочные и щелочноземельные металлы, алюминий).
Получение чистых металлов. Некоторые отрасли промышленности и техники нуждаются в металлах особой чистоты. Например, они востребованы при конструировании ядерных реакторов, в электронной и медицинской технике. Особо чистые металлы отличаются по своим физическим свойствам от обычных. Такие свойства, как пластичность, электро- и теплопроводность, а также сопротивление коррозии у чистых металлов имеют более высокие значения.
В настоящее время проблема получения чистых и сверхчистых металлов решается разными способами.
- Электролитическое рафинирование – процесс электролиза с использованием чернового металла в качестве анода (активного). При пропускании постоянного электрического тока через электролит черновой металл окисляется (растворяется), а на катоде, изготовленном из чистого металла, из раствора (расплава) восстанавливается (осаждается) металл.
- Термическая диссоциация летучих соединений – очистка, основанная на способности некоторых соединений металлов разлагаться при высокой температуре. Например, иодиды титана и циркония, являясь летучими соединениями, при повышении температуры разлагаются на чистый металл и йод.
- Зонная плавка – процесс, основанный на различной степени растворимости примесей в твердом и расплавленном состояниях. Через зону с высокой температурой медленно продвигают стержень из очищаемого металла. По мере продвижения расплавленная область, где собираются все примеси, постепенно перемещается в конец стержня, который входит в горячую зону последним. Операцию повторяют многократно, каждый раз механически отделяя от чистого металла конец стержня, содержащий примеси.
Просмотров: 6 825
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции в изменении металлических и неметаллических характеристик Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга. Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
- Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами обычно имеют ионную природу . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод.) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Электропроводность : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать электроны или делиться ими с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и превращаясь в анионы:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, который растворяется в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабую кислотность (углекислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при определенных условиях, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупким, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента этой группы может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к снижению по мере того, как мы перемещаемся вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
Плотность материи Рона Куртуса
SfC Главная> Физика> Материя>
Рона Куртуса (редакция 17 декабря 2014 г.)
Плотность количества материи — это ее масса, деленная на ее объем.Обычно его измеряют при 0 ° C и давлении 1 атмосфера.
Плотность важна для определения плавучести материалов во флюдах, а также при сравнении материалов и других измерениях.
Стандартная единица плотности — кг / м 3 . Однако они также могут быть плотностью г / см 3 , а также кг / л и фунтов / фут 3 . Газы обычно указываются в кг / м 3 , а жидкости и твердые вещества указываются в г / см 3 .
Плотность различных материалов составляет от 19,3 г / см 3 для золота до 0,09 кг / м 3 для водорода.
Вопросы, которые могут у вас возникнуть:
- Что такое уравнение плотности?
- Какие единицы плотности?
- Какова плотность различных материалов?
Этот урок ответит на эти вопросы. Полезный инструмент: Преобразование единиц
Уравнение плотности
Плотность материала — это его масса, деленная на его объем.Уравнение плотности:
ρ = м / В
где:
- ρ — плотность ( ρ — греческая буква rho )
- м — масса
- V — это объем
- м / V — это м , деленное на V
На объем материала влияют его температура и давление на материал.Таким образом, плотность может изменяться при разных температурах и давлениях.
Также обратите внимание, что масса — это не вес, а масса, на которую действует сила тяжести. При одинаковых условиях давления и температуры плотность материала на Земле, Луне и Марсе одинакова, даже если вес будет разным из-за различных сил тяжести.
Единицы плотности
Единицы измерения плотности зависят от того, какую систему измерения вы используете.
Метрические единицы
Международные единицы (СИ) для плотности — килограммы на кубический метр ( кг / м 3 ).
Если плотность велика — например, в случае с твердыми телами — метрические единицы измерения плотности могут быть указаны в граммах на кубический сантиметр ( г / см 3 ).
Обратите внимание на , что иногда см 3 обозначается как куб.см для кубических сантиметров.
Преобразование кг / м 3 в г / см 3 выглядит следующим образом:
1000 г = 1 кг
100 см = 1 м
1000000 см 3 = 1 м 3
Таким образом:
1 кг / м 3 = 1000 г / 1000000 см 3
1 кг / м 3 = (1/1000) г / см 3
или
1 г / см 3 = 1000 кг / м 3
Например, если плотность золота 19,300 кг / м 3 , лучше всего указать, что плотность равна 19.3 г / см 3 . Просто разделите значение кг / м 3 на 1000, чтобы получить значение г / см 3 .
Плотность воды
Определения размеров кубического сантиметра и грамма были сделаны таким образом, что плотность воды в метрической системе равна 1. Было определено, что 1 кубический сантиметр воды весит 1 грамм. Таким образом, плотность чистой воды составляет:
ρ = m / V = 1 грамм / 1 куб.см = 1.0 г / см 3
Поскольку количество воды изменяется в зависимости от температуры, 4 ° C, точка, в которой вода наиболее сжатая, была выбрана в качестве температуры воды для этого измерения.
Жидкости
Жидкости часто составляют килограммы на литр ( кг / л ) или граммы на миллилитр ( г / мл ). Миллилитр — это объем жидкости, равный 1 см 3 .
Литр равен 1000 мл , а это 1 L = 1000 см 3 .Причина, по которой для определения плотности жидкостей используются литры и миллилитры, заключается в том, что объем легко измерить, налив жидкость в стандартный контейнер.
английские единицы
Английские, британские или американские единицы измерения — фунты на кубический фут (фунт / фут 3 ) или фунты на кубический дюйм ( фунт / дюйм 3 ). Но учтите, что фунты — это вес, а не масса, и с этим обозначением может возникнуть некоторая путаница.
Преобразование из английских в метрические единицы:
1 фунт / фут 3 = 16.02 кг / м 3
Различные единицы могут сбивать с толку, но вы должны убедиться, что вы единообразны в том, какой из них вы используете.
График плотности
Следующая таблица позволяет сравнивать плотность различных материалов при одинаковых условиях атмосферного давления и температуры (если не указано иное).
Плотность твердых тел и жидкостей обычно указывается в г / см 3 , а плотность газов обычно указывается в кг / м 3 .
| Государство | Материал | Плотность (г / см 3 ) |
|---|---|---|
| Твердые вещества | ||
| Золото | 19,3 | |
| Утюг | 7,8 | |
| Алюминий | 2,7 | |
| Лед (0 ° C) | 0.92 | |
| Жидкости | ||
| Меркурий | 13,6 | |
| Морская вода | 1,03 | |
| Вода (5 ° C) | 1,00 | |
| Спирт этиловый | 0,81 | |
| Газы | (при нормальном давлении и заданная температура) | Плотность (кг / м 3 ) |
| Воздух (0 ° C) | 1.29 | |
| Воздух (10 ° C) | 1,25 | |
| Водород (0 ° C) | 0,090 | |
| Гелий (0 ° C) | 0,178 |
Как видите, морская вода немного плотнее чистой. Вот почему в морской воде вещи плавают лучше, чем в обычной.
Также вы можете видеть, что более теплый воздух менее плотный, чем холодный.Вот почему поднимается теплый воздух. Гелий менее плотен, чем воздух, поэтому воздушные шары с гелием поднимаются.
Сводка
Плотность материи — это ее масса, деленная на ее объем. Уравнение: ρ = m / V . Единицами плотности обычно являются кг / м 3 , но они также могут иметь другие обозначения, которые могут быть более удобными. Плотность различных материалов варьируется от больших значений для тяжелых металлов до очень малых значений для газов.
Будьте как можно лучше
Ресурсы и ссылки
Полномочия Рона Куртуса
Сайтов
Материальные ресурсы
Физические ресурсы
Книги
Книги по теме с самым высоким рейтингом
Книги по физике с самым высоким рейтингом
Книги по науке о плотности с самым высоким рейтингом
Вопросы и комментарии
У вас есть вопросы, комментарии или мнения по этой теме? Если это так, отправьте свой отзыв по электронной почте.Я постараюсь вернуться к вам как можно скорее.
Поделиться страницей
Нажмите кнопку, чтобы добавить эту страницу в закладки или поделиться ею через Twitter, Facebook, электронную почту или другие службы:
Студенты и исследователи
Веб-адрес этой страницы:
www.school-for-champions.com/science/
density.htm
Пожалуйста, включите его в качестве ссылки на свой веб-сайт или в качестве ссылки в своем отчете, документе или диссертации.
Авторские права © Ограничения
Где ты сейчас?
Школа чемпионов
По физике
Плотность вещества
определение металла и синонимов металла (английский)
| Щелочные металлы | |
|---|---|
| литий, натрий, калий | |
| рубидий, цезий, франций | |
| Щелочноземельные металлы | |
| бериллий, магний, кальций | |
| стронций, барий, радий | |
| Переходные металлы | |
| цинк, молибден, кадмий | |
| скандий, титан, ванадий | |
| хром, марганец, железо | |
| кобальт, никель, медь | |
| иттрий, цирконий, ниобий | |
| технеций, рутений, родий | |
| палладий, серебро, гафний | |
| тантал, вольфрам, рений | |
| осмий, иридий, платина | |
| золото, ртуть, резерфордий, | |
| дубний, сиборгий, борий, | |
| хассий, коперниций | |
| Металлы после перехода | |
| алюминий, галлий, индий, олово | |
| таллий, свинец, висмут | |
| Лантаноиды | |
| лантан, церий, празеодим | |
| неодим, прометий, самарий | |
| европий, гадолиний, тербий | |
| диспрозий, гольмий, эрбий | |
| тулий, иттербий, лютеций | |
| Актиниды | |
| актиний, торий, протактиний | |
| уран, нептуний, плутоний | |
| америций, кюрий, берклий | |
| калифорний, эйнштейний, фермий | |
| менделевий, нобелий, лоуренсий | |
| Элементы, которые, возможно, являются металлами | |
| мейтнерий, дармштадций, рентгений | |
| унунтриум, флеровий | |
| унунпентиум, ливерморий | |
| Элементы, которые иногда считают металлами | |
| германий, мышьяк, сурьма, полоний, астатин | |
Металл (от греческого «μέταλλον» — métallon , «шахта, карьер, металл» [1] [2] ) — это элемент, соединение или сплав, который является хорошим проводником и электричество, и тепло.Металлы обычно пластичные и блестящие, то есть они отражают большую часть падающего света. [3] В металле атомы легко теряют электроны с образованием положительных ионов (катионов). Эти ионы окружены делокализованными электронами, которые ответственны за проводимость. Полученное таким образом твердое тело удерживается электростатическими взаимодействиями между ионами и электронным облаком, которые называются металлическими связями. [4]
Определение
Металлы иногда описывают как расположение положительных ионов, окруженное морем делокализованных электронов.Металлы занимают основную часть таблицы Менделеева, а неметаллические элементы можно найти только в ее правой части. Диагональная линия, проведенная от бора (B) к полонию (Po), отделяет металлы от неметаллов. Большинство элементов в этой линейке — металлоиды, иногда называемые полупроводниками. Это связано с тем, что эти элементы обладают электрическими свойствами, общими как для проводников, так и для изоляторов. Элементы в нижнем левом углу этой разделительной линии называются металлами, а элементы в верхнем правом углу разделительной линии называются неметаллами.
Альтернативное определение металла относится к ленточной теории. Если заполнить энергетические зоны материала доступными электронами и получить частично заполненную верхнюю зону, то материал будет металлом. Это определение открывает категорию металлических полимеров и других органических металлов. Эти синтетические материалы часто обладают характерной серебристо-серой отражающей способностью (блеском) элементарных металлов.
Астрономия
Основная статья: МеталличностьВ специализированном использовании астрономии и астрофизики термин «металл» часто используется для обозначения всех элементов, кроме водорода или гелия, включая такие химически неметаллические вещества, как неон, фтор и кислород.Почти весь водород и гелий во Вселенной были созданы в результате нуклеосинтеза Большого взрыва, тогда как все «металлы» были произведены нуклеосинтезом в звездах или сверхновых. Солнце и Галактика Млечный Путь состоят из примерно 74% водорода, 24% гелия и 2% «металлов» (остальные элементы; атомные номера 3–118) по массе. [5]
Концепция металла в обычном химическом смысле не имеет отношения к звездам, поскольку химические связи, которые придают элементам их свойства, не могут существовать при температурах звезды.
Недвижимость
Химическая промышленность
Металлы обычно склонны к образованию катионов из-за потери электронов, [4] реагируют с кислородом воздуха с образованием оксидов в течение изменяющихся временных масштабов (железо ржавеет годами, а калий горит за секунды). Примеры:
- 4 Na + O 2 → 2 Na 2 O (оксид натрия)
- 2 Ca + O 2 → 2 CaO (оксид кальция)
- 4 Al + 3 O 2 → 2 Al 2 O 3 (оксид алюминия).
Переходным металлам (таким как железо, медь, цинк и никель) требуется гораздо больше времени для окисления. Другие, такие как палладий, платина и золото, вообще не вступают в реакцию с атмосферой. Некоторые металлы образуют на своей поверхности барьерный слой оксида, через который не могут проникнуть другие молекулы кислорода и, таким образом, сохраняют свой блестящий внешний вид и хорошую проводимость в течение многих десятилетий (например, алюминий, магний, некоторые стали и титан). Оксиды металлов обычно являются основными, в отличие от оксидов неметаллов, которые являются кислыми.
Покраска, анодирование или покрытие металлов — хорошие способы предотвратить их коррозию. Однако для покрытия должен быть выбран более химически активный металл в электрохимическом ряду, особенно когда ожидается скалывание покрытия. Вода и два металла образуют электрохимическую ячейку, и если покрытие менее реактивно, чем покрытие, покрытие фактически способствует коррозии .
Физический
Металлы в целом обладают высокой электропроводностью, которая зависит от их ионной валентности, теплопроводности, блеска и плотности, а также способности деформироваться под действием напряжения без раскалывания. [4] Хотя есть несколько металлов с низкой плотностью, твердостью и температурой плавления, они (щелочные и щелочноземельные металлы) чрезвычайно реактивны и редко встречаются в их элементарной, металлической форме. С оптической точки зрения металлы непрозрачны, блестят и блестят. Это связано с тем, что видимые световые волны не проходят через основную часть их микроструктуры. Большое количество подвижных электронов в любом типичном металлическом твердом теле (элементе или сплаве) является причиной того, что они никогда не могут быть отнесены к категории прозрачных материалов.
Большинство металлов имеют более высокую плотность, чем большинство неметаллов. [4] Тем не менее, плотность металлов сильно различается; литий — наименее плотный твердый элемент, а осмий — самый плотный. Металлы групп I A и II A называются легкими металлами, поскольку они являются исключениями из этого обобщения. [4] Высокая плотность большинства металлов обусловлена плотноупакованной кристаллической решеткой металлической структуры. Прочность металлических связей для различных металлов достигает максимума вокруг центра ряда переходных металлов, поскольку эти элементы имеют большое количество делокализованных электронов в металлических связях с сильной связью.Однако другие факторы (такие как атомный радиус, заряд ядра, количество связывающих орбиталей, перекрытие орбитальных энергий и форма кристалла) также участвуют. [4] . Большинство цветных металлов можно повторно использовать повторно в течение их жизненного цикла.
Электрооборудование
Электро- и теплопроводность металлов обусловлена тем фактом, что в металлической связи внешние электроны атомов металла образуют газ, состоящий из почти свободных электронов, движущихся как электронный газ на фоне положительного заряда, образованного ионными остовами.Хорошие математические предсказания для электропроводности, а также вклада электронов в теплоемкость и теплопроводность металлов могут быть рассчитаны на основе модели свободных электронов, которая не принимает во внимание детальную структуру ионной решетки.
При рассмотрении точной зонной структуры и энергии связи металла необходимо учитывать положительный потенциал, вызванный особым расположением ионных остовов, который в кристаллах является периодическим.Важнейшим следствием периодического потенциала является образование небольшой запрещенной зоны на границе зоны Бриллюэна. Математически потенциал ионных остовов можно рассматривать с помощью различных моделей, самой простой из которых является модель почти свободных электронов.
Механический
Механические свойства металлов включают пластичность, которая во многом обусловлена присущей им способностью к пластической деформации. Обратимая упругая деформация в металлах может быть описана законом Гука для восстанавливающих сил, где напряжение линейно пропорционально деформации.Силы, превышающие предел упругости или нагрев, могут вызвать необратимую (необратимую) деформацию объекта, известную как пластическая деформация или пластичность. Это необратимое изменение расположения атомов может произойти в результате:
Вязкое течение вблизи границ зерен, например, может вызвать внутреннее скольжение, ползучесть и усталость металлов. Он также может способствовать значительным изменениям микроструктуры, таким как рост зерен и локальное уплотнение, за счет устранения межзеренной пористости.Винтовые дислокации могут скользить в направлении любой плоскости решетки, содержащей дислокацию, в то время как основная движущая сила для «подъема дислокации» — это движение или диффузия вакансий через кристаллическую решетку.
Кроме того, считается, что ненаправленный характер металлической связи существенно влияет на пластичность большинства металлических твердых тел. Когда плоскости ионной связи скользят друг мимо друга, результирующее изменение положения сдвигает ионы с одинаковым зарядом в непосредственную близость, что приводит к расколу кристалла; такой сдвиг не наблюдается в кристаллах с ковалентными связями, где происходит разрушение и фрагментация кристаллов. [6]
Сплавы
Сплав — это смесь двух или более элементов в твердом растворе, в котором основным компонентом является металл. Большинство чистых металлов слишком мягкие, хрупкие или химически активные для практического использования. Комбинирование металлов в различных соотношениях в качестве сплавов изменяет свойства чистых металлов для получения желаемых характеристик. Обычно цель изготовления сплавов — сделать их менее хрупкими, твердыми, устойчивыми к коррозии или иметь более желаемый цвет и блеск.Из всех металлических сплавов, используемых сегодня, сплавы железа (сталь, нержавеющая сталь, чугун, инструментальная сталь, легированная сталь) составляют самую большую долю как по количеству, так и по коммерческой стоимости. Железо, легированное углеродом в различных пропорциях, дает низко-, средне- и высокоуглеродистые стали с повышенным содержанием углерода, снижающим пластичность и вязкость. Добавление кремния приводит к получению чугунов, а добавление хрома, никеля и молибдена к углеродистой стали (более 10%) дает нержавеющие стали.
Другими важными металлическими сплавами являются сплавы алюминия, титана, меди и магния. Медные сплавы были известны с доисторических времен — бронза дала название бронзовому веку — и сегодня они находят множество применений, особенно в электропроводке. Сплавы трех других металлов были разработаны относительно недавно; из-за своей химической активности они требуют процессов электролитической экстракции. Сплавы алюминия, титана и магния ценятся за их высокое отношение прочности к массе; магний также может обеспечивать электромагнитное экранирование [ необходима ссылка ] .Эти материалы идеальны для ситуаций, когда высокое отношение прочности к весу более важно, чем стоимость материала, например, в аэрокосмической и автомобильной промышленности.
Сплавы, специально разработанные для высокоточных применений, таких как реактивные двигатели, могут содержать более десяти элементов.
КатегорииНедрагоценный металл
Цинк, основной металл, реагирует с кислотой
В химии термин основной металл неофициально используется для обозначения металла, который относительно легко окисляется или корродирует и по-разному реагирует с разбавленной соляной кислотой (HCl) с образованием водорода.Примеры включают железо, никель, свинец и цинк. Медь считается основным металлом, поскольку она относительно легко окисляется, хотя не реагирует с HCl. Обычно он используется в противопоставлении благородному металлу.
В алхимии базовый металл был обычным и недорогим металлом в отличие от драгоценных металлов, в основном золота и серебра. Давней целью алхимиков было превращение неблагородных металлов в драгоценные.
В нумизматике ценность монет определялась в первую очередь содержанием драгоценных металлов.Большинство современных валют — это фиатная валюта, что позволяет изготавливать монеты из основного металла .
Черный металл
Основная статья: Черные и цветные металлыТермин «железо» происходит от латинского слова, означающего «содержащий железо». Это может быть чистое железо, такое как кованое железо, или сплав, такой как сталь. Черные металлы часто бывают магнитными, но не только.
Благородный металл
Основная статья: Благородный металлБлагородные металлы — это металлы, устойчивые к коррозии и окислению, в отличие от большинства неблагородных металлов.Это, как правило, драгоценные металлы, часто из-за кажущейся редкости. Примеры включают золото, платину, серебро и родий.
Драгоценный металл
Золотой самородок
Основная статья: Драгоценный металлA драгоценный металл — редкий металлический химический элемент высокой экономической ценности.
В химическом отношении драгоценные металлы обладают меньшей реакционной способностью, чем большинство элементов, имеют высокий блеск и высокую электропроводность. Исторически драгоценные металлы были важны как валюта, но теперь рассматриваются в основном как инвестиционные и промышленные товары.Золото, серебро, платина и палладий имеют код валюты ISO 4217. Самые известные драгоценные металлы — золото и серебро. Хотя оба имеют промышленное применение, они более известны своим использованием в искусстве, ювелирных изделиях и чеканке монет. Другие драгоценные металлы включают металлы платиновой группы: рутений, родий, палладий, осмий, иридий и платину, из которых платина является наиболее продаваемой.
Спрос на драгоценные металлы определяется не только их практическим использованием, но и их ролью в качестве инвестиций и средства сбережения.По состоянию на лето 2006 года палладий стоил чуть меньше половины цены золота, а платина — примерно вдвое дороже золота. Серебро значительно дешевле этих металлов, но часто традиционно считается драгоценным металлом из-за его роли в чеканке монет и ювелирных изделий.
Металлы часто извлекаются из Земли путем добычи полезных ископаемых, в результате чего руды являются относительно богатыми источниками необходимых элементов. Руды локализуются поисковыми методами с последующей разведкой и изучением месторождений.Источники полезных ископаемых обычно делятся на открытые рудники, которые разрабатываются путем выемки грунта с использованием тяжелого оборудования, и подземные рудники.
После добычи руды необходимо извлечь металлы, обычно путем химического или электролитического восстановления. Пирометаллургия использует высокие температуры для превращения руды в сырые металлы, а гидрометаллургия использует водную химию для той же цели. Используемые методы зависят от металла и его загрязнителей.
Когда металлическая руда представляет собой ионное соединение этого металла и неметалла, руда обычно должна плавиться — нагреваться с восстановителем — для извлечения чистого металла.Многие обычные металлы, такие как железо, плавятся с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют коммерчески практичного восстановителя и вместо этого извлекаются с помощью электролиза. [7] [8]
Сульфидные руды не восстанавливаются непосредственно до металла, а обжигаются на воздухе для преобразования их в оксиды.
Переработка металлов
Спрос на металлы тесно связан с экономическим ростом. В течение 20 века разнообразие использования металлов в обществе быстро росло.Сегодня развитие крупных стран, таких как Китай и Индия, и достижения в области технологий подпитывают еще больший спрос. В результате увеличивается объем добычи полезных ископаемых, и все больше и больше мировых запасов металлов используются над землей, а не под землей в качестве неиспользованных запасов. Примером может служить используемый запас меди. Между 1932 и 1999 годами потребление меди в США выросло с 73 г до 238 г на человека. [9]
Металлы по своей природе пригодны для вторичной переработки, поэтому, в принципе, их можно использовать снова и снова, сводя к минимуму негативное воздействие на окружающую среду и одновременно экономя энергию.Например, 95% энергии, используемой для производства алюминия из бокситовой руды, экономится за счет использования переработанного материала. [10] Однако уровень рециркуляции металлов в целом низкий. В 2010 году Международная группа по ресурсам, организованная Программой Организации Объединенных Наций по окружающей среде (ЮНЕП), опубликовала отчеты о запасах металлов, существующих в обществе [11] , и о степени их переработки. [12]
Авторы отчета отметили, что запасы металла в обществе могут служить огромными шахтами над землей.Тем не менее, они предупредили, что скорость переработки некоторых редких металлов, используемых в таких приложениях, как мобильные телефоны, аккумуляторные батареи для гибридных автомобилей и топливные элементы, настолько низка, что, если в будущем скорость переработки отходов в конце срока службы не будет значительно увеличена, эти критически важные металлы станут недоступны для использования в современной технике.
Металлургия
Металлургия — это область материаловедения, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.
Приложения
Некоторые металлы и металлические сплавы обладают высокой структурной прочностью на единицу массы, что делает их полезными материалами для выдерживания больших нагрузок или сопротивления ударным повреждениям. Металлические сплавы могут иметь высокое сопротивление сдвигу, крутящему моменту и деформации. Однако тот же металл также может быть уязвим к усталостному повреждению при многократном использовании или в результате внезапного разрушения под напряжением при превышении допустимой нагрузки. Прочность и устойчивость металлов привели к их частому использованию в строительстве высотных зданий и мостов, а также в производстве большинства транспортных средств, многих бытовых приборов, инструментов, труб, неосвещенных указателей и железнодорожных путей.
Два наиболее часто используемых конструкционных металла, железо и алюминий, также являются наиболее распространенными металлами в земной коре. [13]
Металлы являются хорошими проводниками, что делает их ценными в электрических приборах и для передачи электрического тока на расстояние с небольшими потерями энергии. Электросети используют металлические кабели для распределения электроэнергии. Домашние электрические системы по большей части имеют медный провод из-за его хороших проводящих свойств.
Теплопроводность металла полезна для контейнеров для нагрева материалов над пламенем.Металл также используется в радиаторах для защиты чувствительного оборудования от перегрева.
Высокая отражательная способность некоторых металлов важна для изготовления зеркал, включая точные астрономические инструменты. Последнее свойство также может сделать металлические украшения эстетически привлекательными.
Некоторые металлы имеют специальное применение; радиоактивные металлы, такие как уран и плутоний, используются на атомных электростанциях для производства энергии посредством ядерного деления. Ртуть представляет собой жидкость при комнатной температуре и используется в переключателях для замыкания цепи, когда она протекает через контакты переключателя.Сплав с памятью формы используется для изготовления труб, крепежных элементов и сосудистых стентов.
Торговля
Импорт металла и руды в 2005 г.Всемирный банк сообщает, что Китай был крупнейшим импортером руд и металлов в 2005 году, за ним следуют США и Япония. [14]
История
Природа металлов очаровывала человечество на протяжении многих веков, потому что эти материалы давали людям инструменты с непревзойденными свойствами как на войне, так и при их приготовлении и обработке. (на немецком языке) Der Große Brockhaus . 7: L-MIJ (Шестнадцатое, совершенно новое издание). Висбаден: Bibliographisches Institut & F. A. Brockhaus. 1955. с. 715. .



 При определении плотности по данным
рентгенографического анализа используется
связь значений плотности вещества с
атомными массами составляющих его
элементов и объемом, занимаемым ими.
При определении плотности по данным
рентгенографического анализа используется
связь значений плотности вещества с
атомными массами составляющих его
элементов и объемом, занимаемым ими. Справочные значения плотности, как
правило, будут отличаться от
рентгенографической в меньшую или
большую сторону. Эта разница может быть
вызвана наличием в реальных кристаллах
примесей, дефектов кристаллической
решетки, внутренних напряжений
Справочные значения плотности, как
правило, будут отличаться от
рентгенографической в меньшую или
большую сторону. Эта разница может быть
вызвана наличием в реальных кристаллах
примесей, дефектов кристаллической
решетки, внутренних напряжений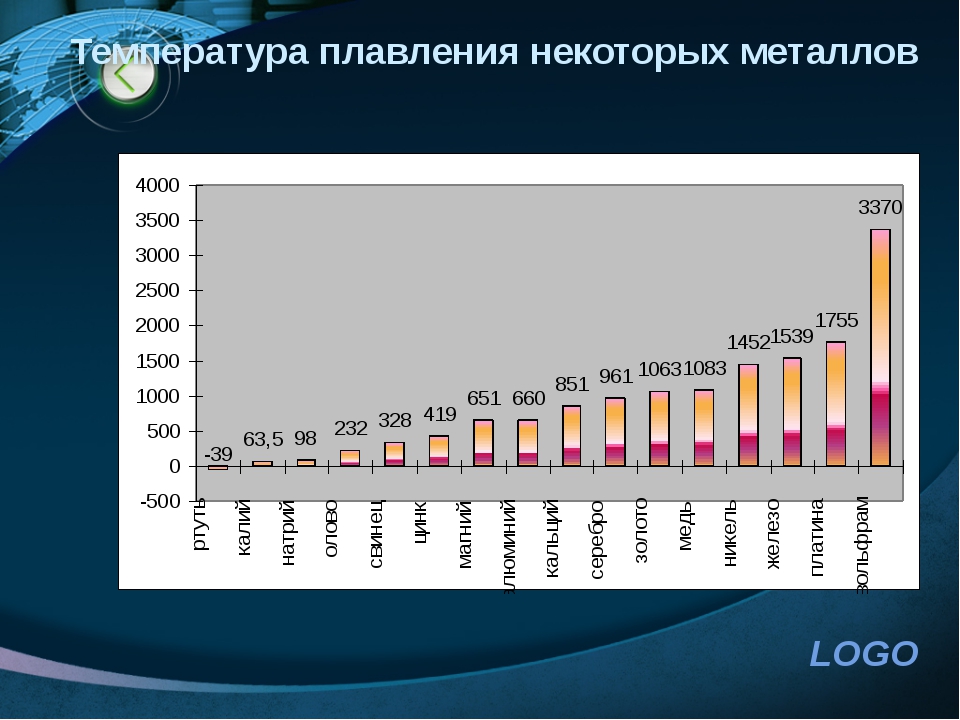
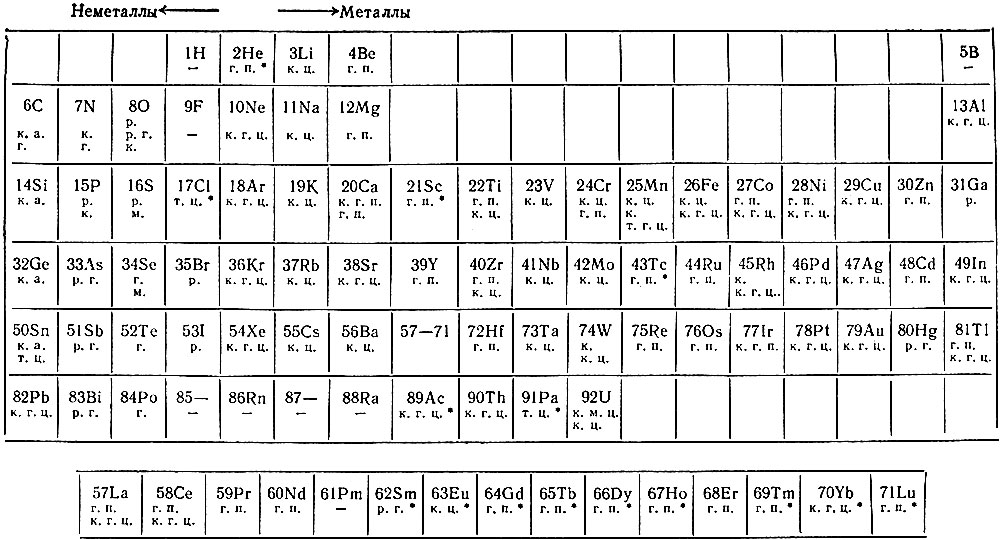
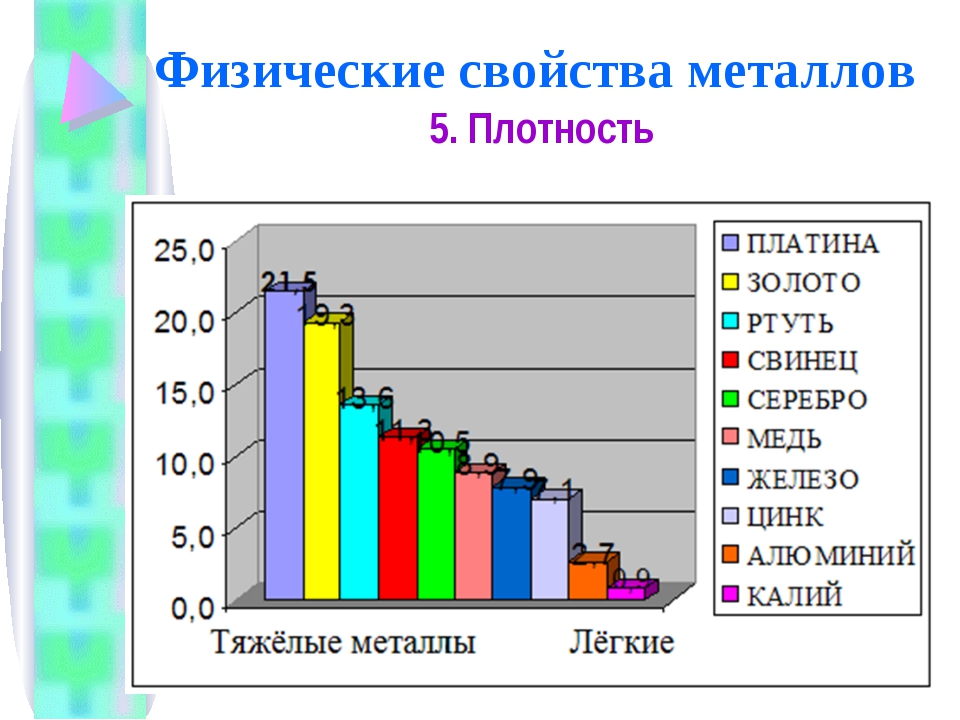 Сплавы железа с
углеродом (стали, чугуны) и с другими
металлами используется во всех отраслях
экономики
Сплавы железа с
углеродом (стали, чугуны) и с другими
металлами используется во всех отраслях
экономики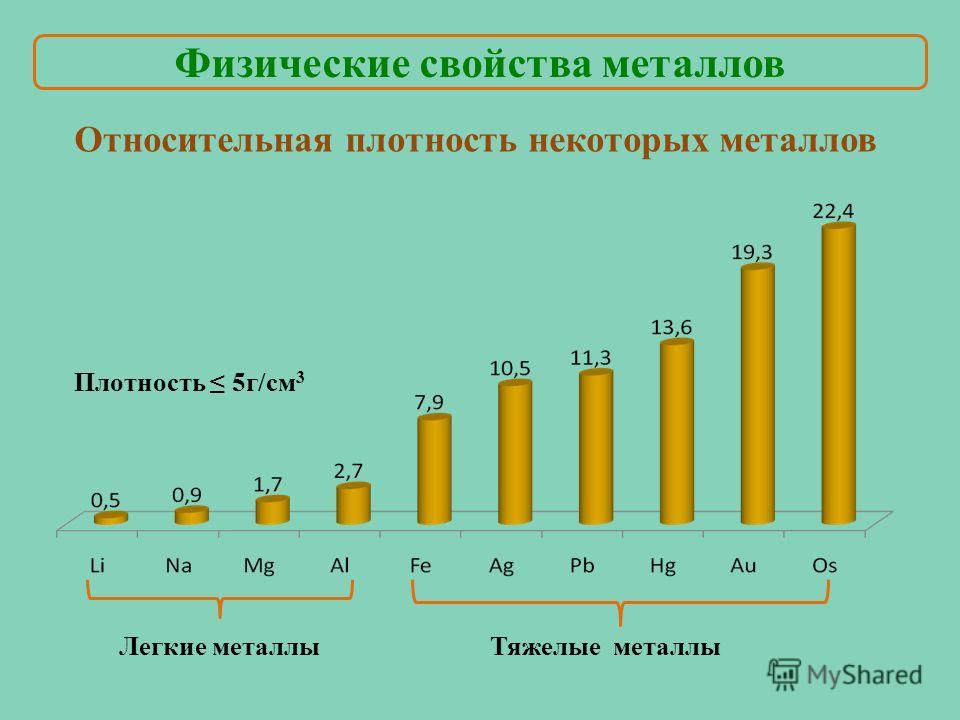 Применяется в
пиротехнике и химической промышленности.
Сплавы на основе магния широко
используются в авиационной и ракетной
технике
Применяется в
пиротехнике и химической промышленности.
Сплавы на основе магния широко
используются в авиационной и ракетной
технике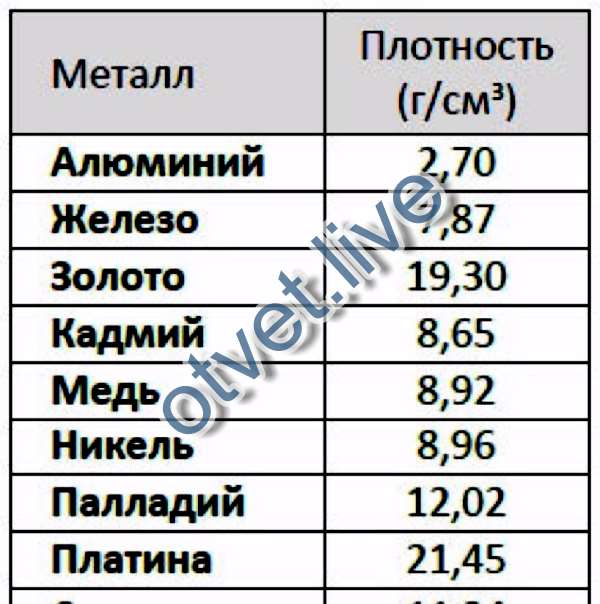 Мягкий, легкий,
легкоплавкий (температура плавления
97,83˚C) Применяют для получения чистых
металлов; как теплоноситель в ядерных
реакторах. Участвует в минеральном
обмене всех живых организмов
Мягкий, легкий,
легкоплавкий (температура плавления
97,83˚C) Применяют для получения чистых
металлов; как теплоноситель в ядерных
реакторах. Участвует в минеральном
обмене всех живых организмов Химически
очень активен. Применяется как активный
восстановитель металлов из их
соединений; для раскисления сталей,
бронз. Препараты кальция используются
в медицине
Химически
очень активен. Применяется как активный
восстановитель металлов из их
соединений; для раскисления сталей,
бронз. Препараты кальция используются
в медицине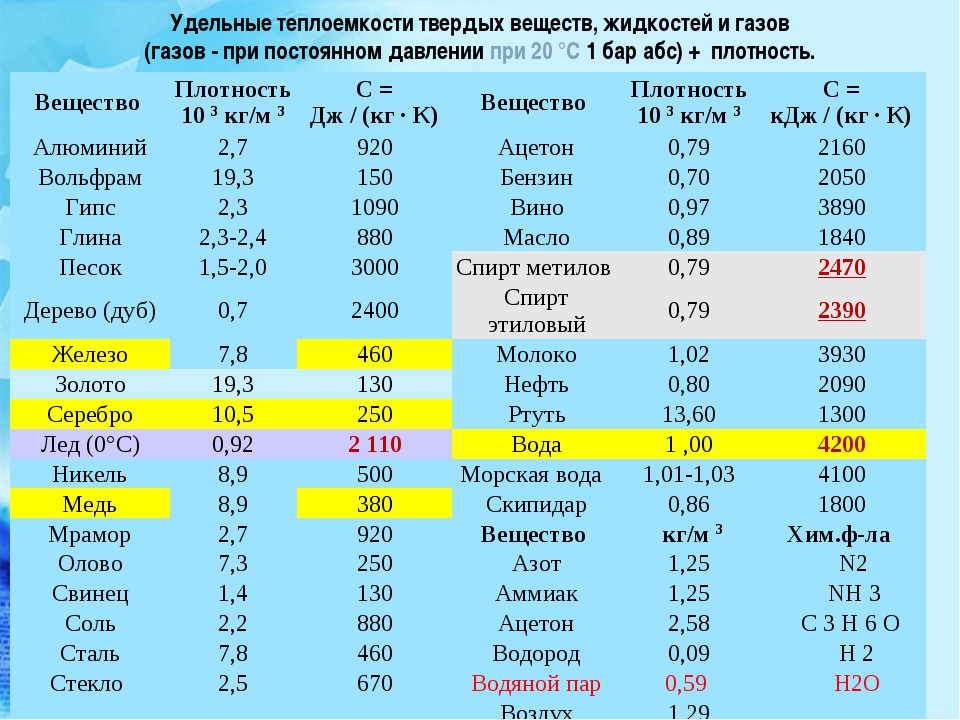 Соединения
используют в текстильной, лакокрасочной,
стекольной промышленности
Соединения
используют в текстильной, лакокрасочной,
стекольной промышленности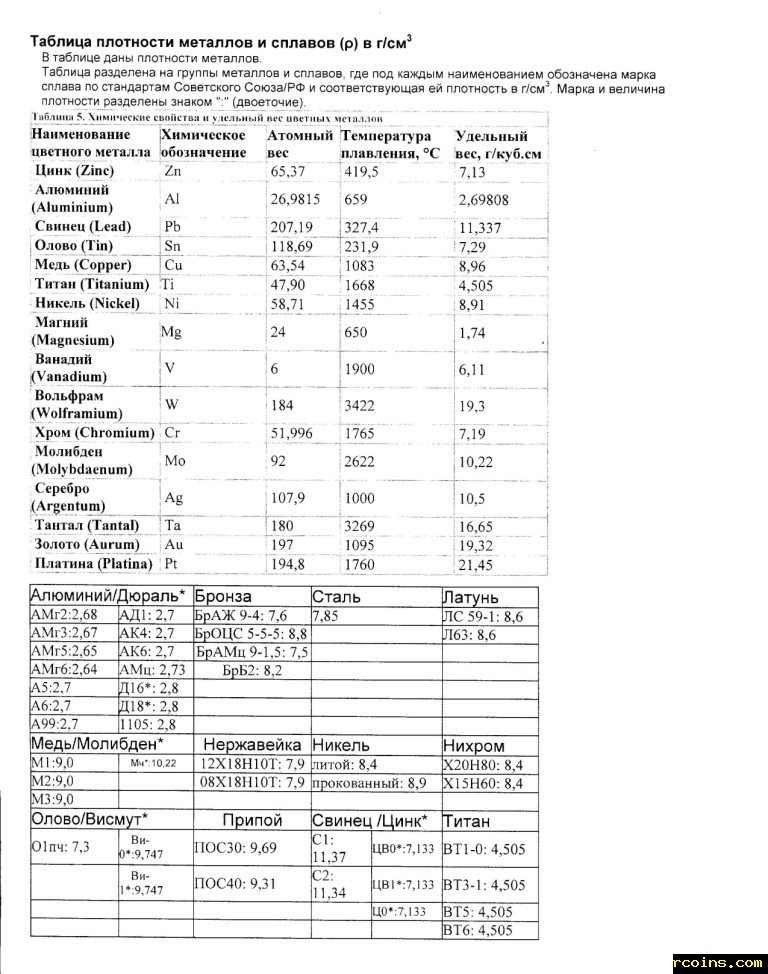 Применяют в щелочных
аккумуляторах, для цинкования, получения
сплавов
Применяют в щелочных
аккумуляторах, для цинкования, получения
сплавов Компонент
жаростойких и химически стойких
сталей; покрытия тепловыделяющих
элементов ядерных реакторов
Компонент
жаростойких и химически стойких
сталей; покрытия тепловыделяющих
элементов ядерных реакторов Компонент
жаропрочных сверхтвердых сталей
(инструментальные, быстрорежущие) и
сплавов. Используется в электротехнике
и радиоэлектронике
Компонент
жаропрочных сверхтвердых сталей
(инструментальные, быстрорежущие) и
сплавов. Используется в электротехнике
и радиоэлектронике
 При этом, количество килограммов воды будет равняться количеству литров, количество граммов – количеству миллилитров, а количество тонн – количеству кубометров.
При этом, количество килограммов воды будет равняться количеству литров, количество граммов – количеству миллилитров, а количество тонн – количеству кубометров.