Стандартный водородный электрод — Standard hydrogen electrode
Редокс-электрод
Стандартный водородный электрод (сокращенно ОНА ), является окислительно — восстановительным электродом , который образует основу термодинамической шкалы потенциалов окислительно-восстановительных . Его абсолютный электродный потенциал оценивается в 4,44 ± 0,02 В при 25 ° C, но чтобы сформировать основу для сравнения со всеми другими электрореакциями, стандартный электродный потенциал водорода ( E °) заявлен равным нулю вольт при любой температуре. Потенциалы любых других электродов сравниваются с потенциалами стандартного водородного электрода при той же температуре.
Водородный электрод основан на окислительно-восстановительной полуячейке :
- 2 H + (водн.) + 2 e — → H 2 (г)
Эта окислительно-восстановительная реакция происходит на платинированном платиновом электроде.
где:
ОНА против NHE против RHE
На раннем этапе развития электрохимии исследователи использовали обычный водородный электрод в качестве эталона для нулевого потенциала. Это было удобно, потому что на самом деле его можно было построить путем «[погружения] платинового электрода в раствор 1 н. Сильной кислоты и [барботирования] газообразного водорода через раствор при давлении около 1 атм». Однако позже этот интерфейс электрод / раствор был изменен. Его заменила теоретическая граница раздела электрод / раствор, где концентрация H + составляла 1 M , но предполагалось, что ионы H 
В итоге,
- NHE (нормальный водородный электрод): потенциал платинового электрода в 1 М растворе кислоты.
- SHE (стандартный водородный электрод): потенциал платинового электрода в теоретическом идеальном растворе (текущий
- RHE ( обратимый водородный электрод ): практичный водородный электрод, потенциал которого зависит от pH раствора.
Выбор платины
Выбор платины для водородного электрода обусловлен несколькими факторами:
- инертность платины (не корродирует)
- способность платины катализировать реакцию восстановления протонов
- высокая плотность собственного обменного тока для восстановления протонов на платине
- отличная воспроизводимость потенциала (смещение менее 10 мкВ при сравнении двух хорошо изготовленных водородных электродов друг с другом)
Поверхность платины платинирована (т. е. покрыта слоем мелкодисперсной порошковой платины, также известной как платиновая чернь ), чтобы:
е. покрыта слоем мелкодисперсной порошковой платины, также известной как платиновая чернь ), чтобы:
- Увеличьте общую площадь поверхности. Это улучшает кинетику реакции и максимально возможный ток.
- Используйте материал поверхности, который хорошо адсорбирует водород на границе раздела. Это также улучшает кинетику реакции.
Другие металлы могут использоваться для изготовления электродов с аналогичной функцией, таких как палладий-водородный электрод .
Вмешательство
Из-за высокой адсорбционной активности платинированного платинового электрода очень важно защитить поверхность электрода и раствор от присутствия органических веществ, а также от атмосферного кислорода. Также следует избегать неорганических ионов, которые могут понижаться до состояния с более низкой валентностью на электроде (например, Fe 3+ , CrO 2-
4 ). Ряд органических веществ также восстанавливается водородом на поверхности платины, и этого также следует избегать.
Источником помех могут быть катионы, которые могут восстанавливаться и откладываться на платине: серебро, ртуть, медь, свинец, кадмий и таллий.
Вещества, которые могут инактивировать («отравить») каталитические центры, включают мышьяк, сульфиды и другие соединения серы, коллоидные вещества, алкалоиды и материалы, обнаруженные в живых системах.
Изотопный эффект
Стандартный окислительно-восстановительный потенциал пары дейтерия немного отличается от такового протонной пары (примерно -0,0044 В по сравнению с SHE). Были получены различные значения в этом диапазоне: -0,0061 В, -0,00431 В, -0,0074 В.
- 2 D + (водн.) + 2 e — → D 2 (г)
Также разница возникает, когда в электроде используется дейтерид водорода вместо водорода.
строительство
Схема стандартного водородного электродаСхема штатного водородного электрода:
- платинированный платиновый электрод
- водородный газ
- раствор кислоты с активностью H + = 1 моль дм −3
- гидрозатвор для предотвращения воздействия кислорода
- резервуар, через который должен крепиться второй полуэлемент гальванического элемента.
 Соединение может быть прямым, через узкую трубку для уменьшения перемешивания или через солевой мостик , в зависимости от другого электрода и раствора. Это создает ионно-проводящий путь к интересующему рабочему электроду.
Соединение может быть прямым, через узкую трубку для уменьшения перемешивания или через солевой мостик , в зависимости от другого электрода и раствора. Это создает ионно-проводящий путь к интересующему рабочему электроду.
Смотрите также
Рекомендации
внешние ссылки
- Палиброда, Эвелина (январь 1967). «Обратите внимание на анодную активацию поверхности металла, поддерживающего гидрогеновый электрод». Журнал электроаналитической химии и межфазной электрохимии . 15 : 92–95. DOI : 10.1016 / 0022-0728 (67) 85013-7 .
1.2 Стандартный водородный электрод. Измерение электродных потенциалов металлов. Уравнение Нернста.
Значения электродных
потенциалов определяются относительно
некоторого электрода, потенциал которого
условно принят за нулевой. Таким эталонным
электродом выбран водородный в стандартных
условиях.
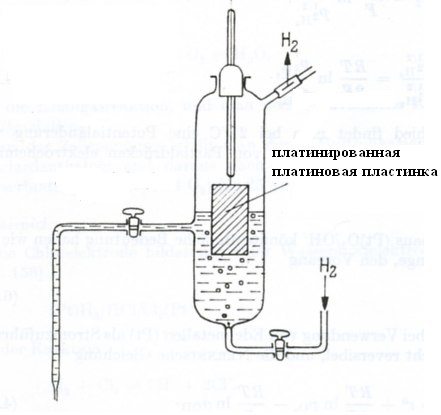
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н+ равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4
Боковая трубка с
краном также заполнена раствором серной
кислоты и служит для соединения
водородного электрода с другим электродом.
Водород хорошо
растворяется в платине; при этом молекулы
водорода частично распадаются на атомы
(пластина катализирует этот распад). На
поверхности соприкосновения платины
с раствором кислоты может протекать
окисление атомов или восстановление
ионов водорода. Платина при этом
практически не принимает участия в
электродных реакциях и играет как бы
роль губки, пропитанной атомарным
водородом. Адсорбированный водород, взаимодействуя
с молекулами воды, переходит в раствор
в виде ионов, оставляя в пластине
электроны.
Адсорбированный водород, взаимодействуя
с молекулами воды, переходит в раствор
в виде ионов, оставляя в пластине
электроны.
При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде:
Н2 = 2Н+ + 2ē.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Стандартный водородный электрод электродных потенциалов
Для определения
потенциала того или иного электродного
процесса нужно составить гальванический
элемент из испытуемого и стандартного
водородного электродов и измерить его
напряжение (рисунок 3). Поскольку потенциал
стандартного водородного электрода
равен нулю, то измеренное напряжение
будет представлять собою потенциал
данного электродного процесса.
Поскольку потенциал
стандартного водородного электрода
равен нулю, то измеренное напряжение
будет представлять собою потенциал
данного электродного процесса.
Таким образом, стандартным электродным потенциалом Е0 металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю.
Величина возникающего в результате этого процесса электродного потенциала определяется по уравнению Нернста:
,
где – электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
Т – температура;
F – число Фарадея;
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла
в растворе.
Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
.
Стандартный водородный потенциал — Справочник химика 21
Водородный электрод для измерения потенциала можно получить, погружая пластинку платинированной платины в раствор, насыщенный водородом при давлении 1 ат (рис. 3.2), или, что более удобно, измеряют потенциал с помощью стеклянного электрода, который также обратим по отношению к водородным ионам. Заметим, что потенциал электрода равен нулю, если и активность водородных ионов, и давление газообразного водорода (в атмосферах) равны единице. Это и есть стандартный водородный потенциал. Таким образом, потенциал полуэлемента для любого электрода равен э. д. с. элемента, где в качестве второго электрода использован стандартный водородный электрод. Потенциал полуэлемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34]
Это и есть стандартный водородный потенциал. Таким образом, потенциал полуэлемента для любого электрода равен э. д. с. элемента, где в качестве второго электрода использован стандартный водородный электрод. Потенциал полуэлемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34] Электрод получает положительный заряд и притягивает анионы из раствора, в результате на поверхности электрода образуется Двойной электрический слой с определенным скачком потенциала. Этот электродный потенциал зависит от концентрации ионов Ре2+ и Ре +. Знак потенциала и его величина определяются относительно стандартного водородного потенциала [c.521]
Так как стандартный водородный потенциал считается равным нулю, то и АН° для водородного потенциала следует также принять равным нулю. Тогда разность ДЯ — ДЯ дород будет энтальпией электродного процесса по сравнению с энтальпией электродного процесса водородного электрода, которая и будет отвечать стандартному потенциалу металла по сравнению с водо-родны.м электродом. [c.149]
Тогда разность ДЯ — ДЯ дород будет энтальпией электродного процесса по сравнению с энтальпией электродного процесса водородного электрода, которая и будет отвечать стандартному потенциалу металла по сравнению с водо-родны.м электродом. [c.149]
Данные о стандартных электродных потенциалах, приводимые в литературе, в зависимости от метода их нахождения можно подразделить на три основные группы. К первой относятся потенциалы, измеренные относительно стандартного водородного потенциала в водном растворе. Строго говоря, чтобы получить при таком эксперименте термодинамически достоверное значение, необходимо устранить потенциал на границе контакта двух растворов в разных растворителях. Однако в оригинальной литературе далеко не всегда можно встретить указания на то, что это условие вьшолнялось (это, впрочем, не означает, что измерение вьшолнялось без его соблюдения). Значения для ряда электродов в наиболее распространенных растворителях, взятые из сводки в монографии [375], приведены в приложении 2. [c.177]
[c.177]
Знание стандартных потенциалов отдельных электродов позволяет находить стандартные э.д. с. гальванических элементов Е°. Величина Е° равна стандартному электродному потенциалу правого электрода минус стандартный электродный потенциал левого электрода. В результате измерений э. д. с. элементов, в которых одним из электродов является стандартный водородный потенциал, получены данные о величинах стандартных электродных потенциалов при 25°С (298 К) для металлов и неметаллов, которые сведены в специальные справочные таблицы. Некоторые из них приведены в табл. VIII.1. [c.110]
Величина ДО определяется из опытных данных по ура внению ДО — —пЕ Р. Однако для нахождения Д0л1е+этого недостаточно, так как необходимо еще знание величины ДОн+. Поэтому подобно тому, какус-ловились считать равным нулю стандартный водородный потенциал, также приняли, чтб ДОй+ = О, и-тогда ДО = —ДОме. 1 [c.171]
Электрод стандартный нормальный водородный — Справочник химика 21
Стандартный потенциал пары Сс1 /Сс1 правей —0,40 в. Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]
Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]Для определения величины электродных потенциалов применяют стандартный электрод. Таким стандартным электродом служит нормальный водородный электрод. [c.50]
Потенциал водородного электрода, у которого активность ионов водорода равна единице и летучесть газообразного водорода равна I бар, принимается за нуль отсчета стандартных электрохимических потенциалов. Такой электрод называют нормальным водородным электродом и обычно обозначают НВЭ. [c.252]
Практически, невозможно измерить потенциалы отдельных электродов. Поэтому необходимо составить гальванический элемент (электролитическую ячейку) из двух полуэлементов с электродами, между которыми возникает разность потенциалов. Потенциал одного электрода постоянен и заранее известен. Электроды, относительно которых определяют потенциал индикаторного, носят название электродов сравнения. По международному соглашению в качестве стандартного электрода сравнения принят стандартный (нормальный) водородный электрод (н. в. э.), потен- [c.47]
Электроды, относительно которых определяют потенциал индикаторного, носят название электродов сравнения. По международному соглашению в качестве стандартного электрода сравнения принят стандартный (нормальный) водородный электрод (н. в. э.), потен- [c.47]
При измерении э. д. с. гальванического элемента абсолютные значения потенциалов обоих электродов во всех случаях остаются неизвестными. Поэтому условно в качестве эталона выбран электрод, относительно которого можно определить потенциалы других электродов. Таким повсеместно принятым стандартным электродом является нормальный водородный электрод , потенциал которого условно принят равным нулю, а любому другому электроду, измеренному по отношению к водородному, приписывается потенциал, равный э. д. с. гальванического элемента. [c.188]
ПО отношению к стандартному (нормальному) водородному электроду. [c.170]
Раньше в качестве точки отсчета принимали потенциал водородного электрода, контактирующего с раствором однонормальной кислоты , т, е. с концентрацией водородных ионов, равной 1 моль/л такой электрод называли нормальным водородным электродом. Сейчас это название часто (но необоснованно) применяют и для обозначения стандартного водородного электрода. [c.128]
с концентрацией водородных ионов, равной 1 моль/л такой электрод называли нормальным водородным электродом. Сейчас это название часто (но необоснованно) применяют и для обозначения стандартного водородного электрода. [c.128]
Стандартный или нормальный потенциал представляет собой равновесный потенциал, взятый в определенных условиях при погружении электрода из данного металла в нормальный раствор его соли, т. е. раствор, содержащий грамм-эквивалент иона металла в 1 л воды при 25°С. Поскольку непосредственно измерить потенциал одного электрода практически невозможно, стандартные потенциалы определяют экспериментально как разность потенциалов рассматриваемого электрода и так называемого электрода сравнения — нормального водородного электрода, потенциал которого условно принимается равным нулю. Значения стандартных потенциалов могут быть также рассчитаны термодинамическим путем [29]. [c.13]
Потенциал индикаторного электрода определяют, сравнивая его с потенциалом другого электрода, который принято называть электродом сравнения.
 В качестве электрода сравнения может быть применен только такой электрод, потенциал которого остается неизменной при изменении концентрации определяемых ионов. В качестве электрода сравнения применяют стандартный (нормальный) водородный электрод (см. книга I, гл. IV, 14). [c.250]
В качестве электрода сравнения может быть применен только такой электрод, потенциал которого остается неизменной при изменении концентрации определяемых ионов. В качестве электрода сравнения применяют стандартный (нормальный) водородный электрод (см. книга I, гл. IV, 14). [c.250]В стандартных условиях ри, = атм и а н + = 1, и электрод называется нормальным водородным электродом, а его электродный потенциал условно принимается равным нулю, хотя реально скачок потенциала на границе [c.51]
Таким стандартным электродом является нормальный водородный электрод (рис. 8). Он состоит из платиновой пластинки, покрытой рыхлым слоем мелкораздробленной (губчатой) платины, погруженной в сосуд с раствором серной кислоты, [c.318]
Чтобы дать количественную характеристику восстановительной способности металла, например цинка, надо построить нормальный гальванический элемент, который будет состоять из нормального цинкового электрода и нормального водородного электрода. Разность потенциалов (э. д. с.) такого гальванического элемента характеризует восстановительную способность металла и называется нормальным (стандартным) электродным потенциалом металла. [c.319]
Разность потенциалов (э. д. с.) такого гальванического элемента характеризует восстановительную способность металла и называется нормальным (стандартным) электродным потенциалом металла. [c.319]
Вернемся снова к системе (2.17). Очевидно, что для стандартизации водородный электрод должен соответствовать некоторым требованиям (pH и давление газообразного водорода). В качестве стандартного (нормального) водородного электрода принимают электрод, погруженный в раствор с активностью ионов гидроксо-ния, равной единице (pH 0), и парциальным давлением водорода, также равным единице. Э. д. с. цепи (2.17), с левой стороны которой записан нормальный водородный электрод (п. в. э.) [c.109]
Абсолютного значения разности ф — ф мы не знаем и не имеем методов для ее определения. Однако для решения практических задач оказывается достаточным знать относительные значения электродных потенциалов. Для того чтобы понять принцип определения относительных значений электродных потенциалов, следует представить себе гальванический элемент, составленный из изучаемого электрода и стандартного электрода, потенциал которого условно принимается за нуль, причем в принципе за нуль можно принять потенциал любого электрода. Обычно в качестве нулевого электрода принимают нормальный водородный электрод. Э. д. с. такого элемента (изучаемый электрод — нормальный водородный) может считаться равной электродному потенциалу = ф — ф. Если принять разность ф — ф для нормального водородного электрода равной нулю, то определение электродных потенциалов других электродов сводится к измерению э. д. с. элемента [c.11]
Обычно в качестве нулевого электрода принимают нормальный водородный электрод. Э. д. с. такого элемента (изучаемый электрод — нормальный водородный) может считаться равной электродному потенциалу = ф — ф. Если принять разность ф — ф для нормального водородного электрода равной нулю, то определение электродных потенциалов других электродов сводится к измерению э. д. с. элемента [c.11]
Нормальный электродный потенциал ср» позволяет оценивать термодинамическую активность различных химических веществ, но в настоящее время нет методов, позволяющих измерять абсолютное значение его. В связи с этим электроды характеризуют так называемым стандартным потенциалом электрода, который представляет собой (по предложению Нернста) разность нормальных потенциалов рассматриваемого и стандартного водородного электродов, определенных при 25 °С (298 К). При таком подходе стандартный электродный потенциал водорода фн, условно принимают равным нулю. Тогда стандартный потенциал вещества, электродный потенциал которого в указанных условиях, более отрицателен, чем потенциал стандартного водородного электрода, считается отрицательным. Если же электродный потенциал вещества менее отрицателен, чем потенциал стандартного водородного электрода, стандартный потенциал вещества считается положительным. Значения стандартных потенциалов некоторых веществ приведены в [2, табл. 79]. [c.237]
Если же электродный потенциал вещества менее отрицателен, чем потенциал стандартного водородного электрода, стандартный потенциал вещества считается положительным. Значения стандартных потенциалов некоторых веществ приведены в [2, табл. 79]. [c.237]
Комбинируя друг с другом разные окислительно-восстановительные пары, мы получаем гальванические элементы, в которых происходят различные окислительно-восстановительные реакции. Чтобы путем измерения э. д. с. этих элементов получить количественную характеристику силы различных окислителей и восстановителей, необходимо отдельные пары комбинировать всегда с одной и той же стандартной парой. В качестве такой стандартной пары принята пара 2Н+/Нг при концентрации (вернее — активности) ионов №, равной 1 грамм-ион/л, и давлении газообразного водорода, равном 1 ат. Она называется нормальным водородным электродом. Устройство нормального водородного эле- [c.238]
Величина стандартного (нормального) электродного потенциала, имеющая условное значение, вычисляется относительно выбранного стандарта — нормального водородного электрода потенциал которого также условно принят за нуль при любой температуре. Стандартный (нормальный) водородный электрод составляют из пластины платины, покрытой платиновой чернью, насыщенной газообразным водородом, опущенной в раствор ионов водорода с активностью, равной единице, при давлении в газовой фазе Рн — I атм. На поверхности платины, насыщенной водородом, возникает скачок потенциала, отвечающий [c.134]
Стандартный (нормальный) водородный электрод составляют из пластины платины, покрытой платиновой чернью, насыщенной газообразным водородом, опущенной в раствор ионов водорода с активностью, равной единице, при давлении в газовой фазе Рн — I атм. На поверхности платины, насыщенной водородом, возникает скачок потенциала, отвечающий [c.134] Водородный электрод для измерения потенциала можно получить, погружая пластинку платинированной платины в раствор, насыщенный водородом при давлении 1 ат (рис. 3.2), или, что более удобно, измеряют потенциал с помощью стеклянного электрода, который также обратим по отношению к водородным ионам. Заметим, что потенциал электрода равен нулю, если и активность водородных ионов, и давление газообразного водорода (в атмосферах) равны единице. Это и есть стандартный водородный потенциал. Таким образом, потенциал полуэлемента для любого электрода равен э. д. с. элемента, где в качестве второго электрода использован стандартный водородный электрод.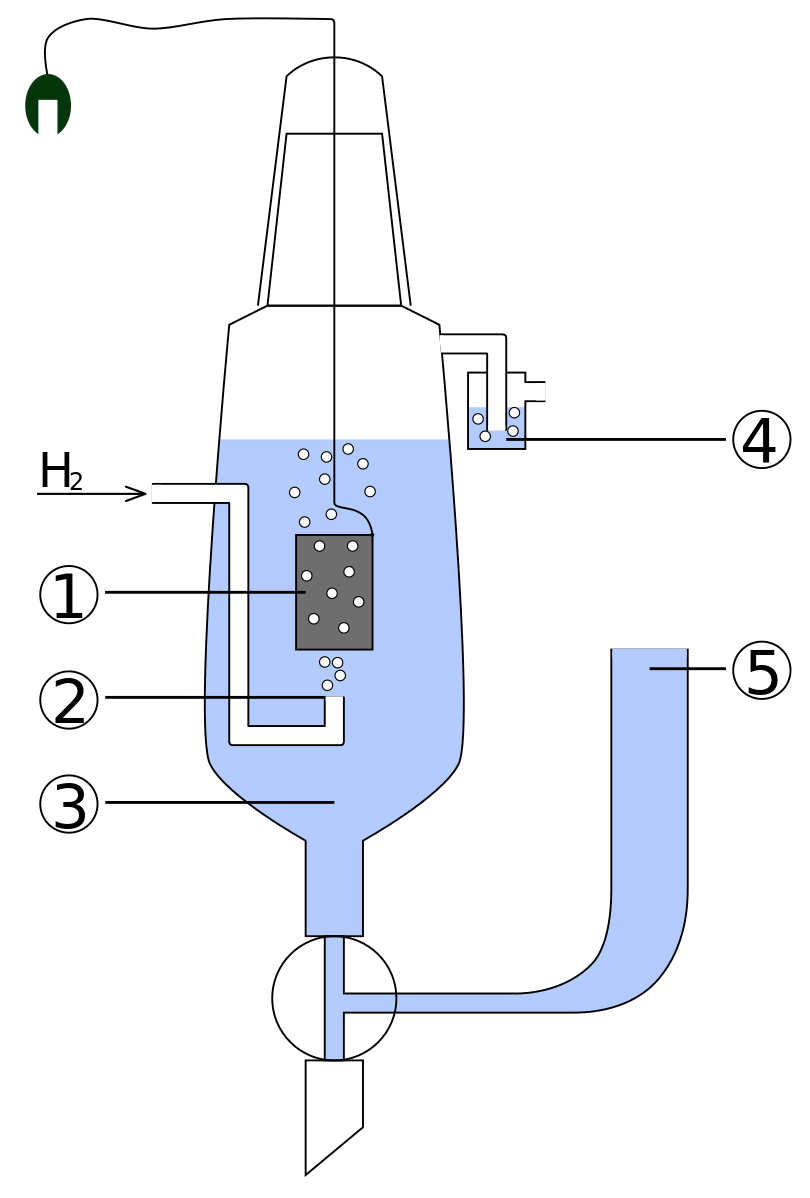 Потенциал полуэлемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34]
Потенциал полуэлемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34]
Стандартные электродные потенциалы ф° в неводных растворителях, отнесенные к нормальному водородному электроду в том же растворителе (в в) [c.560]
Вычисление стандартного потенциала электрода в неводном растворе ио отношению к нормальному водородному электроду в водном растворе довольно сложно и связано, как было указано, с трудностями и проводится различными путями на основе условных допущений . [c.560]
Значения стандартных (нормальных) электродных потенциалов 298 по отношению к водородному электроду для некоторых полуреакций приведены в табл. 8. [c.62]
Одновременно в таблице 19 приведены стандартные окислительновосстановительные потенциалы Е°, которые измерены для систем типа (10), находящихся в равновесном состоянии но отношению к нормальному водородному электроду (окислительно-восстановительный потенциал этого электрода обычно принимают равным нулю). [c.90]
[c.90]
Равновесный потенциал различных электродов, погруженных в раствор собственной соли, в котором активность (концентрация) ионов данного металла равна единице (1 моль/л), измеренный относительно нормального водородного электрода, называется нормальным, или стандартным, потенциалом и,.). Для всех металлов они образуют так называемый электрохимический ряд напряжений (табл. 3.1) или стандартные электродные потенциалы элементов в водных растворах при температуре 25 °С. [c.34]
Для определения стандартного потенциала какого-лйбо металла можно воспользоваться гальваническим элементом — системой из двух электродов, одним из которых служит нормальный водородный электрод, а другим — электрод испытуемого металла, погруженный в раствор его соли с активностью катиона 1 моль л . Электродвижущая сила такого гальванического элемента характеризует окислительно-восстановительную способность металла относительно стандартного водородного электрода и представляет собой, таким образом, его стандартный потенциал. [c.159]
[c.159]
Две вертикальные параллельные линии, расположенные между растворами, указывают, что диффузионный потенциал практически сведен к нулю. Для того чтобы Пд -у О, полуэлементы соединяют электролитическим замыкателем — стеклянной трубкой, заполненной раствором, содержащим ионы, мало отличающиеся подвижностью. Используют растворы хлористого калия, азотнокислого калия, азотнокислого аммония и др. В величину любого стандартного (нормального) электродного потенциала вкл ючаются разности потенциалов, отвечающие этому электроду, стандартному (нормальному) водородному и соответствующим контактным потенциалам. Величина стандартного (нормального) электродного потенциала (далее — просто стандартного потенциала) является поэтому частньш случаем [c.135]
Методы определения различных физико-химических величин и количественного анализа растворов на основе измерения ЭДС получили общее название потенциометрни. В потенциометрии широко используется измерение потенциала исследуемого электрода относительно какого-либо электрода сравнения (см. с. 20). Потенциалы выражаются в шкалах либо выбранного электрода сравнения (последний обязательно должен указываться), либо пересчитываются в водородную шкалу, которая отвечает стандартному (нормальному) водородному электроду сравнения [Р1, На ( = 1 атм = 101,325 кПа), Н+ (а = 1)1. Для стандартного (нормального) водородного электрода будет использоваться принятое в нашей стране сокращенное обозначение н. в. э. [c.108]
с. 20). Потенциалы выражаются в шкалах либо выбранного электрода сравнения (последний обязательно должен указываться), либо пересчитываются в водородную шкалу, которая отвечает стандартному (нормальному) водородному электроду сравнения [Р1, На ( = 1 атм = 101,325 кПа), Н+ (а = 1)1. Для стандартного (нормального) водородного электрода будет использоваться принятое в нашей стране сокращенное обозначение н. в. э. [c.108]
Стандартный (нормальный) водородный электрод представляет собой платинированный платиновый электрод , погруженный в насыщенный химически чистым водородом под давлением 1 атм водный раствор, активность ионов водорода в котором равна единице (1 н. раствор h3SO4). [c.35]
Обычно определяют относительные электродные потенциалы, так как методов прямого измерения электродных потенциалов металлов не существует. С этой целью измеряют э. д. с. гальванического элемента, составленного из стандартного (нормального) водородного электрода, потенциал которого принимают за нуль, и электрода исследуемого металла.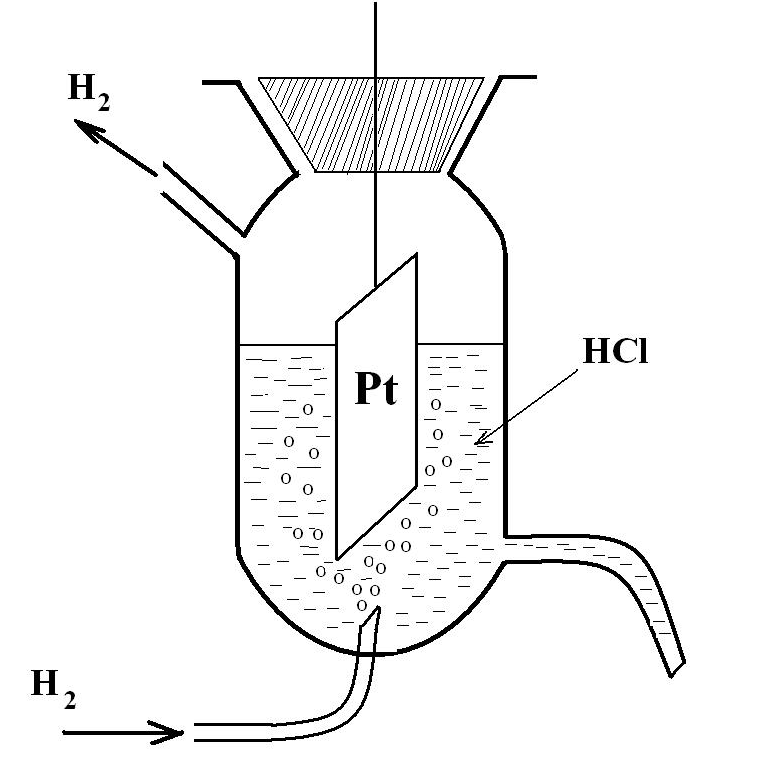 Стандартный водородг ный электрод представляет собой платиновую пластинт ку, покрытую слоем мелкораздробленной платины, на сыщенную водородом при давлении 0,1 МПа и погру женную в 1 н. раствор серной кислоты. Насыщенная водородом платиновая пластинка ведет себя как водородный электрод. У поверхности такого водородного электрода устанавливается равновесие между молекулами водорода, его атомами и ионами [c.139]
Стандартный водородг ный электрод представляет собой платиновую пластинт ку, покрытую слоем мелкораздробленной платины, на сыщенную водородом при давлении 0,1 МПа и погру женную в 1 н. раствор серной кислоты. Насыщенная водородом платиновая пластинка ведет себя как водородный электрод. У поверхности такого водородного электрода устанавливается равновесие между молекулами водорода, его атомами и ионами [c.139]
Если исследуемый электрод — металл, погруженный в раствор собстренной соли с единичной концентрацией (активностью) ионов и температурой 25 С, а Между металлом и раствором устанавливается равновесие, то потенциал такого металлического электрода относительно нормального водородного считается стандартным. [c.18]
Стандартные (нормальные) окислительные потенциалы ([c.166]
Для определения величины электродного потенциала металла измеряют разность между потенциалами двух электродов, т. е. электродвижущую силу элемента, причем потенциал одного электрода известен. В качестве такого электрода можно применить так называемый стандартный (нормальный) водородный электрод, потенциал которого условно равен нулюИзмерения большей частью производят не по отношению к водородному электроду, а к другим более удобным в пользовании (потенциал которых измерен по отношению к водородному электроду), так называемых электродов сравнения. [c.29]
В качестве такого электрода можно применить так называемый стандартный (нормальный) водородный электрод, потенциал которого условно равен нулюИзмерения большей частью производят не по отношению к водородному электроду, а к другим более удобным в пользовании (потенциал которых измерен по отношению к водородному электроду), так называемых электродов сравнения. [c.29]
В качестве стандартного элютро-да, относительно потенциала которого измеряют нотенциил исслей мого электрода, принят нормальный водородный электрод потенциал которого Яо при всех температурах у с я о в-но принят ра Ьным нулю. [c.22]
Поскольку нет метода изАгерення абсолютного значения потенциала одного электрода, нулевой точкох выбран условно потенциал стандартного (нормального) водородного электрода. [c.34]
Значения стандартных (нормальных) электродных потенциалов Ф2Э3 по отношению к водородному электроду для некоторых полуреакцнй указаны в табл. 2.5 приведенные данные расположены по убывающему значению отрицательного потенциала, чему отвечает падение восстаповительно 1 и рост окислительной активности. [c.195]
2.5 приведенные данные расположены по убывающему значению отрицательного потенциала, чему отвечает падение восстаповительно 1 и рост окислительной активности. [c.195]
Для сравнительной характеристики металлов пользуются понятием — стандартный электродный потенциал металла. Стандартным электродным потенциалом металла называют разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией 1 г-ион металла в литре, и нормальным водородным электродом. Располагая металлы то величине их стандартных электродных потенциалов, получают ряд напряжений металлов щшожент А). [c.121]
Стандартный водородный электрод: определение химии
Стандартный водородный электрод является стандартным измерением электродного потенциала для термодинамической шкалы окислительно-восстановительных потенциалов. Стандартный водородный электрод часто называют аббревиатурой SHE или его можно назвать нормальным водородным электродом (NHE). Технически ОНА и НХЕ разные. NHE измеряет потенциал платинового электрода в 1 N растворе кислоты, в то время как SHE измеряет потенциал платинового электрода в идеальном растворе (текущий стандарт нулевого потенциала при всех температурах).
Технически ОНА и НХЕ разные. NHE измеряет потенциал платинового электрода в 1 N растворе кислоты, в то время как SHE измеряет потенциал платинового электрода в идеальном растворе (текущий стандарт нулевого потенциала при всех температурах).
Стандарт определяется потенциалом платинового электрода в окислительно-восстановительной полуреакции2 ч+(вод) + 2 е— → H2(г) при 25 ° С. Стандартный водородный электрод состоит из пяти компонентов: Окислительно-восстановительная реакция происходит на платинированном платиновом электроде. Платина используется для SHE, потому что она устойчива к коррозии, катализирует реакцию восстановления протонов, имеет высокую плотность собственного обменного тока и дает воспроизводимые результаты. Платиновый электрод платинирован или покрыт платиновым черным, потому что это увеличивает площадь поверхности электрода и увеличивает кинетику реакции, потому что он хорошо адсорбирует водород.строительство
 Когда электрод погружается в кислый раствор, через него пузырится газообразный водород. Концентрация восстановленной и окисленной формы поддерживается, поэтому давление газообразного водорода составляет 1 бар или 100 кПа. Активность ионов водорода равна формальной концентрации, умноженной на коэффициент активности
Когда электрод погружается в кислый раствор, через него пузырится газообразный водород. Концентрация восстановленной и окисленной формы поддерживается, поэтому давление газообразного водорода составляет 1 бар или 100 кПа. Активность ионов водорода равна формальной концентрации, умноженной на коэффициент активностиЗачем использовать платину?
источники
 Журнал химического образования . 64 (10): 885.
Журнал химического образования . 64 (10): 885.
Стандартный водородный электрод
ЭДС элемента равна разности равновесных потенциалов катода и анода. Если потенциал одного из электродов принять равным нулю, то относительный потенциал Е второго элемента будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода. В настоящее время известны лишь относительные электродные потенциалы. За нуль принят потенциал стандартного водородного электрода.
Водородный электрод представляет собой Рt — пластинку, покрытую тонким слоем очень рыхлой пористой платины для увеличения её поверхности. Пластинка опускается в 2 н. водный раствор H2SO4 (рис. 62). Активность ионов водорода в таком растворе равна 1 г – ион/л. Через раствор пропускается химически чистый водород под атмосферным давлением. Водород насыщает поверхность Pt — пластины, часть его переходит в атомарное состояние H2 2H и на границе электрода с раствором устанавливается равновесие Н ↔Н+ + ē или 2Н+ + 2ē ↔ Н2.
62). Активность ионов водорода в таком растворе равна 1 г – ион/л. Через раствор пропускается химически чистый водород под атмосферным давлением. Водород насыщает поверхность Pt — пластины, часть его переходит в атомарное состояние H2 2H и на границе электрода с раствором устанавливается равновесие Н ↔Н+ + ē или 2Н+ + 2ē ↔ Н2.
Водородный электрод условно обозначают Н2 / 2Н+, где вертикальная черта обозначает поверхность раздела фаз.
Если давление водорода в газовой среде, соприкасающейся с раствором равно 1 атм, активность ионов Н+ в рас-
творе равна 1 г – ион/л , то потенциал такого электрода условно принимается за 0 В и его в этом случае называют нормальным
(стандартным) водородным электродом.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов
Рис.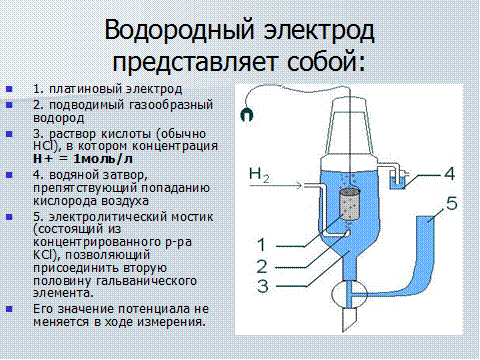 62. Схема водородного электрода
62. Схема водородного электрода
которого является измеряемый, а вторым стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева — водородный электрод, справа — измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
Н2, Pt |H+| |Zn2+| Zn,
а схема для измерения потенциала медного электрода:
H2, Pt |H+| |Cu2+| Cu.
Поскольку потенциал водородного электрода условно принят за нуль, то измеряемая величина ЭДС элемента будет равна потенциалу электрода.
Узнать еще:
Стандартный водородный электрод — Большая Энциклопедия Нефти и Газа, статья, страница 4
Стандартный водородный электрод
Cтраница 4
Поскольку пользоваться стандартным водородным электродом неудобно, его по мере возможности заменяют другими, более удобными в работе электродами с постоянными скачками электродного потенциала.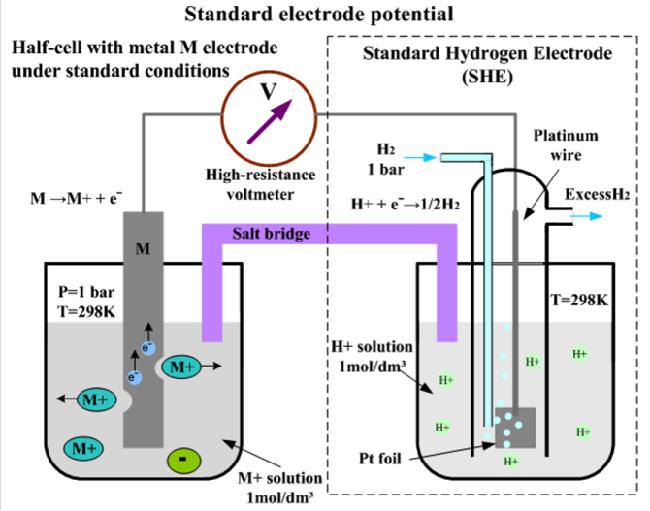 Такими электродами являются каломельный, хлоридсеребряный и хингидрон — f ный электроды.
[46]
Такими электродами являются каломельный, хлоридсеребряный и хингидрон — f ный электроды.
[46]
Что называют стандартным водородным электродом. Для каких целей его используют. [47]
Таким требованиям отвечает стандартный водородный электрод ( СВЭ), изображенный на рис. 14 — 2, применяемый обычно в качестве универсального стандарта. [48]
Для удобства потенциал стандартного водородного электрода принимают равным точно нулю вольт при любой температуре. [50]
По-видимому, потенциал стандартного водородного электрода становится более положительным с повышением температуры; кажущийся температурный коэффициент составляет 0 92 мв / град. Подобным образом данные, приведенные в табл. IX. [51]
Потенциалы отнесены к стандартному водородному электроду при комнатной температуре. [52]
[52]
Разность потенциалов между стандартным водородным электродом и металлом, погруженным в раствор его соли с активностью ионов металла 1 г-ион в 1000 г воды, называют стандартным электродным потенциалом металла. [54]
Какой электрод называется стандартным водородным электродом. [55]
Универсальным электродом сравнения является стандартный водородный электрод, но для практической работы он неудобен из-за необходимости получения очень чистого водорода и ряда других причин. [56]
В шкале электродных потенциалов стандартный водородный электрод является электродом сравнения. Однако практически более удобны другие электроды сравнения, например каломельный. Если раствор КС1 однонормальный, то потенциал каломельного электрода при 25 С отрицательнее потенциала стандартного водородного на 0 281 В, а если де-цинормальный, то отрицательнее на 0 3388 В. [57]
[57]
Страницы: 1 2 3 4
Стандартные электроды — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Как устроен электрод?
- Какие процессы идут?
- Из чего сделан электрод?
- Примеры электродов
- Стандартный водородный электрод
- Из чего состоит SHE?
- Что происходит в этом процессе?
- Трехэлектродная система
- Ссылки
- Проблемы
- Участники и атрибуты
Электрод по определению — это точка, в которой ток входит и выходит из электролита. Когда ток покидает электроды, он известен как катод, а когда ток входит, он известен как анод. Электроды — жизненно важные компоненты электрохимических ячеек. Они переносят образовавшиеся электроны из одной полуячейки в другую, производя электрический заряд. Этот заряд основан на стандартной электродной системе (SHE) с опорным потенциалом 0 вольт и служит средой для любого расчета потенциала ячейки.
Когда ток покидает электроды, он известен как катод, а когда ток входит, он известен как анод. Электроды — жизненно важные компоненты электрохимических ячеек. Они переносят образовавшиеся электроны из одной полуячейки в другую, производя электрический заряд. Этот заряд основан на стандартной электродной системе (SHE) с опорным потенциалом 0 вольт и служит средой для любого расчета потенциала ячейки.
Каков механизм электрода?
Какие процессы идут?
Электрод — это металл, поверхность которого служит местом, где устанавливается окислительно-восстановительное равновесие между металлом и тем, что находится в растворе.Электрод может быть анодом или катодом. Анод получает ток или электроны от смеси электролитов, тем самым окисляясь. Когда атомы или молекулы подходят достаточно близко к поверхности электрода, раствор, в который помещен электрод, отдает электроны. Это заставляет атомы / молекулы становиться положительными ионами.
С катодом происходит обратное. Здесь электроны высвобождаются из электрода, и раствор вокруг него уменьшается.
Здесь электроны высвобождаются из электрода, и раствор вокруг него уменьшается.
Из чего сделан электрод?
Электрод должен быть хорошим проводником, поэтому обычно это металл. Теперь, из чего сделан этот металл, зависит от того, участвует ли он в реакции или нет. Для некоторых реакций требуется инертный электрод, который не участвует. Примером этого может быть платина в реакции SHE (описанной ниже). В то время как другие реакции используют твердые формы реагентов, превращая их в электроды. Примером этого типа ячейки может быть:
(левая сторона — анод) Cu (s) | Cu (NO 3 ) 2 (водн.) (0.1M) || AgNO 3 (водн.) (0,01M) | Ag (s) (правая сторона — катод)
(В приведенной выше схеме ячейки: внешние компоненты представляют собой электроды для реакции, а внутренние части представляют собой растворы, в которые они погружены)
Здесь вы можете видеть, что используется твердая форма реагента — медь. Медь, как и серебро, участвуют в качестве реагентов и электродов.
Примеры электродов
Некоторые широко используемые инертные электроды: графит (углерод), платина, золото и родий.
Некоторые часто используемые реактивные (или задействованные) электроды: медь, цинк, свинец и серебро.
Стандартный водородный электрод
Стандартный водородный электрод (SHE) — это электрод, который ученые используют для сравнения во всех реакциях потенциала полуэлементов. Значение стандартного потенциала электрода равно нулю, что составляет основу для расчета потенциалов ячеек с использованием разных электродов или разных концентраций. Важно иметь этот общий электрод сравнения, так же как для Международного бюро мер и весов важно хранить запечатанный кусок металла, который используется для сравнения S.I. Килограмм.
Из чего сделана ОНА?
SHE состоит из 1,0 М раствора H + (водн.), Содержащего квадратный кусок платинированной платины (соединенный с платиновым проводом, по которому можно обмениваться электронами) внутри трубки. Затем во время реакции водород проходит через трубку в раствор, вызывая реакцию:
Затем во время реакции водород проходит через трубку в раствор, вызывая реакцию:
2H + (водн.) + 2e — <==> H 2 (г).
Платина используется, потому что она инертна и мало реагирует с водородом.
Что происходит в этом процессе?
Сначала начальный разряд позволяет электронам заполнить самый высокий занятый уровень энергии Pt. При этом некоторые из ионов H + образуют ионы H 3 O + с молекулами воды в растворе. Эти ионы водорода и гидроксония затем подходят достаточно близко к Pt электроду (на платинированной поверхности этого электрода), где водород притягивается к электронам в металле и образует атом водорода. Затем они объединяются с другими атомами водорода, образуя h3 (g).Этот газообразный водород выделяется из системы. Для поддержания реакции к электроду требуется постоянный поток H 2 (г). Pt-провод подключается к аналогичному электроду, в котором происходит противоположный процесс, и таким образом создается заряд, который равен 0 вольт. Обычно предпочтение отдается другим стандартным электродам, поскольку установка SHE может быть сложной задачей. Сложность возникает при приготовлении платинированной поверхности и при контроле концентрации реагентов.По этой причине SHE называют гипотетическим электродом.
Обычно предпочтение отдается другим стандартным электродам, поскольку установка SHE может быть сложной задачей. Сложность возникает при приготовлении платинированной поверхности и при контроле концентрации реагентов.По этой причине SHE называют гипотетическим электродом.
Трехэлектродная система
Трехэлектродная система состоит из рабочего электрода, электрода сравнения и вспомогательного электрода. Трехэлектродная система важна в вольтамперометрии. Все три этих электрода служат уникальным роликом в трехэлектродной системе. Под электродом сравнения понимается электрод, который имеет установленный электродный потенциал. В электрохимической ячейке электрод сравнения может использоваться как полуячейка.Когда электрод сравнения действует как половина ячейки, можно обнаружить электродный потенциал другой половины ячейки. Вспомогательный электрод — это электрод, который предотвращает прохождение тока через ячейку сравнения. Он гарантирует, что ток равен току рабочего электрода. Рабочий электрод — это электрод, который переносит электроны к присутствующим веществам и от них. Вот некоторые примеры эталонных ячеек:
Рабочий электрод — это электрод, который переносит электроны к присутствующим веществам и от них. Вот некоторые примеры эталонных ячеек:
Каломельный электрод: Этот электрод сравнения состоит из молекул ртути и хлорида ртути.Этот электрод может быть относительно проще в изготовлении и обслуживании по сравнению с SHE. Он состоит из твердой пасты Hg 2 Cl 2 и жидкой элементарной ртути, прикрепленной к стержню, который погружен в насыщенный раствор KCl. Необходимо, чтобы раствор был насыщенным, потому что это позволяет фиксировать активность хлорида калия, а напряжение быть ниже и ближе к SHE. Этот насыщенный раствор позволяет обменять ионы хлора. Все это обычно помещается внутри трубки, которая имеет пористый солевой мостик, позволяющий электронам проходить обратно и замыкать цепь.-_ {(водный)} \]
Серебро-хлоридный электрод серебра : Электрод такого типа осаждает соль в растворе, который участвует в электродной реакции. Этот электрод состоит из твердого серебра и его осажденной соли AgCl. Это широко используемый электрод сравнения, поскольку он недорог и не так токсичен, как каломелевый электрод, содержащий ртуть. Электрод из серебра и хлорида серебра изготавливается из твердой серебряной проволоки и кодирования ее в AgCl. Затем его помещают в пробирку с раствором KCl и AgCl.-_ {(водный)} \]
Этот электрод состоит из твердого серебра и его осажденной соли AgCl. Это широко используемый электрод сравнения, поскольку он недорог и не так токсичен, как каломелевый электрод, содержащий ртуть. Электрод из серебра и хлорида серебра изготавливается из твердой серебряной проволоки и кодирования ее в AgCl. Затем его помещают в пробирку с раствором KCl и AgCl.-_ {(водный)} \]
Список литературы
- Айвз, Дэвид Дж. Г. и Джордж Джон. Янц. «2. Водородный электрод». Электроды сравнения. Нью-Йорк [usw.]: Acad. Пр., 1961. Печать.
- Аллманд А. и Гарольд Иоганн Томас. Эллингем. «Глава 4: Электролизная ванна». Принципы прикладной электрохимии, . Нью-Йорк: Longmans, Green, 1924. Печать
- Стандартный водородный электрод: искаженная концепция, http: //pubs.acs.org / doi / pdf / 10.1021 / ed050p604
Проблемы
1. Какой электрод окисляет раствор в полуячейке? Анод или катод?
2. Почему стандартный водородный электрод важен для расчета потенциалов ячеек?
3. Определите, какая сторона является катодом, а какая — анодом.
Определите, какая сторона является катодом, а какая — анодом.
Ag (ов) | Ag + (водн.) (. 5M) || Ag + (водн.) (0,05M) | Аг (ов)
4. Почему важно использовать инертный электрод в таких ситуациях, как SHE?
5.Каков стандартный потенциал половины ячейки для SHE?
Ответы (выделите, чтобы увидеть):
1. Анод
2. Это важно при вычислении потенциалов полуэлементов, поскольку оно служит эталоном. Без этого электрода не было бы оснований для расчета значений потенциалов ячеек.
3. Слева — анод, справа — катод.
4. В этой ситуации важно использовать инертный электрод, потому что он не будет вступать в реакцию или участвовать в реакции в ячейке, а просто обеспечивает площадь поверхности для протекания реакции.
5,0 вольт.
Авторы и ссылки
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
: определение химического состава
Стандартный водородный электрод — это стандартное измерение электродного потенциала для термодинамической шкалы окислительно-восстановительных потенциалов. Стандартный водородный электрод часто обозначается аббревиатурой SHE или может быть известен как обычный водородный электрод (NHE). Технически SHE и NHE разные. NHE измеряет потенциал платинового электрода в 1 н. Растворе кислоты, а SHE измеряет потенциал платинового электрода в идеальном растворе (текущий стандарт нулевого потенциала при всех температурах).
Стандарт определяется потенциалом платинового электрода в окислительно-восстановительной полуреакции
2 H + (водн.) + 2 e — → H 2 (г) при 25 ° C.
Строительство
Стандартный водородный электрод состоит из пяти компонентов:
- Платинированный платиновый электрод
- Кислотный раствор с активностью ионов водорода (H + ) 1 моль / дм 3
- Пузырьки газообразного водорода
- Hydroseal для предотвращения помех от кислорода
- Резервуар для крепления второй половины -элемент гальванического элемента.
 Для предотвращения перемешивания можно использовать либо солевой мостик, либо узкую трубку.
Для предотвращения перемешивания можно использовать либо солевой мостик, либо узкую трубку.
Окислительно-восстановительная реакция протекает на платинированном платиновом электроде. Когда электрод погружается в кислотный раствор, газообразный водород проходит через него. Концентрация восстановленной и окисленной формы сохраняется, поэтому давление газообразного водорода составляет 1 бар или 100 кПа. Активность ионов водорода равна формальной концентрации, умноженной на коэффициент активности.
Зачем нужна платина?
Платина используется для SHE, поскольку она устойчива к коррозии, катализирует реакцию восстановления протонов, имеет высокую плотность собственного обменного тока и дает воспроизводимые результаты.Платиновый электрод платинирован или покрыт платиновой чернью, потому что это увеличивает площадь поверхности электрода и увеличивает кинетику реакции, потому что он хорошо адсорбирует водород.
Источники
- Ives, D.
 J. G .; Янц, Г. Дж. (1961). Электроды сравнения: теория и практика . Академическая пресса.
J. G .; Янц, Г. Дж. (1961). Электроды сравнения: теория и практика . Академическая пресса. - Ramette, R. W. (октябрь 1987 г.). «Устаревшая терминология: обычный водородный электрод». Журнал химического образования . 64 (10): 885.
- Sawyer, D. T .; Собковяк, А .; Робертс, Дж. Л., младший (1995). Электрохимия для химиков (2-е изд.). Джон Уайли и сыновья.
Стандартный водородный электрод и ЭДС
N Если у нас есть стандарт, мы можем найти разность потенциалов цинкового полуэлемента путем сравнения. Однако, Прежде чем подключать внешнюю цепь, запомните, что на каждом электроде происходят следующие равновесные реакции:
H 2 (Pt электрод) 2H + (раствор) + 2 e — (электрод)
Zn (электрод) Zn 2+ (раствор) + 2 e — (электрод)
B потому что цинк имеет большую склонность к ионизации, чем
газообразный водород, на цинковом электроде будет установлен более высокий потенциал. Итак, когда мы замыкаем цепь и соединяем провода, электроны потекут
вниз градиент потенциала от цинковой полосы к платиновому электроду. Это
разность потенциалов — вот что заставляет электроны течь. В составе
В этой большой ячейке цинковый электрод действует как анод :
Итак, когда мы замыкаем цепь и соединяем провода, электроны потекут
вниз градиент потенциала от цинковой полосы к платиновому электроду. Это
разность потенциалов — вот что заставляет электроны течь. В составе
В этой большой ячейке цинковый электрод действует как анод :
Zn (электрод) Zn 2+ (раствор) + 2 e — (электрод)
Одновременно на платиновой полоске происходит восстановление иона водорода; этот электрод действует как катод :
2e — (электрод) + 2H + (раствор) H 2 (Pt электрод)
T Разность потенциалов, которая движет потоком электронов от атомов цинка к ионам водорода, называется электродвижущей силой и может быть измерена с помощью вольтметра.Эта сила представляет собой просто сложение потенциалов, генерируемых полуэлементами окисления и восстановления:
E ° нетто = E ° вол + E ° красный
W Если поток электронов спонтанный, E ° net положительный.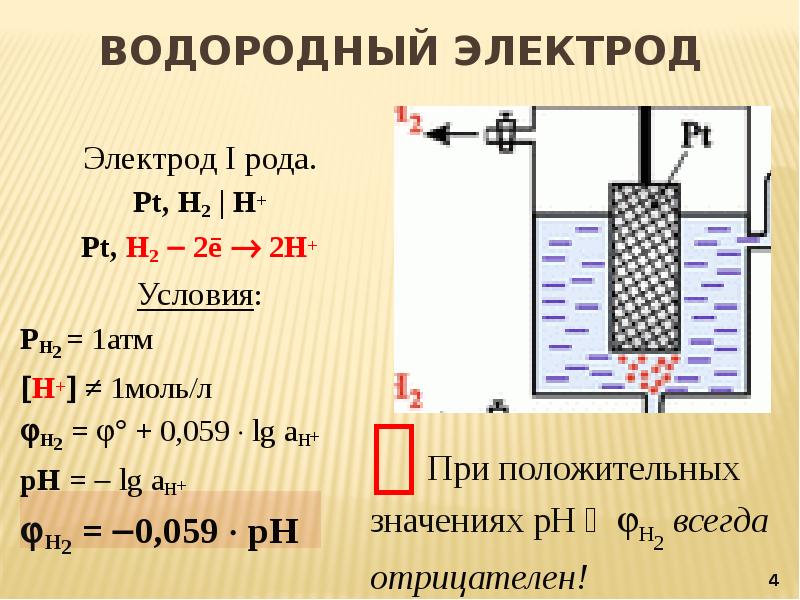 В этой реакции, поскольку наш стандарт определен как вклад точно 0 В (при стандартных условиях), E ° нетто будет потенциальным вкладом от реакции окисления, происходящей на цинковом электроде:
В этой реакции, поскольку наш стандарт определен как вклад точно 0 В (при стандартных условиях), E ° нетто будет потенциальным вкладом от реакции окисления, происходящей на цинковом электроде:
E ° нетто = E ° Ox + E ° красный
E ° net = E ° Zn + E ° SHE
E ° zn = E ° net — E ° SHE
E ° zn = E ° net — (0) = E ° net
A активируйте Рисунок 4 , чтобы найти потенциал ячейки , измеренный в вольтах, который перемещает электроны между цинковым и стандартным водородным электродами.
Нажмите на рисунок, чтобы найти потенциал клетки.
Хорошо!
г. восстановление Zn будет иметь такой же потенциал, как и окисление.
Помните
стандартный потенциал для SHE составляет 0 В.
B Перед тем как перейти к следующей странице, вы должны понять, как создается градиент потенциала на одном электроде и между двумя полуячейками.Вы также должны понимать принцип действия и функции стандартного водородного электрода (SHE) .
Водородный электрод
SHE — Термодинамически безупречно! Но . . .
Лектрод S стандартный H ydrogen E лектрод (SHE) официально является термодинамическим 0,0 В точка отсчета для всех возможных измерений при всех температурах. Это легко определить, но не удобно реализовывать строго.
Сколько кислоты нужно для приготовления раствора с a = 1? Комптон и Сандерс (3) предлагают [H + ] = 1.18 M , но это число будет другим для серной и соляной кислоты, так как коэффициенты активности разные.
Все не намного лучше, если подумать
о парциальном давлении водорода. Давление пара воды составляет
около 25 мм рт. ст. при комнатной температуре. Итак, даже если барометрический
давление 760 мм рт. ст., парциальное давление насыщенного водородом воды всего 735 мм рт.
ст. при комнатной температуре. Итак, даже если барометрический
давление 760 мм рт. ст., парциальное давление насыщенного водородом воды всего 735 мм рт.
Используя 1M H + и используя общую давление в одну атмосферу каждый вносит ошибку только около 5 мВ.Ошибки имеют противоположные стороны, поэтому они имеют тенденцию отменяться.
NHE — Синоним?SHE также иногда называют NHE , для N ormal H ydrogen E лектрод. «Нормальный» наводит на мысль о НПП, «Нормальный каломельный электрод», заполненный 1 N KCl. Я подозреваю, что у многих возникла такая ассоциация. К счастью, разность потенциалов между 1 M (или 1 N ) HCl и HCl @ a = 1 маленький.
В таблицах на этом веб-сайте я использовал NHE, потому что именно так в большинстве цитируемых ссылок перечислил потенциалы.
RHE — Практическое руководство! Реверсивный водородный электрод (RHE) — довольно практичный и воспроизводимый электрод «эталон». Термин относится к водородному электроду, погруженному в электролит.
решение фактически использовано. Я бы предположил, что полное давление (, а не парциальное давление водорода) составляет одну атмосферу.Этот электрод является
фаворит тех, кто изучает водородный UPD на Pt электродах в H 2 SO 4 .
Никакие посторонние ионы не вводятся, а водород должен присутствовать
тем не мение!
Термин относится к водородному электроду, погруженному в электролит.
решение фактически использовано. Я бы предположил, что полное давление (, а не парциальное давление водорода) составляет одну атмосферу.Этот электрод является
фаворит тех, кто изучает водородный UPD на Pt электродах в H 2 SO 4 .
Никакие посторонние ионы не вводятся, а водород должен присутствовать
тем не мение!
Доступен обратимый водородный электрод в продаже от Гаскатель. Этот продуманный дизайн заполняет внутреннюю часть корпус электрода водородом. Они используют платину с углеродным покрытием катализатор в качестве газодиффузионного электрода, который находится в контакте с водородом с фиксированным давлением атмосфера внутри и решение снаружи.Связаться с производитель для более подробной информации.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.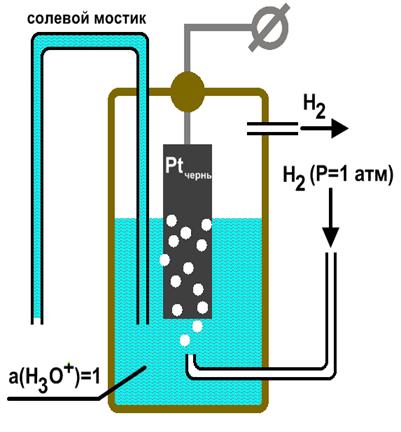
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Док Примечания к редакции химии уровня A Brown ТеоретическиеФизические Продвинутый уровень Химическое равновесие Примечания к пересмотру химического равновесия ЧАСТЬ 7.3 7.3 Водород Электрод, стандартный электродный потенциал, стандартные условия и обозначение ячейки Что такое стандартный водород? электрод сконструирован? Стандартный электродный потенциал полуячейка основана на произвольном нуле для иона водорода / водорода газовый полуэлемент.Что такое стандартный электродный потенциал? Что мы имеем в виду по стандартным условиям? Примечания по химическому равновесию, часть 7, индекс 7,3 Водородный электрод, стандартный электродный потенциал и стандартные условия
Фиг.4
Рис.5 Рис.1
|

 Соединение может быть прямым, через узкую трубку для уменьшения перемешивания или через солевой мостик , в зависимости от другого электрода и раствора. Это создает ионно-проводящий путь к интересующему рабочему электроду.
Соединение может быть прямым, через узкую трубку для уменьшения перемешивания или через солевой мостик , в зависимости от другого электрода и раствора. Это создает ионно-проводящий путь к интересующему рабочему электроду. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.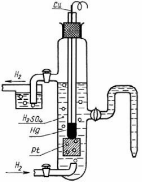 Для предотвращения перемешивания можно использовать либо солевой мостик, либо узкую трубку.
Для предотвращения перемешивания можно использовать либо солевой мостик, либо узкую трубку. J. G .; Янц, Г. Дж. (1961). Электроды сравнения: теория и практика . Академическая пресса.
J. G .; Янц, Г. Дж. (1961). Электроды сравнения: теория и практика . Академическая пресса.  Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора. ) = 0.00V в стандартных условиях.
) = 0.00V в стандартных условиях. ) (ионы водорода для
водородный электрод),
) (ионы водорода для
водородный электрод),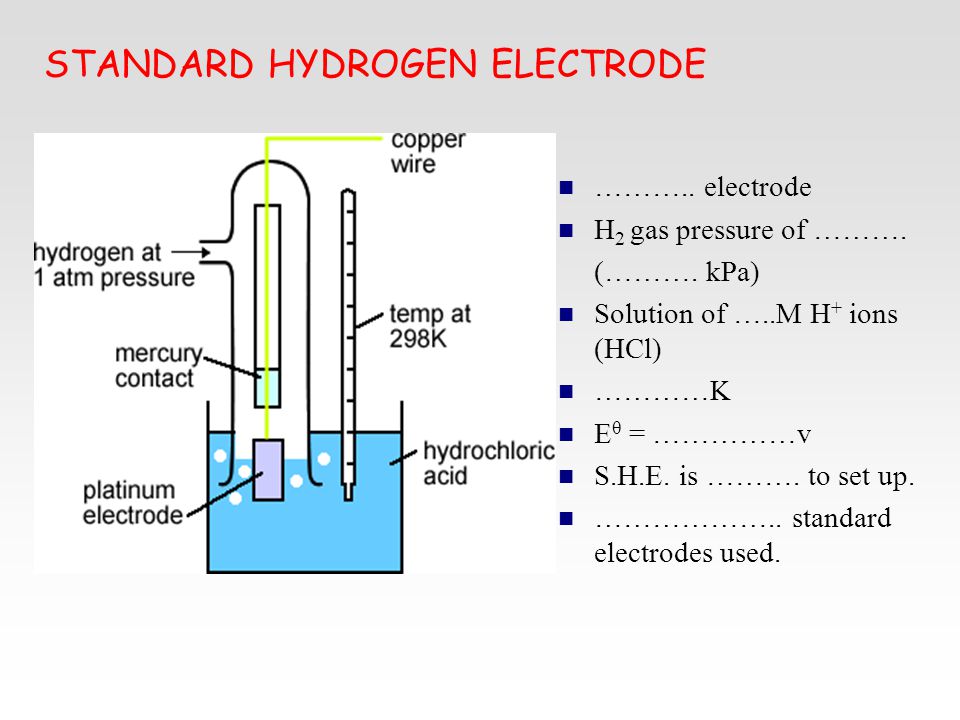 0 x 10 7 моль дм 3 , без проблем
по ионизации здесь! и 1 молярный раствор теоретически дает
1 молярный раствор ионов водорода.
0 x 10 7 моль дм 3 , без проблем
по ионизации здесь! и 1 молярный раствор теоретически дает
1 молярный раствор ионов водорода. 36В, ты
может происходить окисление иона хлорида у водорода
электрод.
36В, ты
может происходить окисление иона хлорида у водорода
электрод.

 ), Но больше ничего не цитируйте,
и есть альтернатива и абсолютно правильный и универсальный
ответ!
), Но больше ничего не цитируйте,
и есть альтернатива и абсолютно правильный и универсальный
ответ! ) или Cu 2+ (водн.) ионы.
) или Cu 2+ (водн.) ионы.


 34 + 0,00 = + 0,34 В
34 + 0,00 = + 0,34 В  ион с полуячейкой с ионом медь / медь (II) выше.
ион с полуячейкой с ионом медь / медь (II) выше. ) || H + (водн.) | H 2 (г) | Pt
) || H + (водн.) | H 2 (г) | Pt 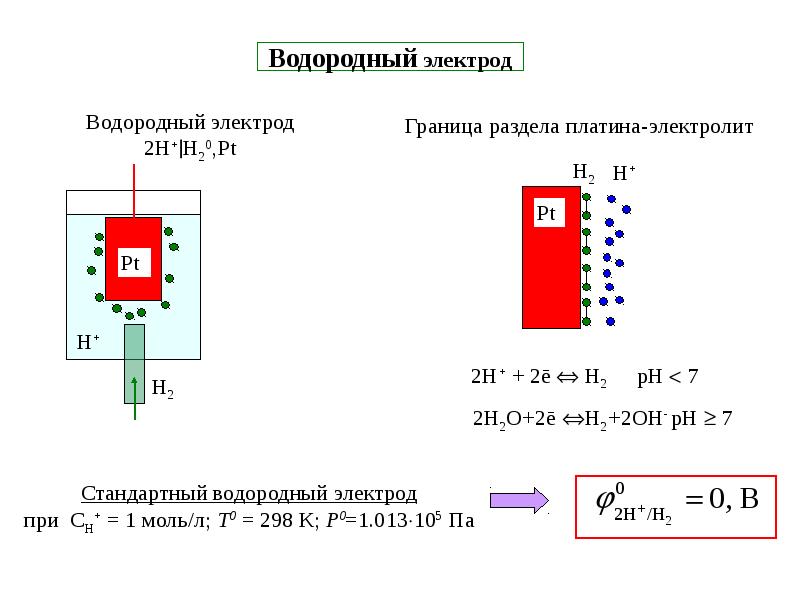 ) ==> Zn 2+ (водн.) + H 2 (г)
) ==> Zn 2+ (водн.) + H 2 (г)  6 показано, как измерить
стандартный потенциал полуэлемента, состоящего из элемента в два
различные степени окисления в водном растворе .
6 показано, как измерить
стандартный потенциал полуэлемента, состоящего из элемента в два
различные степени окисления в водном растворе . ) || Fe 3+ (водн.) , Fe 2+ (водн.) | Pt
) || Fe 3+ (водн.) , Fe 2+ (водн.) | Pt 