| ЗАДАЧНИК ОНЛ@ЙН БИБЛИОТЕКА 1 БИБЛИОТЕКА 2 Температура внутренних слоев ЗемлиТемпература атмосферы на различной высоте над Землей
В зависимости от вертикального распределения температуры атмосферу делят на пять слоев: тропосферу (высота нижней и верхней границы тропосферы от 0 до 11-16 км), стратосферу (от 11-16 до 50-55 км), мезосферу (от 50-55 до 80 км), термосферу (от 80 до 600-800 км) и экзосферу (выше 600-800 км). Как известно, зависимость температуры кипения воды от давления характеризируется
уравнением Клаузиуса-Клапейрона – P2/P1 = EXP(qμв/R(1/T1-1/T2)),
а зависимость давления от высоты барометричкеской формулой – P=PoEXP(-μгgh/RT).
| Температура веществ. Температура плавления веществ. Температура кипения веществ. Температура плавления таблица.Температура веществ
Температура кипения tкип веществ (при нормальном атмосферном давлении)
Температура кипения воды при различных давлениях | ||||
Давление | tкипoC | Давление | tкипoC | ||
кПа | мм рт. | кПа | мм рт. ст. | ||
0,6 | 4,6 | 0 | 70,1 | 526,0 | 90 |
1,2 | 9,2 | 10 | 84,5 | 634,0 | 95 |
2,3 | 17,5 | 20 | 90,7 | 680,0 | 96,9 |
4,2 | 31,8 | 30 | 93,3 | 700 | 97,7 |
7,4 | 55,3 | 40 | 94,7 | 710 | 98,1 |
12,3 | 92,5 | 50 | 96,0 | 720 | 98,5 |
31,1 | 233,7* | 70 | 97,3 | 730 | 98,9 |
38,5 | 289,0** | 75 | 98,7 | 740 | 99,3 |
53,7 | 403,0*** | 83 | 100,0 | 750 | 99,6 |
101,325 | 760 | 100,0 | |||
* Такое примерно давление атмосфнры на вершине самой высокой горы в мире
— Эвереста (Гималаи, 8848 м).
** Такое примерно давление атмосферы на горной
вершине Памир (7495 м).
*** Такое примерно давление атмосферы на вершине горы
Казбек (5043 м).
Температура кипения воды при повышенных давлениях
Давление | tкипoC | Давление | tкипoC | ||
МПа | ат | МПа | ат | ||
0,098 | 1,0 | 99 | 3,08 | 31,5 | 236 |
0,196 | 2,0 | 120 | 3,82 | 39,0 | 248 |
0,29 | 3,0 | 133 | 4,90 | 50,0 | 263 |
0,3 | 4,0 | 143 | 9,81 | 100,0 | 310 |
0,49 | 5,0 | 151 | 11,77 | 120,0 | 324 |
0,59 | 6,0 | 158 | 13,73 | 140,0 | 335 |
0,69 | 7,0 | 164 | 14,71 | 150,0 | 341 |
0,78 | 8,0 | 170 | 16,67 | 170,0 | 351 |
0,88 | 9,0 | 174 | 19,61 | 200,0 | 364 |
0,98 | 10,0 | 179 | 21,57 | 220,0 | 372 |
1,56 | 16,0 | 200 | 22,13 | 225,65 | 374,15 |
1,96 | 20,0 | 211 | |||
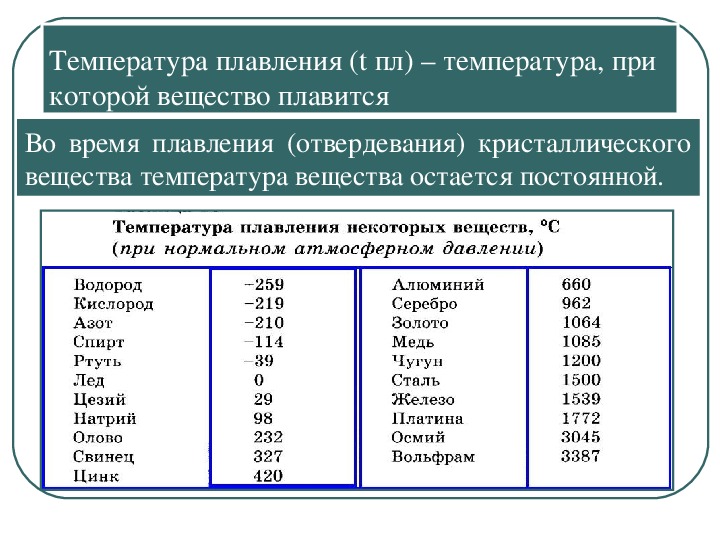
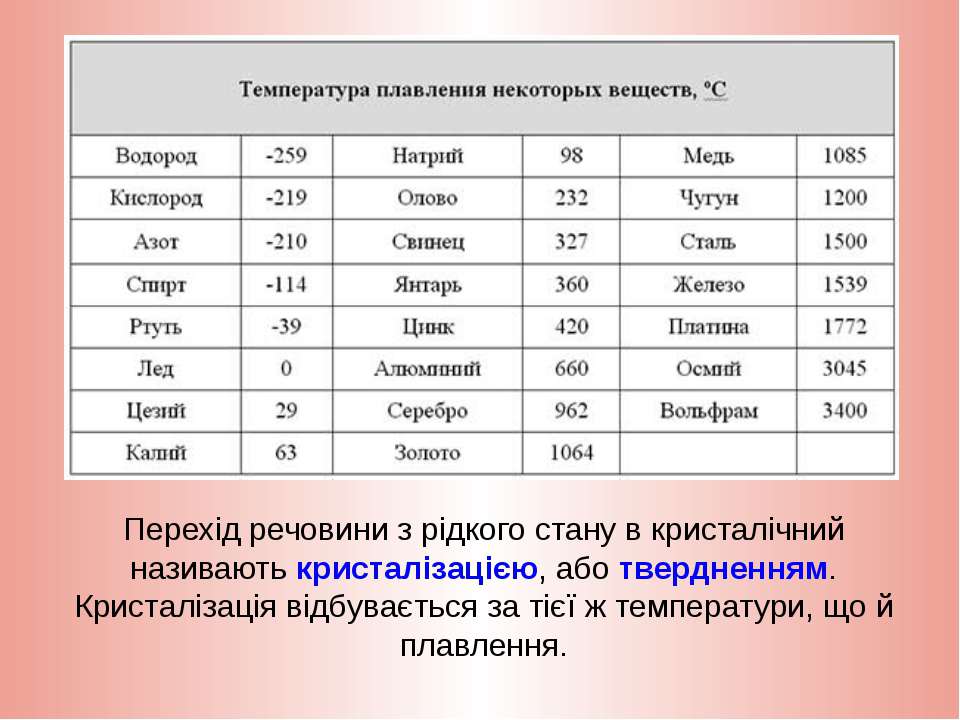
Температура плавления разлчных веществ Таблица
(при нормальном атмосферном давлении)
Вещество | tплoC | Вещество | tплoC |
| Азот | -210,0 | Молоко цельное | — 0,6 |
| Алмаз | > 3500 | Масло сливочное | 28-33 |
| Бензин | ниже -60 | Нафталин | 80,3 |
| Вазелин | 37-52 | Нефть | — 60 |
| Вода | 0,00 | Парафин | 38-56 |
| Вода тяжелая | 3,82 | Соль поваренная | 770 |
| Водород | -259,1 | Скипидар | — 10 |
| Воздух | -213 | Спирт | — 114,2 |
| Воск пчелиный | 61-64 | Стеарин | 71,6 |
| Глицерин | 18 | Фреон-12 | — 155 |
| Йод | 113,5 | Хлор | — 101,0 |
| Керосин | ниже -50 | Эфир | — 116,0 |
| Кислород | -218,4 |
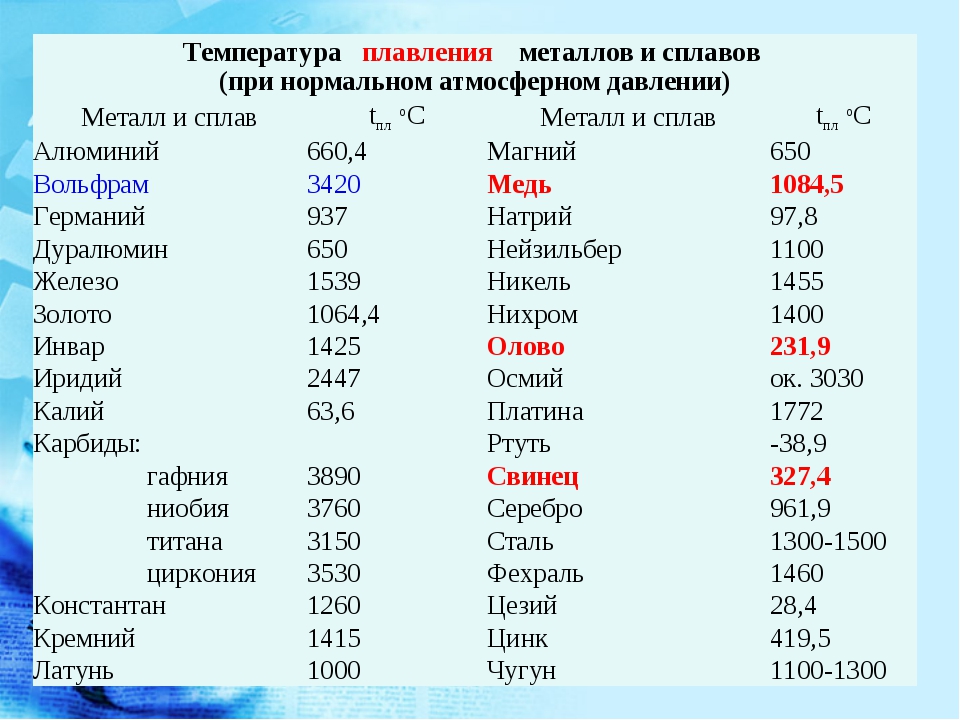
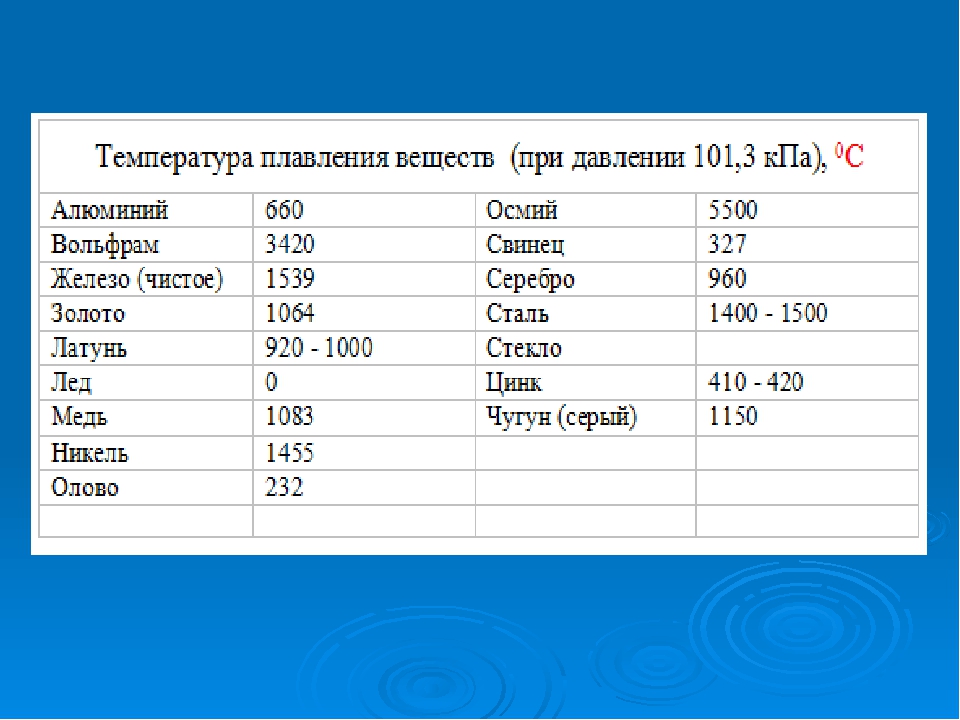
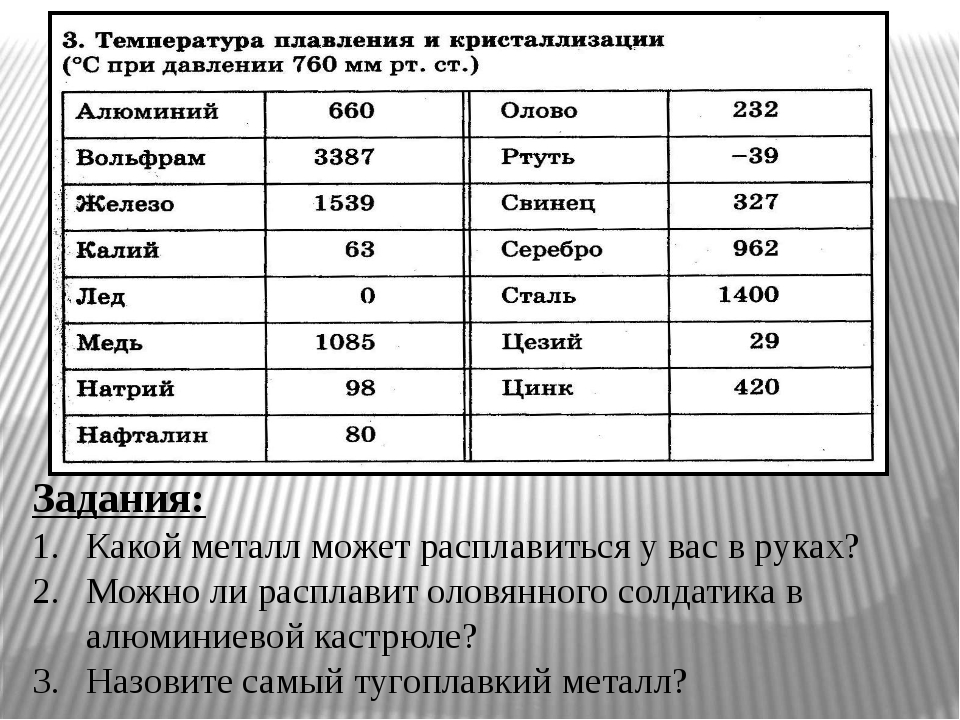
Температура плавления металлов и сплавов
(при нормальном атмосферном давлении)
Металл и сплав | tплoC | Металл и сплав | tплoC |
| Алюминий | 660,4 | Магний | 650 |
| Вольфрам (наиболее тугоплавкий из металлов | 3420 | медь | 1084,5 |
| Германий | 937 | Натрий | 97,8 |
| Дуралюмин | 650 | Нейзильбер | 1100 |
| Железо | 1539 | Никель | 1455 |
| Золото | 1064,4 | Нихром | 1400 |
| Инвар | 1425 | Олово | 231,9 |
| Иридий | 2447 | Осмий | ок. 3030 3030 |
| Калий | 63,6 | Платина | 1772 |
| Карбиды: | Ртуть | -38,9 | |
| гафния | 3890 | Свинец | 327,4 |
| ниобия | 3760 | Серебро | 961,9 |
| титана | 3150 | Сталь | 1300-1500 |
| циркония | 3530 | Фехраль | 1460 |
| Константан | 1260 | Цезий (наиболее легкоплавкий из металлов) | 28,4 |
| Кремний | 1415 | Цинк | 419,5 |
| Латунь | 1000 | Чугун | 1100-1300 |
…
| ЗАДАЧНИК ОНЛ@ЙН БИБЛИОТЕКА 1 БИБЛИОТЕКА 2 | Удельная теплота плавления. Удельная теплота парообразования (испарения). Критические параметры некоторых веществ. Удельная теплота сгорания.Удельная теплота плавления металлов
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Изменение объемов веществ при их плавленииВ таблице укзан объем жидкости Vж, образующийся при плавлении твердых тел из различных веществ объемом 1000 см3
Большинство веществ при переходе из твердого состояния
в жидкое увеличивает свой объем. Удельная теплота испарения (парообразования) воды при различной температуре | ||||
t, oC | Удельная теплота испарения | t, oC | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| 0 | 2501 | 597 | 80 | 2308 | 551 |
| 5 | 2489 | 594 | 100 | 2256 | 539 |
| 10 | 2477 | 592 | 160 | 2083 | 497 |
| 15 | 2466 | 589 | 200 | 1941 | 464 |
| 18 | 2458 | 587 | 300 | 1404 | 335 |
| 20 | 2453 | 586 | 370 | 438 | 105 |
| 30 | 2430 | 580 | 374 | 115 | 27 |
| 50 | 2382 | 569 | 374,15* | 0 | 0 |
* При температуре 374,15 oC и давлении
22,13 Па (225,64 ат) вода находится в критическом состоянии.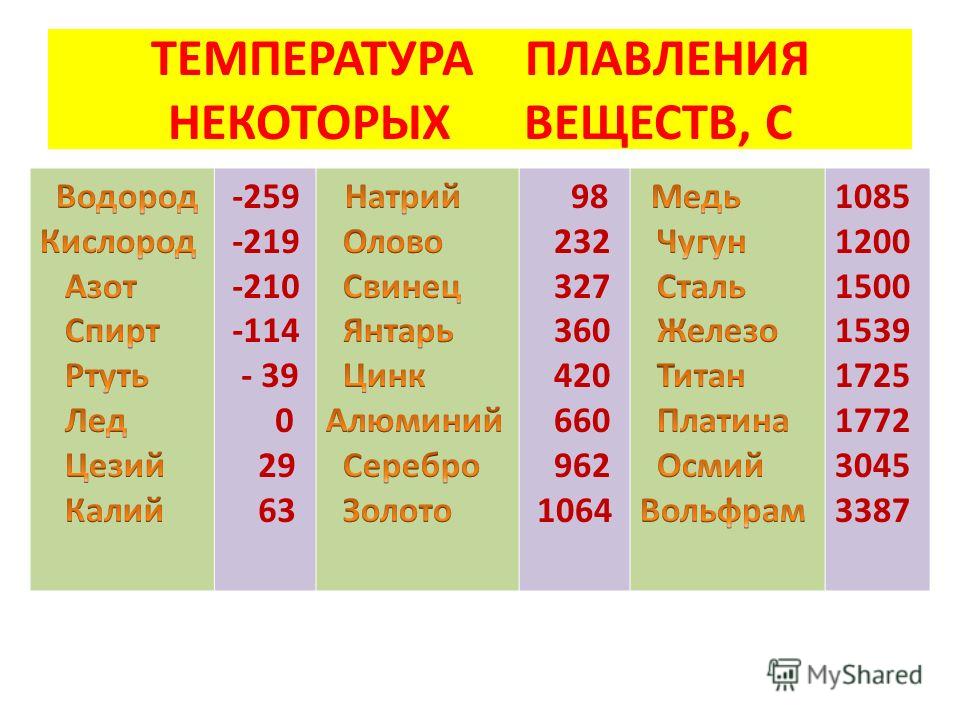 В этом состоянии
жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между
водой и ее насыщенным паром исчезает.
В этом состоянии
жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между
водой и ее насыщенным паром исчезает.
Изменение объемов жидкостей при испарении и газов (паров) при конденсации
Испаряющаяся жидкость | Vг, л | Конденсирующийся газ (пар) | Vж, л |
| Азот | 716 | Азот | 1,42 |
| Вода (при ) | 1780 | Водяной пар | 0,737 |
| Воздух | 749 | Воздух | 1,38 |
| Гелий | 774 | Гелий | 1,31 |
| Кислород | 886 | Кислород | 1,15 |
| Метан | 656 | Метан | 1,55 |
В таблице указан объем газа (пара), образующегося при
испарении 1л жидкости, взятой при температу ре 20 oС и нормальном
атмосферном давлении, а также объем жидкости образующейся при конденсации 1
м3 газа (пара).
Удельная теплота парообразования жидкостей и расплавленных металлов
(при температуре кипения и нормальном атмосферном давлении)Жидкость | Удельная теплота испарения | Жидкость | Удельная теплота испарения | ||
кДж/кг | кал/кг | кДж/кг | кал/кг | ||
| Азот жидкий | 201 | 48 | Водород жидкий | 450 | 108 |
| Алюминий | 9200 | 2200 | Воздух | 197 | 47 |
| Бензин | 230-310 | 55-75 | Гелий жидкий | 23 | 5,5 |
| Висмут | 840 | 200 | Железо | 6300 | 1500 |
| Вода (при t=0 oC) | 2500 | 597 | Керосин | 209-230 | 50-55 |
| Вода (при t=20 oC) | 2450 | 586 | Кислород жидкий | 214 | 51 |
| Вода (при t=100 oC) | 2260 | 539 | Магний | 5440 | 1300 |
| Вода (при t=370 oC) | 440 | 105 | Медь | 4800 | 1290 |
| Вода (при t=374,15 oC) | 0 | 0 | Олово | 3010 | 720 |
| Ртуть | 293 | 70 | |||
| Свинец | 860 | 210 | |||
| Спирт этиловый | 906 | 216 | |||
| Эфир этиловый | 356 | 85 | |||
Удельная теплота испарения (парообразования) некоторых твердых веществ
Вещество | Удельная теплота испарения | Вещество | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Йод | 226 | 54 | Мышяк | 427 | 102 |
| Камфара | 387,2 | 92,5 | Сухой лед | 586 | 140 |
| Лед | 2834 | 677 | |||
Примечание. Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Критические параметры некоторых веществ
Вещество | Критическая температура, oC | Критическая плотность, кг/м3 | Критическое давление | |
МПа | ат | |||
| Азот | -147.1 | 311 | 3.39 | 34.6 |
| Аммиак | 132.4 | 235 | 11.5 | 117 |
| Ацетилен | 35.7 | 231 | 6.24 | 63.7 |
| Вода | 374.2 | 307 | 22. 13 13 | 225.65 |
| Водород | -239.9 | 31.0 | 1.30 | 13.5 |
| Воздух | -140.7 | 350 | 3.77 | 38.5 |
| Гелий | -267.9 | 69.3 | 0.23 | 2.3 |
| Кислород | -118.8 | 430 | 5.04 | 51.4 |
| Нафталин | 469 | 314 | 3.98 | 40.6 |
| Оксид углерода (II) | -139 | 301 | 3.5 | 36 |
| Оксид углерода (IV) | 31.0 | 460 | 7.35 | 75.0 |
| Спирт | 243.5 | 276 | 6.38 | 65.2 |
| Хлор | 144.0 | 573 | 7.70 | 78.5 |
| Эфир | 193.8 | 260 | 3.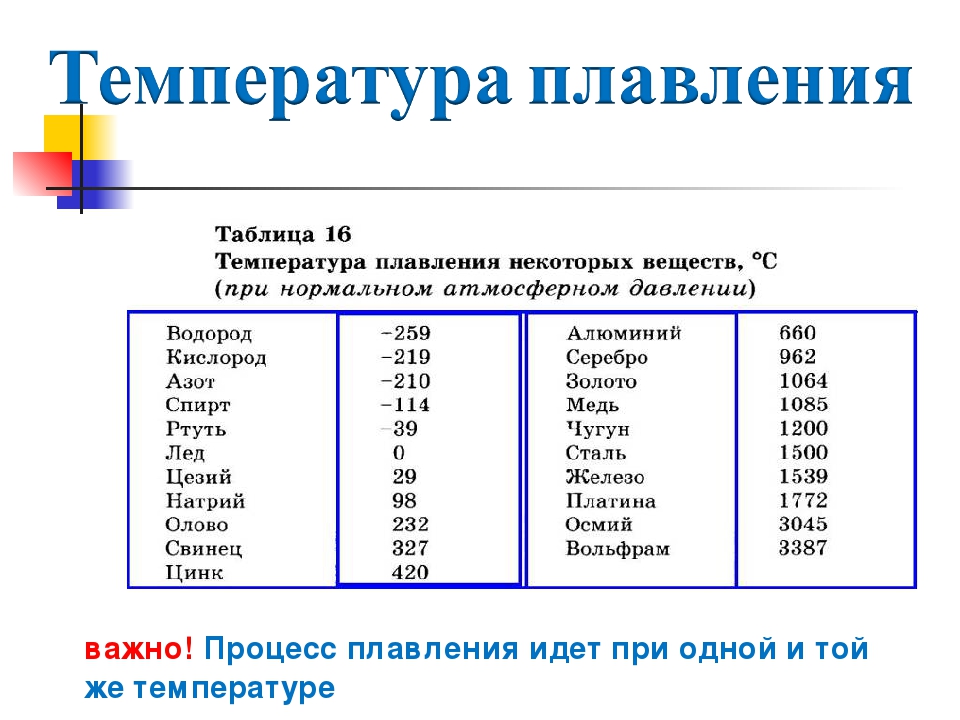 60 60 | 37.0 |
Удельная теплота сгорания некоторых пищевых продуктов
Продукт | Удельная теплота сгорания | Продукт | Удельная теплота сгорания | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Батоны простые | 10470 | 2500 | Мясо куриное | 5380 | 1280 |
| Виноград | 2400 | 700 | Огурцы свежие | 570 | 140 |
| Говядина | 7520 | 1800 | Окунь, щука | 3520 | 840 |
| Земляника садовая | 1730 | 443 | Сахар | 17150 | 4100 |
| Картофель | 3770 | 900 | Сметана | 14800 | 3530 |
| Кефир | 2700 | 640 | Смородина черная | 2470 | 590 |
| Малина | 1920 | 460 | Хлеб пшеничный | 8930 | 2130 |
| Масло сливочное | 32700 | 7800 | Хлеб ржаной | 8620 | 2060 |
| Молоко | 2800 | 670 | Яблоки | 2010 | 480 |
| Морковь | 1720 | 400 | Яйца | 6900 | 1650 |
| Мороженое сливочное | 7500 | 1790 | |||
Удельная теплота сгорания различных видов топлива и некоторых веществ
Топливо, вещество | Удельная теплота сгорания | |
МДж/кг | калл/кг | |
| Условное топливо | 29,3 | 7000 |
Твердое | ||
| Антрацит | 26,8-31,4 | 6400-7500 |
| Древесный уголь | 31,5-34,4 | 7500-8200 |
| Дрова (воздушно-сухие) | 8,4-11 | 2000-2500 |
| Каменный уголь | ≈ 27 | ≈ 6500 |
| Порох | 3,8 | 900 |
| Сланцы горючие | 7,5-15,0 | 1800-3600 |
| Твердые ракетные топлива | 4,2-10,5 | 100-2500 |
| Торф | 10,5-14,5 | 2500-3500 |
| Тротил (взрывчатое вещество) | 15 | 3600 |
| Уголь: | ||
| канско-акчинский | 15,5 | 3700 |
| подмосковный | 10,5 | 2500 |
| челябинский | 14,6 | 3500 |
| экибастузский | 16,1 | 3840 |
Жидкое | ||
| Бензин | 44-47 | 10500-11200 |
| Дизельное автотракторное | 42,7 | 10200 |
| Керосин | 44-46 | 10500-11000 |
| Нефть | 43,5-46 | 10400-11000 |
| Спирт | 27,0 | 6450 |
| Топливо для ЖРД (керосин + жидкий кислород) | 9,2 | 2200 |
| Топливо для реактивных двигателей самолетов (ТС-1) | 42,9 | 10250 |
Газообразное | ||
| Ацетилен | 48,1 | 11500 |
| Водород | 120 | 28600 |
| Газ природный | 41-49 | 9800-11700 |
| Метан | 50,0 | 11950 |
| Оксид углерода (II) | 10,1 | 2420 |
.
 ..
..Твердые тела | Температура плавления, С° |
2 — Метил — 2 — Пропанол | 25,5 |
Адамсит, NH(C6h5)2AsCl | 195 |
Адомантан, C10h26 | 296 |
Акриламид | 84,5 |
Антрахинон, C14H8O2 | 286 |
Антрацен | 216 |
Арсенид серебра, Ag3As | 1740 |
Асбест | 1500 |
Белый фосфор | 44,14 |
Бензоила пероксид, (C6H5COO)2 | 106 — 108 |
Бор | 2075 |
Бора карбид | 2350 |
Бора нитрид (баразон) | 3200 |
Бора оксид | 450 |
Бромбензилцианид | 25,4 |
Графит (при давлении 12МПа) | 3750 |
Йод | 113,5 |
Калий — гидроксид, KOH | 404 |
Кварц | 1728 |
Кремнезём, кварц | 1713 |
Кремний кристаллический | 1420 |
Лёд | 0 |
Литий — фторид, LiF | 845,1 |
Метааминофенол | 123 |
Натрий — хлорид | 800,8 |
Ортоаминофенол | 174 |
Осмия оксид, OsO4 | 41 |
Парааминофенол | 186 |
Рутения оксид, RuO4 | 25,4 |
Сахароза | 185 — 186 |
Селен (тригональный) | 217 |
Сера | 112,8 |
Серебро (l) — хлорид, AgCl | 455 |
Теллур (тригональный) | 449,8 |
Фторид натрия, NaF | 995 |
Хлористый калий, KCl | 776 |
Хлорофос | 83 — 84 |
Хлоруксусная кислота | 62,3 |
Циклогексанол, C6h21OH | 25,15 |
Цинк — хлорид, ZnCl2 | 293 |
Цирконий — диоксид, ZrO2 | 2700 |
Щавелевая кислота, C2h3O4 | 189,5 |
Янтарная кислота | 185 |
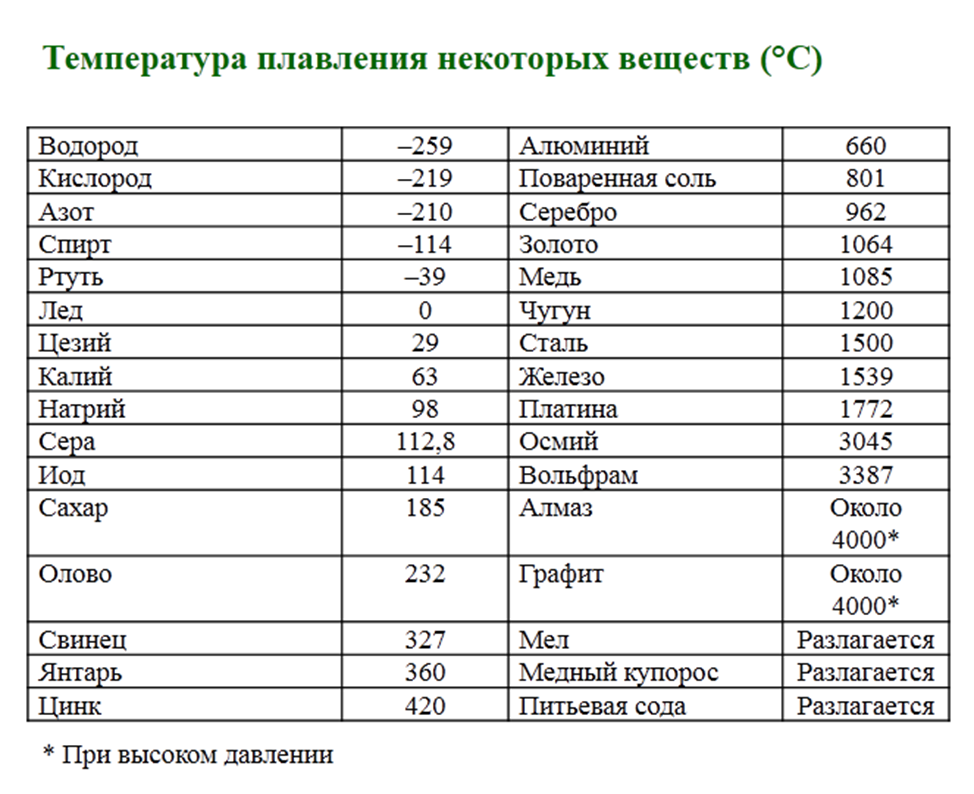
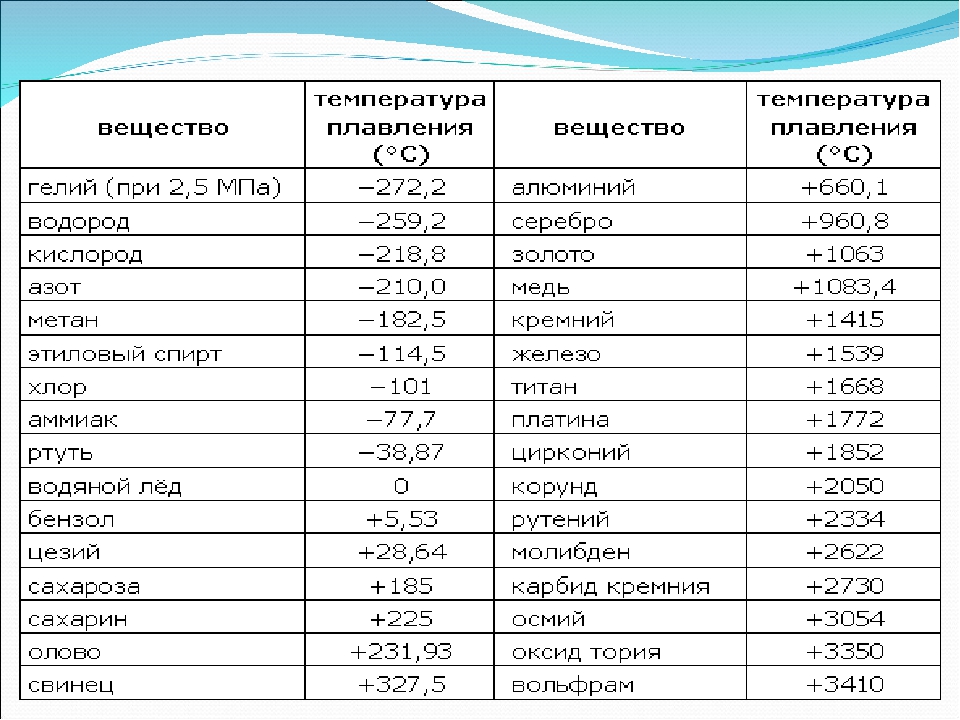
Температура кипения и плавления простых веществ (Таблица)
В таблице приводятся температуры кипения и плавления простых веществ (химических элементов). Цифры в скобках обозначают, что вещество при данной температуре и разлагается.
Цифры в скобках обозначают, что вещество при данной температуре и разлагается.
Сокращения: г.— газ; ж. — жидкость; тв. — твердое вещество: возг. — возгорается; ромб. — ромбическая.
Название элемента | Символ | Состояние | Температура плавления | Температура кипения, °С |
Азот | N | Г. | —209,86 | —195,8 |
Актиний | Ас | ТВ. | ~1040 | ~3300 |
Алюминий | Аl | ТВ. | 660,1 | ~2500 |
Америций | Ат | ТВ. | ~1200 | ~2600 |
Аргон | Аr | Г. | —189,2 | —185,7 |
Астат | At |
|
| 334 |
Барий | Ва | ТВ. | 710 | 1640 |
Бериллий | Be | ТВ. | 1285 | 2970 |
Бор | В | ТВ. | ~2075 | ~3800 |
Бром | Вr | Ж. | —7,3 | 58,8 |
Ванадий | V | ТВ. | 1900 | 3400 |
Висмут | Bi | ТВ. | 271,3 | ~1560 |
Водород | Н | Г. | —259,18 | —252,8 |
Вольфрам | W | ТВ. | 3380 | 5900 |
Гадолиний | Gd | ТВ. | 1312 | ~1500 |
Галлий | Ga | Ж. | 29,8 | ~2230 |
Гафний | Hf | ТВ. | ~2230 | ~5400 |
Гелий | Не | Г. | —272,2 | —268,9 |
Германий | Ge | ТВ. | 936 | 2700 |
Гольмий | Но | ТВ. | 1500 | ~2380 |
Диспрозий | Dy | ТВ. | 1380 | ~2330 |
Европий | Eu | ТВ. | ~900 | ~1430 |
Железо | Fe | ТВ. | ~1535 | ~3000 |
Золото | Au | ТВ. | 1063 | ~2847 |
Индий | In | ТВ. | ~155 | ~2000 |
Йод | J | ТВ. | 114 | 183 |
Иридий | Ir | ТВ. | 2450 | ~500 |
Иттербий | Yb | ТВ. | 824 | ~132 |
Иттрий | Y | ТВ. | ~1500 | 3020 |
Кадмий | Cd | ТВ. | 321,03 | 7670 |
Калий | К | ТВ. | 62,3 | ~7605 |
Кальций | Ca | ТВ. | 850 | 1482 |
Кислород | О | Г. | —218,4 | —182,97 |
Озон |
| Г. | —251 | —112 |
Кобальт | Со | ТВ. | ~1490 | ~2900 |
Кремний | Si | ТВ. | 1420 | ~2600 |
Криптон | Кr | Г. | —157 | —152,9 |
Ксенон | Хе | Г. | —112 | —108,1 |
Кюрий | Сm | ТВ. | … | … |
Лантан | La | ТВ. | 920 | ~3470 |
Литий | Li | ТВ. | 186 | ~(1370) |
Лютенций | Lu | ТВ. | 1675 | ~2680 |
Магний | Mg | ТВ. | 651 | ~1110 |
Марганец | Mn | ТВ. | 1260 | ~1900 |
Медь | Cu | ТВ. | 1083 | ~2300 |
Молибден | Mo | ТВ. | 2625 | ~3700 |
Мышьяк | As | ТВ. | 814 (36 бар) | 615, возг. |
Натрий | Na | ТВ. | 97,5 | ~880 |
Неодим | Nd | ТВ. | 1024 | 3210 |
Неон | Ne | Г. | —248,67 | —245. |
Нептуний | Np | ТВ. | 640 | … |
Никель | Ni | ТВ. | 1453 | 2900 |
Ниобий | Nb | ТВ. | (2500) | 3700 |
Олово | Sn | ТВ. | 231,91 | 2270 |
Осмий | Os | ТВ. | 2700 | >5300 |
Палладий | Pd | ТВ. | 1552 | >2500 |
Платина | Pt | ТВ. | 1773,5 | 4300 |
Плутоний | Pu | ТВ. | 673 | 3230 |
Полоний | Po | ТВ. | 254 | 952 |
Празеодим | Pr | ТВ. | 940 | 3017 |
Прометий | Pm | ТВ. | ~1000 | … |
Протактиний | Pa | ТВ. | ~1400 | ~4000 |
Радий | Ra | ТВ. | 960 | 1140 |
Радон | Rn | Г. | —71 | —61,8 |
Рений | Re | ТВ. | 3170 | >5440 |
Родий | Rh | ТВ. | 1966 | >3000 |
Ртуть | Hg | Ж. | —38,87 | 356,58 |
Рубидий | Rb | ТВ. | 38,5 | 700 |
Рутений | Ru | ТВ. | 1950 | (2700) |
Самарий | Sm | ТВ. | 1072 | 1670 |
Свинец | Pb | ТВ. | 327,3 | 1740 |
Селен | Se | ТВ. | 220 | 688 |
Сера (ромб.) | S | ТВ. | 112,8 | 444,60 |
Серебро | Ag | ТВ. | 960,8 | ~2160 |
Скандий | Sc | ТВ. | 1200 | 2400 |
Стронций | Sr | ТВ. | 725 | 1150 |
Сурьма | Sb | ТВ. | 630 | 1380 |
Таллий | TI | ТВ. | 302,5 | 1457 |
Тантал | Та | ТВ. | 3000 | (4100) |
Теллур | Те | ТВ. | 452 | 1390 |
Тербий | Tb | ТВ. | 1368 | 2480 |
Технеций | Тс | ТВ. | ~2300 | ~4700 |
Титан | Ti | ТВ. | ~1800 | >3000 |
Торий | Th | ТВ. | 1845 | >3000 |
Тулий | Tu | ТВ. | 1600 | 1720 |
Углерод алмаз | С | ТВ. | >3500 | 4200 |
Углерод графит | C | ТВ. | 3600 | ~4200 |
Уран | U | ТВ. | (1150) | ~3900 |
Фосфор белый | P | ТВ. | 44,1 | 280 |
фосфор красный | P | ТВ. | 590 (43 бар) | 423, возг. |
Франций | Fr | ТВ. | 17,5 | … |
Фтор | F | Г. | —223 | —187 |
Хлор | Cl | Г. | —102 | —34,1 |
Хром | Сг | ТВ. | 1615 | 2200 |
Цезий | Cs | ТВ. | 28,5 | 670 |
Церий | Се | ТВ. | 804 | ~3000 |
Цинк | Zn | ТВ. | 419,5 | 907 |
Цирконий | Zr | ТВ. | ~1900 | ~4000 |
Эрбий | Ег | ТВ. | 1525 | ~2500 |
Температура кипения металлов (Таблица)
Справочная таблица по химии содержит информацию по температуре кипения металлов. Будет полезна для школьников и студентов при изучении химии, а также для подготовки к экзаменам и ЕГЭ.
Смотрите также таблицу «температура кипения твердых тел».
Металлы | Температура кипения, С° |
Актиний | 3300 |
Албминий | 2467 |
Барий | 1860 |
Бериллий | 2470 |
Висмут | 1550 |
Вольфрам | 5657 |
Галлий | 2205 |
Германий | 2850 |
Железо | 3050 |
Золото | 2807 |
Индий | 2000 |
Иридий | 4400 |
Итрий | 3300 |
Кадмий | 767 |
Кальций | 1495 |
Кобальт | 2960 |
Лантан | 3450 |
Магний | 1095 |
Медь | 2567 |
Никель | 2900 |
Олово | 2620 |
Осмий | 5027 |
Палладий | 2940 |
Платина | 3800 |
Радий | 1500 |
Родий | 3700 |
Ртуть | 357 |
Рутений | 4200 |
Свинец | 1475 |
Серебро | 2212 |
Скандий | 2850 |
Стронций | 1390 |
Сурьма | 1634 |
Таллий | 1475 |
Хром | 2672 |
Цинк | 906,2 |
Плотность, температура плавления и кипения простых веществ: таблицы для элементов
В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
Указаны плотность и температуры плавления и кипения следующих простых веществ: азот N2, актиний Ac, алюминий Al, америций Am, аргон Ar, астат At, барий Ba, бериллий Be, бор B, бром Br, ванадий V, висмут Bi, водород H2, вольфрам W, гадолиний Gd, галлий Ga, гафний Hf, гелий He, германий Ge, гольмий Ho, диспрозий Dy, европий Eu, железо Fe, золото Au, индий In, йод (иод) J, иридий Ir, иттербий Yb, иттрий Y, кадмий Cd, калий K, кальций Ca, кислород O2, озон O3, кобальт Co, кремний Si, криптон Kr, ксенон Xe, кюрий Cm, лантан La, литий Li, лютеций Lu, магний Mg, марганец Mn, медь Cu, молибден Mo, мышьяк As, натрий Na, неодим Nd, неон Ne, нептуний Np, никель Ni, ниобий Nb, олово Sn, осмий Os, палладий Pd, платина Pt, плутоний Pu, полоний Po, празеодим Pr, прометий Pm, протактиний Pa, радий Ra, радон Rn, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, самарий Sm, свинец Pb, селен Se, сера S, серебро Ag, скандий Sc, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, тербий Tb, технеций Tc, титан Ti, торий Th, тулий Tu, углерод C (алмаз, графит), уран U, фосфор P (белый, красный), франций Fr, фтор F, хлор Cl, хром Cr, цезий Cs, церий Ce, цинк Zn, цирконий Zr, эрбий Er.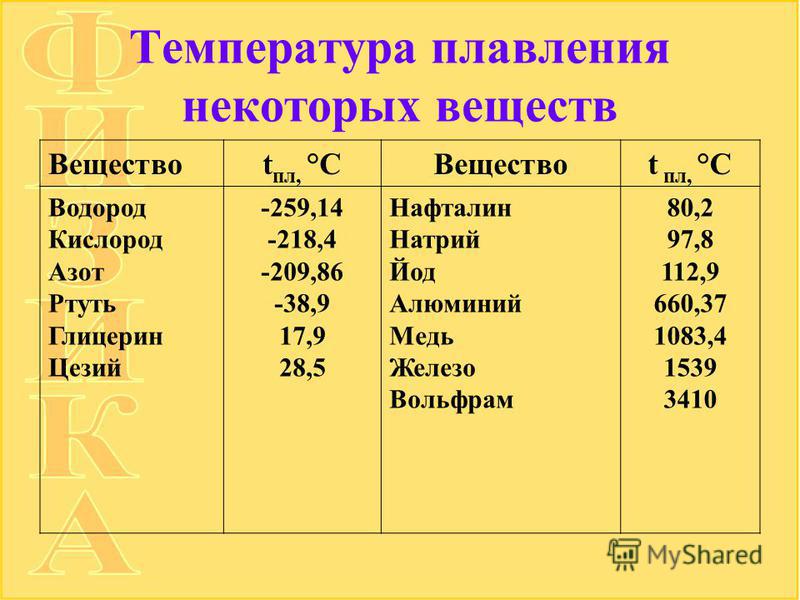
Следует отметить, что плотность веществ в таблице выражена в размерности кг/м3. В таблице можно выделить вещества (химические элементы) с минимальной и максимальной плотностью. Наименьшей плотностью из химических элементов обладают газы — например, плотность водорода равна всего 0,08987 кг/м3 — это самый легкий газ на планете. Из тяжелых элементов высокой плотностью отличаются вольфрам, уран, нептуний, осмий и другие металлы.
Цифры в скобках означают, что вещество при данной температуре разлагается. Сокращения: г. — газ, ж. — жидкость, тв. — твердое вещество, возг. — возгоняется, ромб. — ромбическая структура.
По данным таблицы можно выделить вещества, обладающие минимальной и максимальной температурой плавления и кипения. Самую низкую температуру плавления имеет химический элемент гелий — его температура плавления равна минус 272,2 °С. Гелий также обладает и самой низкой температурой кипения.
Самую высокую температуру плавления среди простых веществ имеет такой химический элемент, как углерод в виде графита.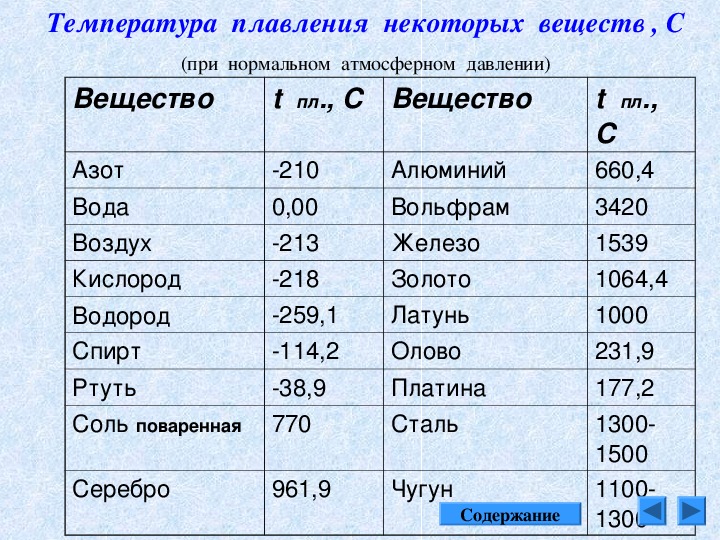 Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Самую высокую температуру кипения имеет элемент кадмий, он кипит при температуре не ниже 7670°С, хотя начинает плавиться всего лишь при 321°С.
Атомная масса и плотность простых веществ
В таблице приведена атомная масса и плотность следующих химических элементов: азот ,актиний, алюминий, америций, аргон, астат, барий, бериллий, берклий, бор, бром, ванадий, висмут, водород, вольфрам, гадолиний, галлий, гафний, гелий, германий, гольмий, диспрозий, европий, железо, золото, индий, йод, иридий, иттербий, иттрий, кадмий, калий, калифорний, кальций, кислород, кобальт, кремний, криптон, ксенон, кюрий, лантан, литий, лютеций, магний, марганец, медь, менделевий, молибден, мышьяк, натрий, неодим, неон, нептуний, никель, ниобий, олово, осмий, палладий, платина, плутоний, полоний, празеодим, прометий, протактиний, радий, радон, рений, родий, ртуть, рубидий, рутений, самарий, свинец, селен, сера, серебро, скандий, стронций, сурьма, таллий, тантал, теллур, тербий, технеций, титан, торий, тулий, углерод (графит, алмаз), уран, фермий, фосфор, франций, фтор, хлор, хром, цезий, церий, цинк, цирконий, эйнштейний, эрбий.
Указанные значения плотности соответствуют плотности веществ при температуре 20°С и атмосферном давлении, за исключением тех случаев, когда в скобках указана другая температура.
Плотность элементов дана в размерности тонна на кубометр. Например, плотность жидкого азота при температуре -195,8°С равна 0,808 т/м3 или 808 кг/м3; плотность хлора в газообразном состоянии равна 3,214 кг/м3, жидкого — 1557 кг/м3. Значения плотности веществ приведены для их естественного молекулярного и агрегатного состояний при указанной температуре.
Источники:
1. Писаренко В.В. Справочник лаборанта-химика. Справ. пособие для проф.-техн. учебн. заведений. М., «Высшая школа», 1970. — 192 стр. с илл.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
WebElements Periodic Table »Периодичность» Температура плавления »Гистограмма
- Список объектов недвижимости
- Изобилие
- Атомные числа
- Атомные радиусы
- Атомные спектры
- Атомная масса
- Блок в периодической таблице
- Температура кипения
- Энтальпия связи
- Длина связи в элементе
- Объемный модуль
- Регистрационный номер CAS
- Классификация
- Цвет
- Ковалентный радиус
- Критическая температура
- Кристаллическая структура
- Плотность твердого вещества
- Описание
- Открытие
- Эффективный ядер.
 сборы
сборы - Связь электронов. энергия
- Удельное электрическое сопротивление
- Сродство к электрону
- Структура электронной оболочки
- Электроотрицательность
- Электронная конфигурация
- Энтальпия: распыление
- Энтальпия плавления
- Коэффициент расширения
- Энтальпия: испарение
- Геология
- Название группы
- Групповые номера
- Твердость
- Опасности для здоровья
- История элемента
- Энтальпия гидратации
- Константы гидролиза
- Энергия ионизации
- Изоляция
- Изотопы
- Энергия решетки
- Диапазон жидкости
- Масса у человека
- Значение имени
- Точки плавления
- Молярный объем
- Наименования и символы
- ЯМР
- Orbital_properties
- Число окисления
- Номера периодов
- Коэффициент Пуассона
- Ионные радиусы
- Радиусов — ионный, Полинг
- Радиусы — металлик (12)
- Радиусы — валентная орбиталь
- Радиусов — Ван дер Ваальс
- Реакции элементов
- Понижающие потенциалы
- Понижающие потенциалы
- Отражательная способность
- Показатель преломления
- Модуль жесткости
- ГОСТ
- Сверхпроводимость
- Условное обозначение
- Теплопроводность
- Термодинамика
- использует
- Скорость звука
- Масса рентгеновского излучения абс.
 коэфф.
коэфф. - Модуль Юнга
- Температура плавления
- Галерея изображений
- Галерея Менделеева
- Heatscapes
- Гистограмма
- Группа 1
- Группа 2
- Группа 3
- Группа 4
- Группа 5
- Группа 6
- Группа 7
- Группа 8
- Группа 9
- Группа 10
- Группа 11
- Группа 12
- Группа 13
- Группа 14
- Группа 15
- Группа 16
- Группа 17
- Группа 18
- Период 2
- Период 3
- Период 4сп
- Период 4
- Период 4д
- Период 5сп
- Период 5спд
- Период 5д
- Период 6сп
- Период 6спд
- Период 6
- Период 6д
- Период 6f
- Период 7спд
- Период 7
- Период 7f
- s- и p-блок
- Д-Блок
- Блок f
WebElements Таблица Менделеева »Периодичность» Точка кипения »Галерея Менделеева
- Список объектов недвижимости
- Изобилие
- Атомные числа
- Атомные радиусы
- Атомные спектры
- Атомная масса
- Блок в периодической таблице
- Температура кипения
- Энтальпия связи
- Длина связи в элементе
- Объемный модуль
- Регистрационный номер CAS
- Классификация
- Цвет
- Ковалентный радиус
- Критическая температура
- Кристаллическая структура
- Плотность твердого вещества
- Описание
- Открытие
- Эффективный ядер.
 сборы
сборы - Связь электронов. энергия
- Удельное электрическое сопротивление
- Сродство к электрону
- Структура электронной оболочки
- Электроотрицательность
- Электронная конфигурация
- Энтальпия: распыление
- Энтальпия плавления
- Коэффициент расширения
- Энтальпия: испарение
- Геология
- Название группы
- Групповые номера
- Твердость
- Опасности для здоровья
- История элемента
- Энтальпия гидратации
- Константы гидролиза
- Энергия ионизации
- Изоляция
- Изотопы
- Энергия решетки
- Диапазон жидкости
- Масса у человека
- Значение имени
- Точки плавления
- Молярный объем
- Наименования и символы
- ЯМР
- Orbital_properties
- Число окисления
- Номера периодов
- Коэффициент Пуассона
- Ионные радиусы
- Радиусов — ионный, Полинг
- Радиусы — металлик (12)
- Радиусы — валентная орбиталь
- Радиусов — Ван дер Ваальс
- Реакции элементов
- Понижающие потенциалы
- Понижающие потенциалы
- Отражательная способность
- Показатель преломления
- Модуль жесткости
- ГОСТ
- Сверхпроводимость
- Условное обозначение
- Теплопроводность
- Термодинамика
- использует
- Скорость звука
- Масса рентгеновского излучения абс.
 коэфф.
коэфф. - Модуль Юнга
- Температура кипения
- Галерея изображений
- Галерея Менделеева
- Heatscapes
- Гистограмма
- Группа 1
- Группа 2
- Группа 3
- Группа 4
- Группа 5
- Группа 6
- Группа 7
- Группа 8
- Группа 9
- Группа 10
- Группа 11
- Группа 12
- Группа 13
- Группа 14
- Группа 15
- Группа 16
- Группа 17
- Группа 18
- Период 2
- Период 3
- Период 4сп
- Период 4
- Период 4д
- Период 5сп
- Период 5спд
- Период 5д
- Период 6сп
- Период 6спд
- Период 6
- Период 6д
- Период 6f
- Период 7
- Период 7f
- s- и p-блок
- Д-Блок
- Блок f
В какой момент плавится металл? Стол для плавки металлов
Металлы, как правило, имеют более высокую температуру плавления, чем многие другие материалы, и они могут менять форму под воздействием тепла — в отличие от древесины, которая просто разлагается. Когда температура становится достаточно высокой, ионы, из которых состоит металл, вибрируют все больше и больше, в конечном итоге разрывая связи его ионов и позволяя им двигаться свободно.
Когда температура становится достаточно высокой, ионы, из которых состоит металл, вибрируют все больше и больше, в конечном итоге разрывая связи его ионов и позволяя им двигаться свободно.
Когда внутренняя структура металла начинает сдвигаться и связи ослабляются, он становится жидкостью. Прочность связи, которая зависит от самого материала, обычно определяет температуру плавления металла. Некоторые металлические сплавы будут иметь более высокие или более низкие точки плавления, чем сами металлы, и они не всегда могут плавиться плавно.
Ваш путеводитель по плавке металлов
Обычно, когда кто-то спрашивает о температурах плавления металла, они ищут твердую температуру, до которой металл должен быть нагрет, что приводит к ожижению. Ниже представлена интерактивная таблица, которая основана на различных научных источниках для определения точек плавления различных металлов:
| Металл | Точка плавления (° F) | ||||||
|---|---|---|---|---|---|---|---|
| Латунь Admiralty | 1650 | ||||||
| Алюминий | 1220 | ||||||
| Алюминий 9011 905 905 905 905 905 905 905 Алюминий 905 — 1900 | |||||||
| Сурьма | 1170 | ||||||
| Бериллий | 2345 | ||||||
| Бериллий Медь | 1587 | ||||||
| 905 905 905 Желтый Латунь (красный) | 905|||||||
| Кадмий | 610 | ||||||
| Хром | 3380 | ||||||
| Кобальт | 2723 | ||||||
| Медь | 1983 | ||||||
| Медь | 1983 | ||||||
| 1945 | |||||||
| Сплав инконель | 2540 — 2600 | ||||||
| Иридий | 4440 | ||||||
| Железо (кованое) | 2700 | ||||||
| Железо (серое литье) | 2060 | ||||||
| 905 | 621 | ||||||
| Магний | 1200 | ||||||
| Сплав магния | 660-1200 | ||||||
| Марганец | 2271 | ||||||
| Марганец | Марганец | ||||||
| Молибден | 4750 | ||||||
| Никель | 2647 | ||||||
| Ниобий (колумбий) | 4473 | ||||||
| Осмий 7 | 111 | ||||||
| Платина | 3220 | ||||||
| Плутоний | 1180 | ||||||
| Калий | 146 | ||||||
| Красная латунь | 905 905 | 907 905 Красный Латунь | 907 3569 | ||||
| Рутений | 4500 | ||||||
| Селен | 423 | ||||||
| Кремний | 2572 | ||||||
| Серебро (чистое) Серебро (чистое) | 905 905 905 | Натрий | 208 9051 2 | ||||
| Сталь углеродистая | 2600 | ||||||
| Сталь нержавеющая | 2750 | ||||||
| Тантал | 5400 | ||||||
| Торий | 3180 902 | 4 | |||||
| Титан | 3040 |
Знакомство со сплавами
В нашем температурном списке присутствует множество металлических сплавов, но важно знать, что большинство из них имеют значительный температурный диапазон, которого они должны достичь.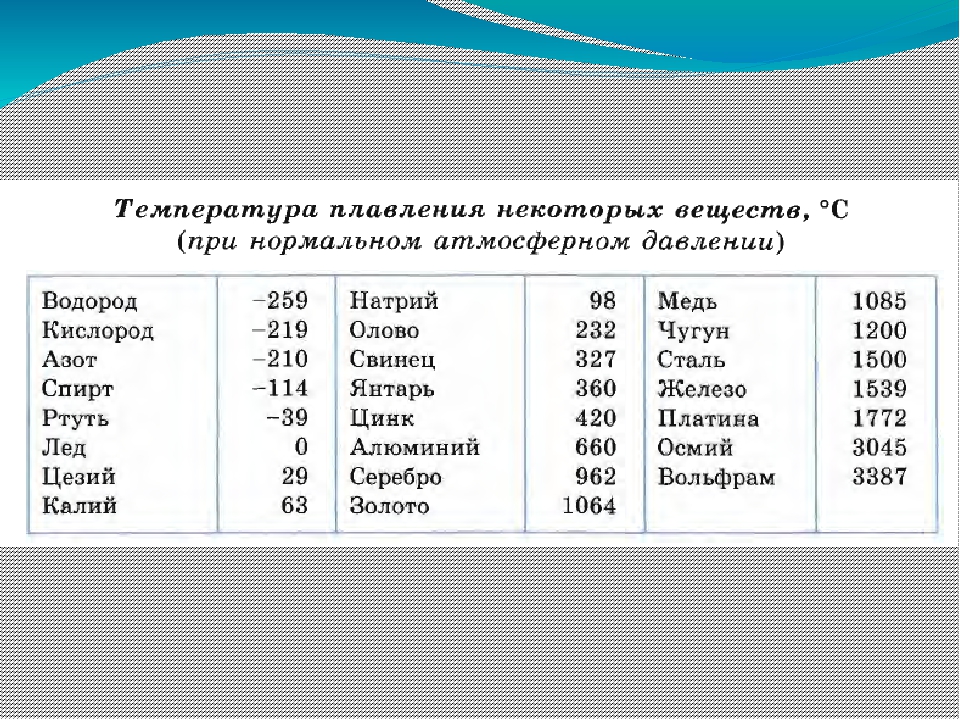 При изменении состава температура нагрева изменяется, и диапазоны расширяются примерно на 200 ° F.
При изменении состава температура нагрева изменяется, и диапазоны расширяются примерно на 200 ° F.
Диапазон сплава означает, что он начинает иметь жидкое и твердое состояния, иногда одновременно, когда вы приближаетесь к общему диапазону плавления.
Все сразу плавится
При работе с чистыми металлами вы, вероятно, заметите, что он плавится почти равномерно. Это контрастирует с другими элементами, такими как лед, который постепенно тает, и жидкость видна, в то время как куски твердого тела все еще находятся вокруг.
Теплопроводность — одна из главных причин такого равномерного плавления, поскольку металлы обладают исключительной теплопередачей. По сравнению со льдом, проводимость металла на порядки выше. Это означает, что если приложить тепло к одной части металлического стержня или стержня, то тепло будет распределяться очень равномерно по всей поверхности.
Чем плотнее металл, тем лучше его теплопроводность. Это позволяет металлообрабатывающим предприятиям безопасно применять тепло в одном месте, но при этом должным образом нагревать весь кусок металла.
металлов с высокой температурой плавления
Точка плавления вещества — это температура, при которой оно переходит из твердого состояния в жидкое. Металлы обладают высокой температурой плавления, поскольку они существуют в твердой кристаллической форме. Металлы с высокой температурой плавления имеют сильные межмолекулярные силы между атомами.Силы электростатического притяжения между ионами металлов и свободными электронами создают прочные металлические связи с более прочными связями, что приводит к более высоким температурам плавления.
Огнеупорные металлы
Есть два принятых определения тугоплавких металлов. Один утверждает, что металл должен иметь температуру плавления выше 2200 ° C, а другой утверждает, что все металлы с температурой плавления выше 1850 ° C считаются тугоплавкими металлами. В более широком смысле следующие 14 металлов классифицируются как тугоплавкие.
Металл | Точка плавления | Приложения |
Вольфрам (Вт) | 3420 ° С | Лампы накаливания, электроды сварочные, нагревательные элементы для печей |
Рений (Re) | 3180 ° С | Детали реактивных двигателей, легирование, нити для печей, рентгеновские аппараты |
Тантал (Ta) | 2966 ° С | Лопатки турбин двигателей, медицинские приборы, военные, полупроводники |
Молибден (Мо) | 2620 ° С | Покрытия, солнечные элементы, инструментальная и быстрорежущая сталь |
Ниобий (Nb) | 2468 ° С | Сверхпроводники, легирование стали, инструментальные стали, натриевые лампы |
Хром (Cr) | 1907 ° С | Легирование, покрытие, катализатор |
Гафний (Hf) | 2227 ° С | Управляющие стержни ядерных реакторов, легирование, микропроцессоры |
Иридий (Ir) | 2454 ° С | Отвердитель, легирование (особенно с осмием), наконечники ручки, подшипники компаса |
Осмий (Os) | 3050 ° С | Легирование, иглы, наконечники ручек |
Родий (Rh) | 1960 ° С | Легирование, катализатор, украшения |
Рутений (Ру) | 2310 ° С | Солнечные элементы, легированные (особенно платиной и палладием), ювелирные изделия |
Титан (Ti) | 1668 ° С | Легирование, самолеты, корабли, гребные валы, теплообменники |
Ванадий (В) | 1910 ° С | Легирование (особенно сталью и титаном) |
Цирконий (Zr) | 1855 ° С | Реакторы ядерные, магниты (легированные ниобием), химическая промышленность |
находят узкоспециализированное применение, например, в осветительных приборах, инструментах, смазочных материалах и стержнях ядерной реакции.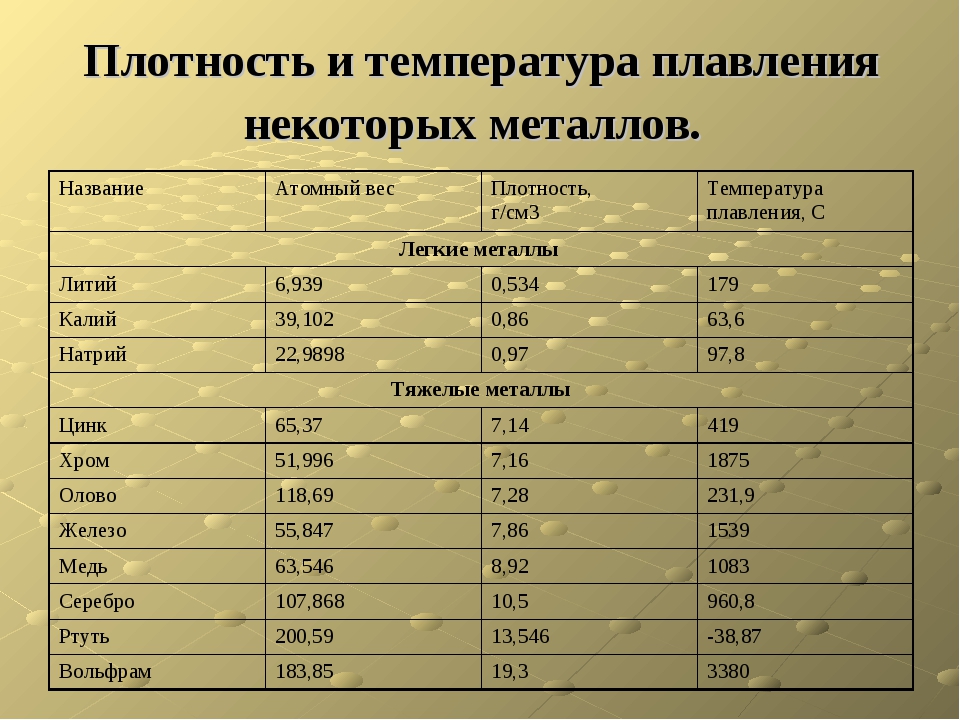 Их нельзя формовать, их можно обрабатывать только методом порошковой металлургии.
Их нельзя формовать, их можно обрабатывать только методом порошковой металлургии.
Лютеций, Лоуренсий и Протактиний также имеют высокие температуры плавления. Но они очень радиоактивны или имеют очень ограниченное применение и обычно не используются.
Для сравнения, температура плавления стали обычно находится в диапазоне 1370-1510 ° C (в зависимости от конкретного сплава). Сталь, конечно, не тугоплавкий металл, а сплав на основе железа, который иногда легируют упомянутыми тугоплавкими металлами.
Другие распространенные металлы с высокой температурой плавления
Следующие четыре металла являются наиболее часто используемыми металлами с высокими температурами плавления, но ниже 1850 ° C, и как таковые не считаются тугоплавкими металлами:
Палладий (Pd)
Палладий — блестящий серебристо-белый металл, плавящийся при 1555 ° C и имеющий плотность 12,02 г / см. 3 . Металл очень устойчив к коррозии на воздухе, но может потускнеть на влажном воздухе, содержащем серу.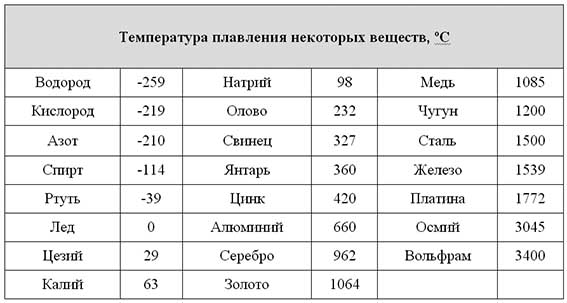 Он не имеет биологической роли и не токсичен.
Он не имеет биологической роли и не токсичен.
Металл образуется как побочный продукт при переработке медных и никелевых руд. Он чрезвычайно пластичен и легко превращается в тонкий лист, используемый в декоративных целях или в качестве украшений.
Чаще всего используется при производстве автомобильных каталитических нейтрализаторов. Он также широко используется для обесцвечивания золота при изготовлении украшений из белого золота. Другие популярные применения включают стоматологию, керамические конденсаторы, изготовление электрических контактов и хирургических инструментов.
Скандий (Sc)
Скандий — серебристо-белый металл, плавящийся при 1541 ° C и имеющий плотность 3,0 г / см. 3 . Это мягкий металл, который медленно меняет цвет на желтоватый или розоватый при контакте с воздухом из-за образования оксида скандия (Sc 2 O 3 ) на поверхности. Его биологическая роль неизвестна, но предполагается, что он является канцерогеном.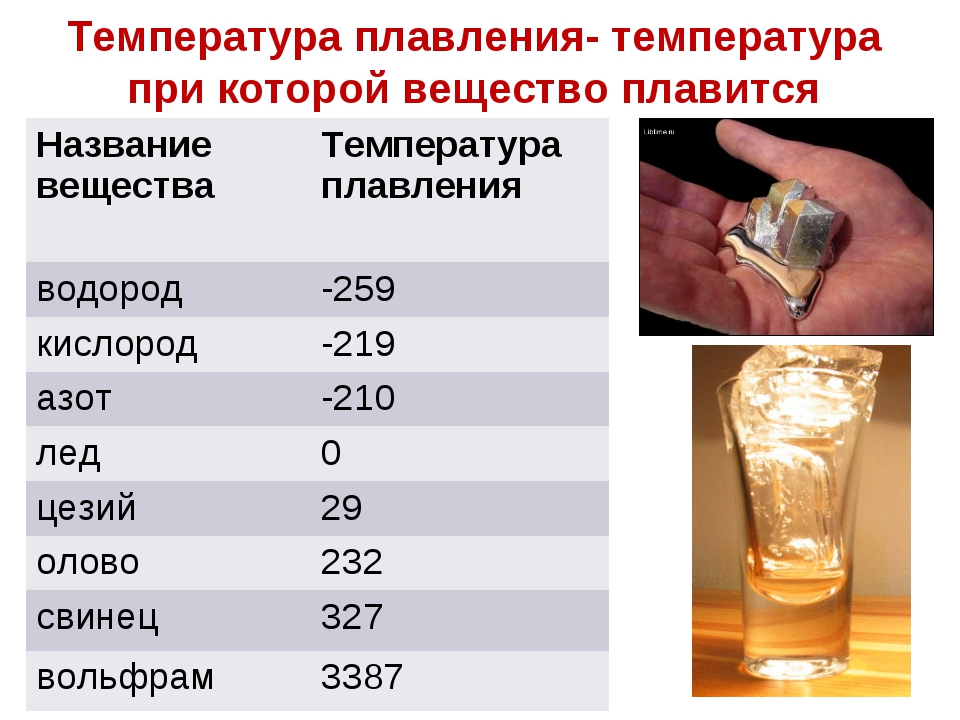
Скандий — главный элемент тортвейтита, очень коллекционного минерала, обнаруженного в Скандинавии. Скандий считается редкоземельным элементом, поскольку он имеет аналогичные химические свойства с другими редкоземельными элементами и содержится в тех же рудах.
Скандий увеличивает температуру рекристаллизации алюминия до более чем 600 ° C. Это намного выше температурного диапазона термообрабатываемых алюминиевых сплавов. Это мощный легирующий элемент, который значительно улучшает механические и физические характеристики алюминиевого сплава. Эти сплавы набирают популярность в авиационной и транспортной отраслях.
Железо (Fe)
Железо — серебристо-серый металл, плавящийся при 1535 ° C и имеющий плотность 7,87 г / см. 3 .Это пластичный, мягкий металл, который относительно хорошо проводит тепло и электричество. В чистом виде он обладает высокой реакционной способностью и легко окисляется на воздухе с образованием красно-коричневых оксидов железа или ржавчины. Он известен своей биологической ролью и жизненно важен для функционирования живых организмов. Считается нетоксичным.
Он известен своей биологической ролью и жизненно важен для функционирования живых организмов. Считается нетоксичным.
Железо производится путем плавки / восстановления железной руды (гематита и магнетита) в чушковый чугун, содержащий большое количество углерода и других примесей, в доменных печах при температуре около 2000 ° C с последующим удалением этих примесей.
Железо (вместе с его сплавами) — самый распространенный промышленный металл в мире. Большая часть производимого чугуна используется для производства различных марок стали. Добавление никеля, хрома, ванадия и вольфрама улучшает коррозионную стойкость, а добавление 3-5 мас.% Углерода создает недорогой сплав для труб и других неструктурных применений.
Иттрий (Y)
Иттрий — серебристо-белый металл, плавящийся при 1525 ° C и имеющий плотность 4,47 г / см. 3 . Он в меру мягкий и пластичный.Он не имеет известной биологической роли, но может быть очень токсичным для людей и животных.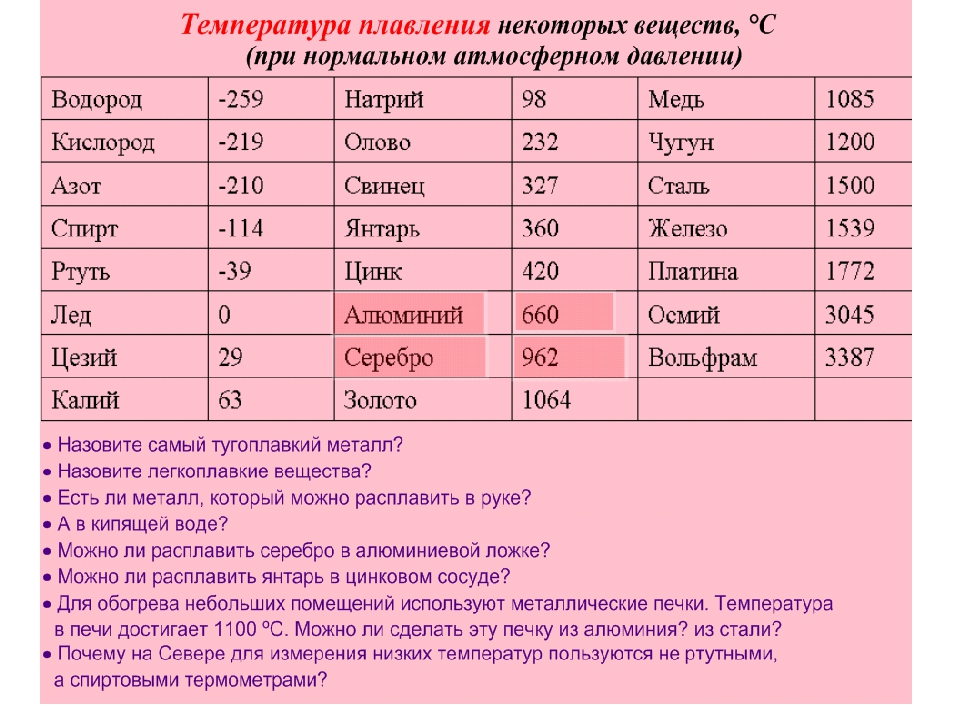
Металл получают восстановлением фторида иттрия кальциево-магниевым сплавом в дуговой печи при 1600 ° C, достаточном для плавления иттрия.
6.1B: Использование точек плавления
Существует несколько причин для определения точки плавления соединения: это полезно для подтверждения идентификации соединения, а также служит приблизительным ориентиром для относительной чистоты образца.
Идентификация
Поскольку температура плавления соединения является физической константой, ее можно использовать для подтверждения идентичности неизвестного твердого вещества.\ text {o} \ text {C} \). Нередко два разных соединения имеют одинаковые или одинаковые температуры плавления. Следовательно, точка плавления должна использоваться просто как одна часть данных, чтобы поддержал идентификацию неизвестного.
Хотя совпадения схожих точек плавления не являются чем-то необычным, при использовании в контексте оценки продукта химической реакции точки плавления могут быть мощным инструментом идентификации.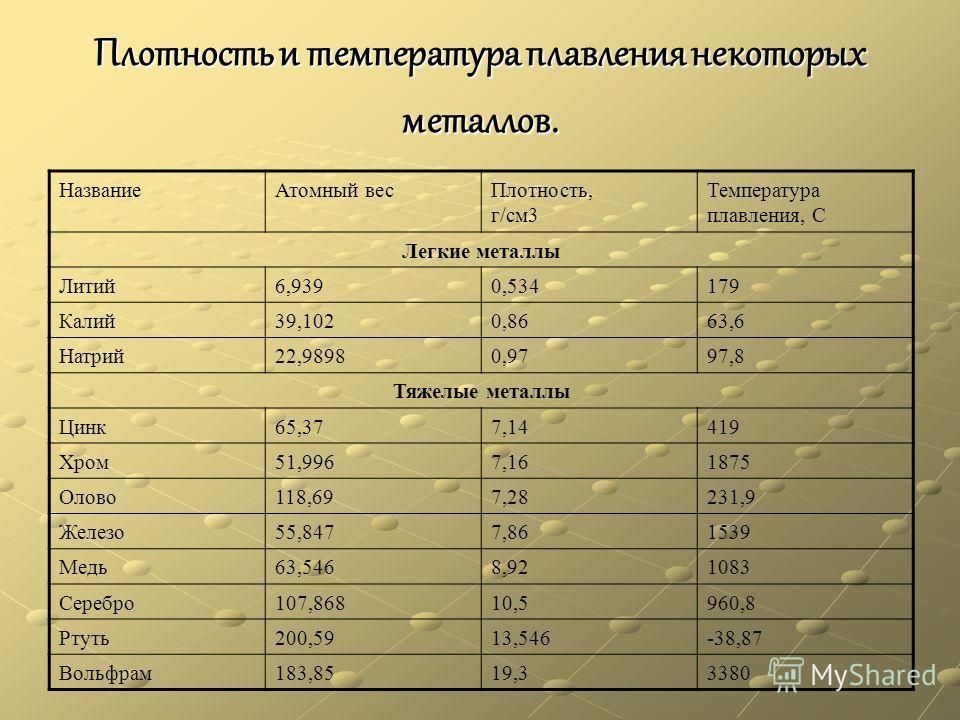 Например, тремя возможными продуктами нитрования бензальдегида являются 2, 3 или 4-нитробензальдегид (Рисунок 6.1 \)
Например, тремя возможными продуктами нитрования бензальдегида являются 2, 3 или 4-нитробензальдегид (Рисунок 6.1 \)
Оценка чистоты
Вторая причина для определения точки плавления соединения — грубая мера чистоты. Как правило, примесей понижают и расширяют интервал плавления .
Например, температуры плавления образцов бензойной кислоты, загрязненных известными количествами ацетанилида, приведены в таблице 6.1. По мере увеличения количества примесей плавление начиналось при более низкой температуре, и ширина диапазона плавления увеличивалась.
| Мол.% Бензойной кислоты | мол.% Ацетанилида | Точка плавления (ºC) |
|---|---|---|
| 100% | 0% | 120–122 |
| 95% | 5% | 114 — 121 |
| 90% | 10% | 109–120 |
| 85% | 15% | 105–117 |
| 80% | 20% | 94–116 |
Рисунок 6.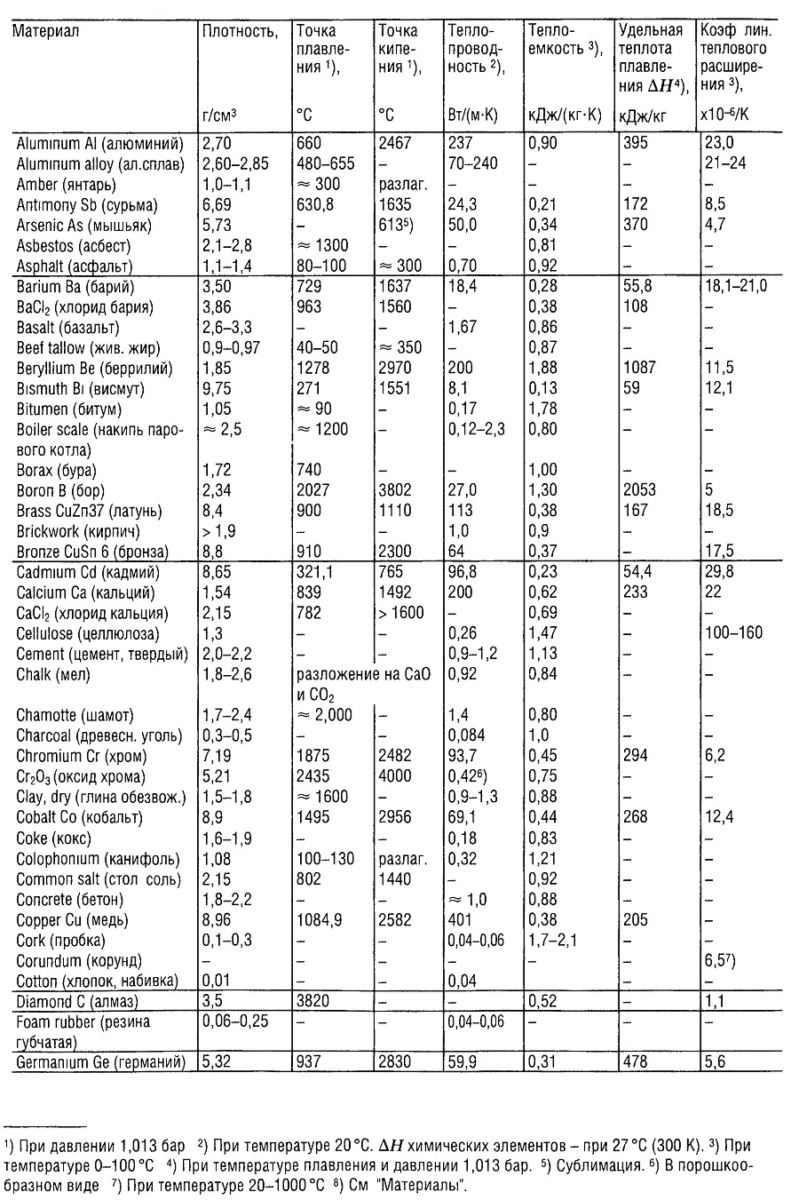 5 показывает покадровое плавление трех образцов бок о бок в приборе для определения точки плавления: чистая бензойная кислота (слева), бензойная кислота с примесью ацетанилида \ (10 \: \ text {mol} \% \) (в центре) и бензойная кислота с примесью ацетанилида \ (20 \: \ text {mol} \% \) (справа). При нагревании образцов сначала плавится образец с наибольшей примесью (справа). Интересно, что оба загрязненных образца плавятся еще до того, как чистый образец (слева) начинает плавиться.
5 показывает покадровое плавление трех образцов бок о бок в приборе для определения точки плавления: чистая бензойная кислота (слева), бензойная кислота с примесью ацетанилида \ (10 \: \ text {mol} \% \) (в центре) и бензойная кислота с примесью ацетанилида \ (20 \: \ text {mol} \% \) (справа). При нагревании образцов сначала плавится образец с наибольшей примесью (справа). Интересно, что оба загрязненных образца плавятся еще до того, как чистый образец (слева) начинает плавиться.
Автор
Лиза Николс (Общественный колледж Бьютта). Organic Chemistry Laboratory Techniques под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Полный текст доступен онлайн.
Какой материал имеет самую высокую температуру плавления? (с изображениями)
На этот вопрос сложно ответить, потому что все время создаются новые материалы и сплавы, а материал с самой высокой температурой плавления теперь может изменяться по мере синтеза новых соединений. В настоящее время рекордсменом является карбид тантала-гафния (Ta4HfC5), тугоплавкое соединение с температурой плавления 4488 K (4215 ° C, 7619 ° F). Смешивая вместе различные металлы для создания сплавов, можно достичь еще более высоких температур плавления. Материалы с такими исключительными физическими свойствами иногда называют суперсплавами.
В настоящее время рекордсменом является карбид тантала-гафния (Ta4HfC5), тугоплавкое соединение с температурой плавления 4488 K (4215 ° C, 7619 ° F). Смешивая вместе различные металлы для создания сплавов, можно достичь еще более высоких температур плавления. Материалы с такими исключительными физическими свойствами иногда называют суперсплавами.
Химический элемент с наивысшей температурой плавления — углерод, при 4300–4700 К (4027–4427 ° C, 7280–8000 ° F). Второй по величине точкой плавления химических элементов является вольфрам (3695 К (3422 ° C, 6192 ° F)), поэтому он используется в качестве нити для ламп накаливания. Иногда вольфрам называют элементом с наивысшей температурой плавления, потому что углерод на самом деле не плавится при атмосферном давлении, а скорее сублимируется (переходит непосредственно из твердого состояния в газ) при 4000 К (3727 ° C, 6740 ° F).
Углерод, обнаруженный в угольных месторождениях, является химическим веществом с самой высокой температурой плавления.Когда для оборудования требуются очень высокие температуры плавления, иногда используется керамика.Одним из примеров является проект «Плутон» в 1950-х годах, когда американские ученые попытались создать баллистическую ракету с ядерной установкой и неэкранированным реактором мощностью гигаватт. Реактор производил такое огромное количество тепла, что потребовались керамические шасси и компоненты.
Под экстремальным давлением температура плавления увеличивается.Внутреннее железное ядро Земли, например, имеет температуру приблизительно от 5000 до 6000 ° C (> 9000 ° F), но оно твердое, потому что давление там примерно в 3 миллиона раз выше, чем на поверхности. И наоборот, когда давление снижается, температура плавления уменьшается. На поверхности Марса давление настолько низкое, что любая жидкая вода испаряется почти сразу. Вот почему мы наблюдаем свидетельства создания небольших временных источников на Марсе, но не постоянных водоемов.
Железное внутреннее ядро Земли остается твердым, потому что оно находится под экстремальным давлением. .
 Температура воздуха от поверхности Земли, где она принимается равной 15 °С, до верхней границы тропосферы понижается в среднем на 6 «С на 1 км подъема. В нижней части стратосферы (до высоты 20 км) температура атмосферы остается приблизительно постоянной, а затем повышается в среднем на 1-2 °С на 1 км подъема и на верхней границе ( примерно 50 км) становится равной -2,5 °С. В мезосфере температура с высотой понижается, и у верхней границы мезосферы (примерно 80 км) температура атмосферы достигает -75 °С. По мере дальнейшего увеличения высоты вновь происходит повышение температуры. Это же характерно и для термосферы, где температура, возрастая с увеличением высоты, достигает очень больших значений (свыше 1000 °С). В малоизученной области атмосферы — экзосфере — температура с увеличением высоты возрастает предположительно до 2000 °С.
Температура воздуха от поверхности Земли, где она принимается равной 15 °С, до верхней границы тропосферы понижается в среднем на 6 «С на 1 км подъема. В нижней части стратосферы (до высоты 20 км) температура атмосферы остается приблизительно постоянной, а затем повышается в среднем на 1-2 °С на 1 км подъема и на верхней границе ( примерно 50 км) становится равной -2,5 °С. В мезосфере температура с высотой понижается, и у верхней границы мезосферы (примерно 80 км) температура атмосферы достигает -75 °С. По мере дальнейшего увеличения высоты вновь происходит повышение температуры. Это же характерно и для термосферы, где температура, возрастая с увеличением высоты, достигает очень больших значений (свыше 1000 °С). В малоизученной области атмосферы — экзосфере — температура с увеличением высоты возрастает предположительно до 2000 °С.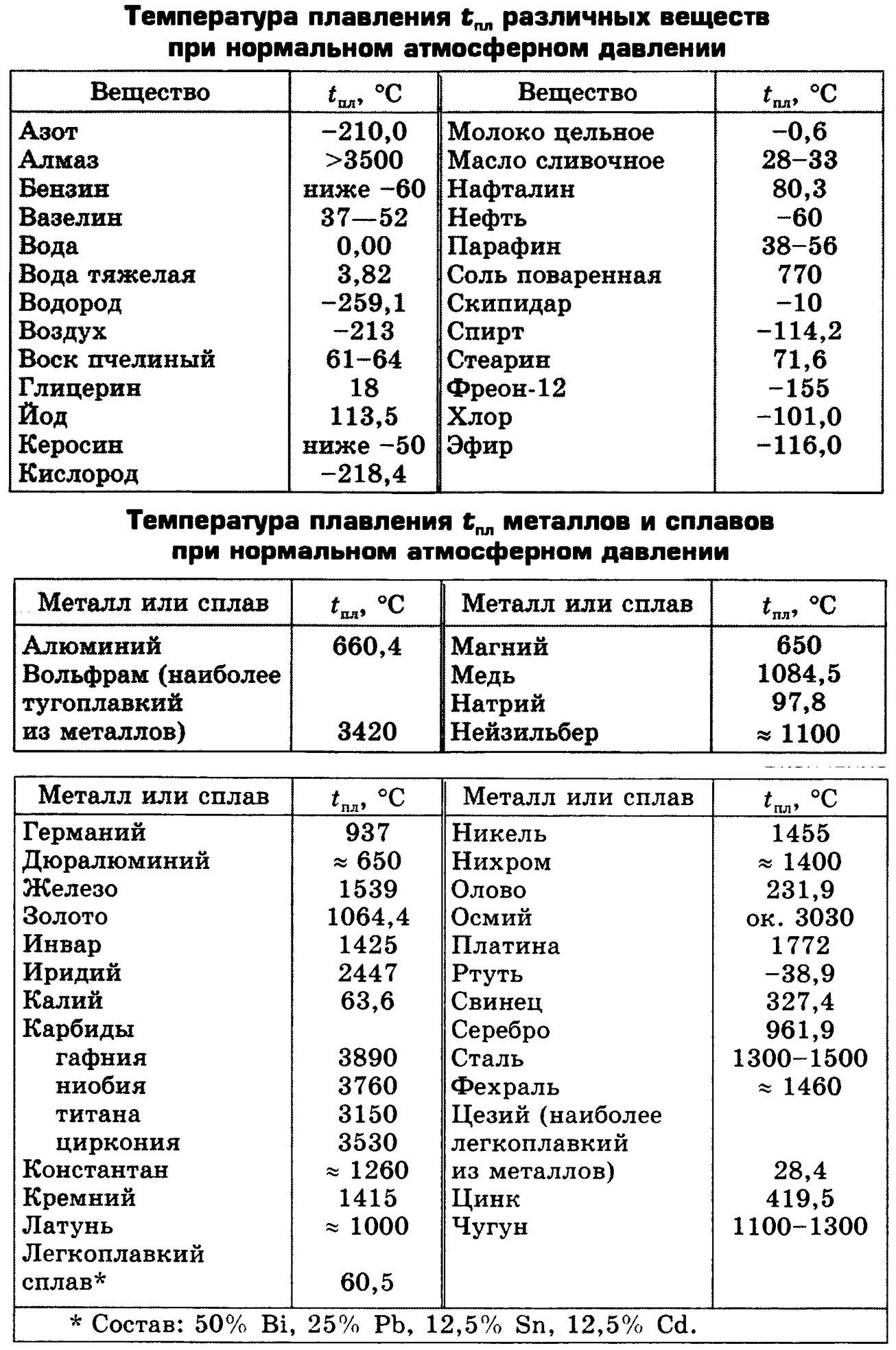 Сопоставляя, два уравнения получаем формулу зависимости температуры кипения
воды от высоты – Th=ToTг qμв/qμвTг+
μгghTo, где
Сопоставляя, два уравнения получаем формулу зависимости температуры кипения
воды от высоты – Th=ToTг qμв/qμвTг+
μгghTo, где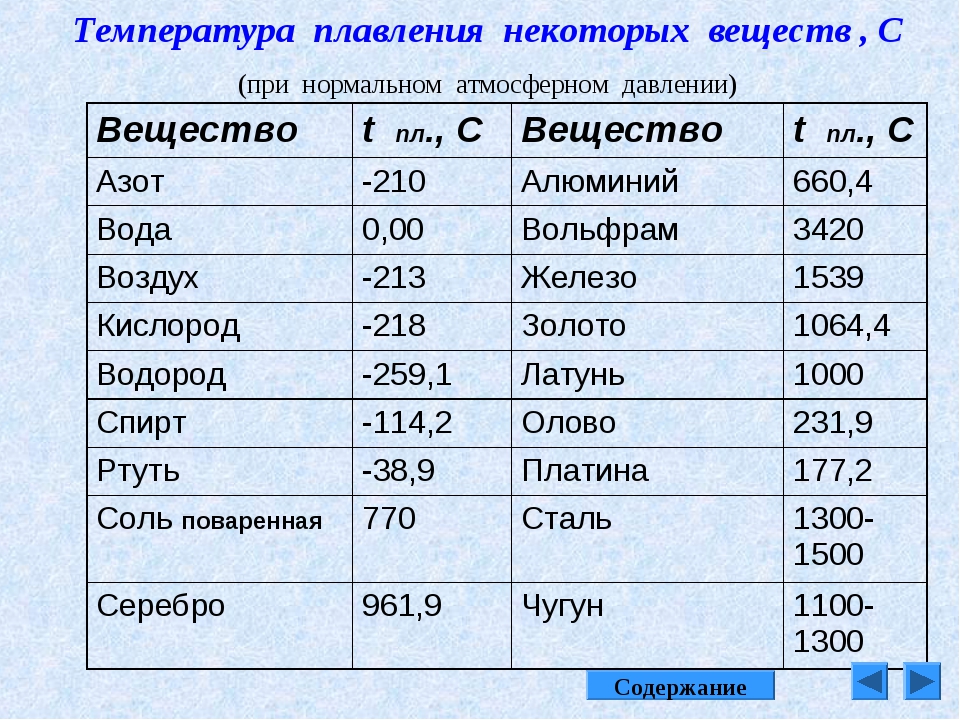 )
)
 5000
5000 ст.
ст.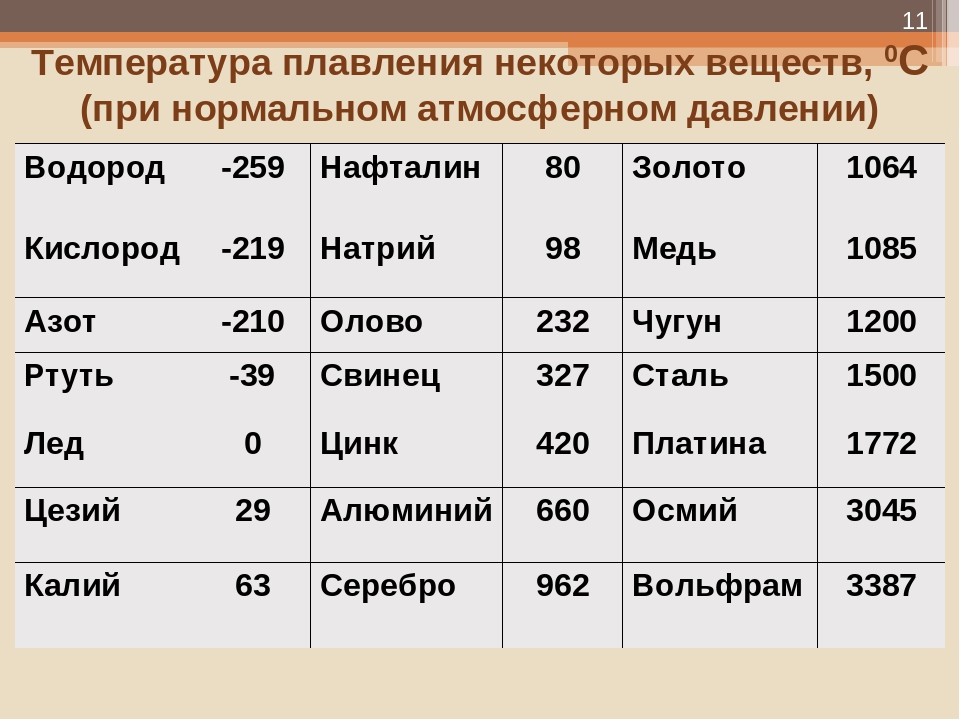 Удельная теплота плавления.
Удельная теплота плавления.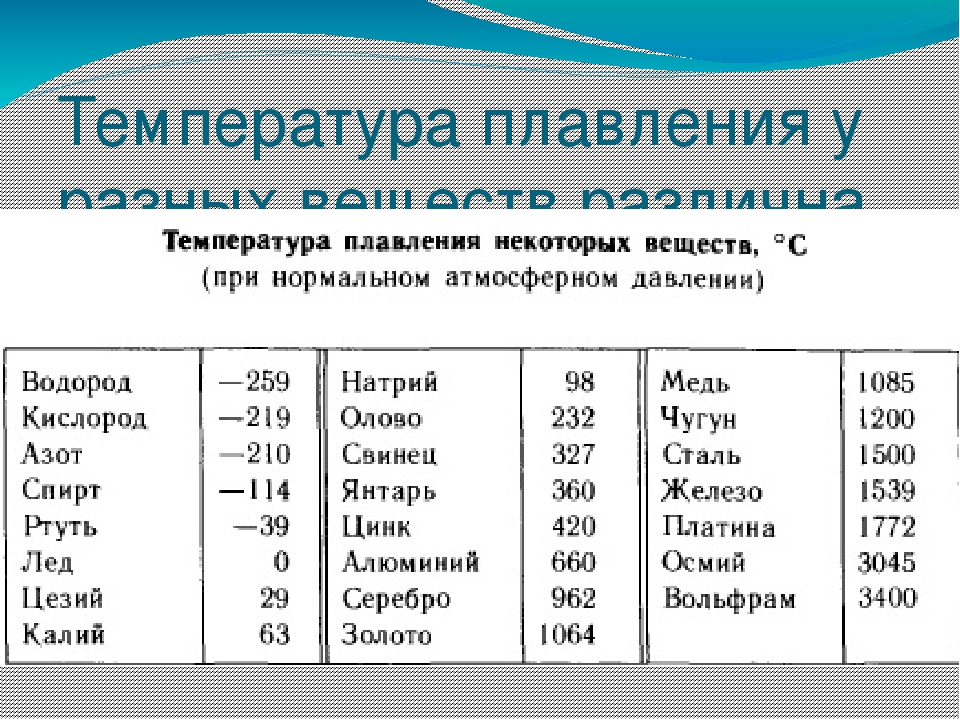 Исключение составляют лед, висмут и некоторые
другие вещества.
Исключение составляют лед, висмут и некоторые
другие вещества.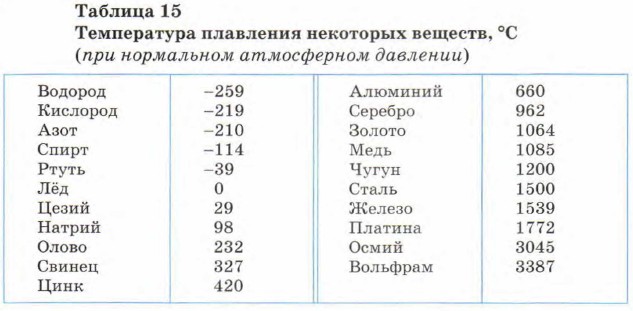


 9
9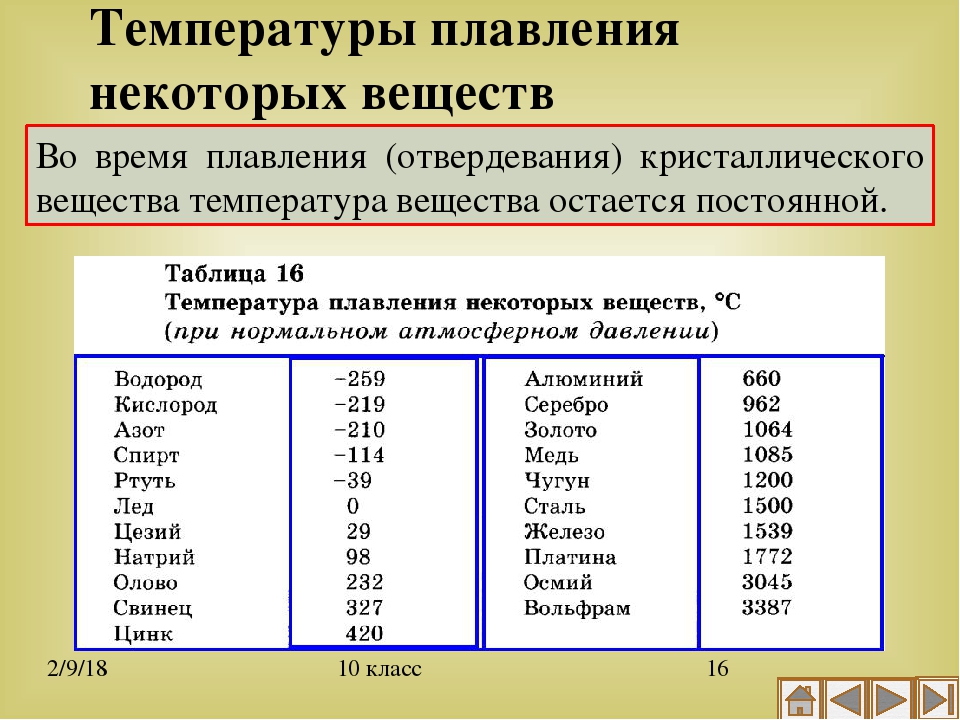


 сборы
сборы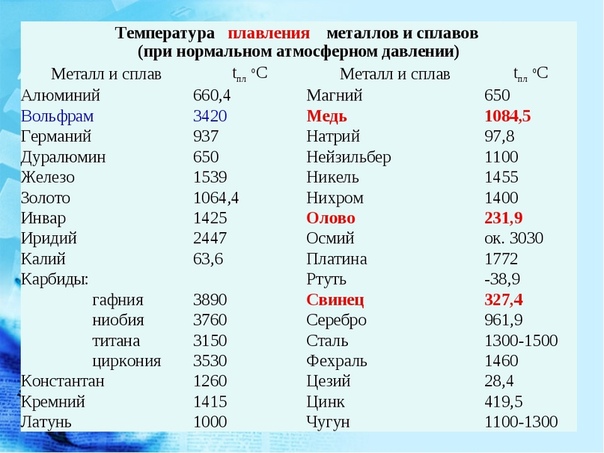 коэфф.
коэфф. сборы
сборы коэфф.
коэфф.