Азот, свойства атома, химические и физические свойства
Азот, свойства атома, химические и физические свойства.
N 7 Азот
14,00643-14,00728* 1s2 2s2 2p3
Азот — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 7. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), втором периоде периодической системы.
Атом и молекула азота. Формула азота. Строение азота
Изотопы и модификации азота
Свойства азота (таблица): температура, плотность, давление и пр.
Физические свойства азота
Химические свойства азота. Взаимодействие азота. Реакции с азотом
Получение азота
Применение азота
Таблица химических элементов Д.И. Менделеева
Атом и молекула азота. Формула азота. Строение азота:
Азот (фр. azote, по наиболее распространённой версии, от др.
Азот самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева
Азот – химически весьма инертный неметалл.
Как простое вещество азот (химическая формула N2) при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха. В жидком состоянии азот – бесцветная, подвижная, как вода, жидкость, а в твёрдом – представляет собой белоснежные кристаллы или снегоподобную массу.
Молекула азота двухатомна.
Химическая формула азота N2.
Электронная конфигурация атома азота 1s2 2s
Строение атома азота. Атом азота состоит из положительно заряженного ядра (+7), вокруг которого по атомным оболочкам движутся семь электронов. При этом 2 электрона находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку азот расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. Два спаренных электрона находится на 1s-орбитали, вторая пара электронов – на 2s-орбитали. На 2р-орбитали находятся три неспаренных электрона. В свою очередь ядро атома азота состоит из семи протонов и семи нейтронов. Азот относится к элементам p-семейства.
Радиус атома азота (вычисленный) составляет 56 пм.
Атомная масса атома азота составляет 14,00643-14,00728 а. е. м.
Азот – один из самых распространённых элементов на Земле. Азот – основной компонент воздуха. Он занимает 78, 084 % его объёма и 75,5 % по массе.
Молекула азота крайне прочна. Атомы азота связаны прочными тройными связями. Даже при высокой температуре молекула азота N2 слабо диссоциирует на атомарный азот. При 3000 °C на атомарный азот диссоциирует 0,1 % молекулярного азота, при 5000 °C – несколько процентов. Переход в атомарное состояние вызывается также полем высокочастотного электрического разряда при сильном разрежении газообразного азота или под действием солнечного излучения в высоких слоях атмосферы.
Атомарный азот намного активнее молекулярного.
Изотопы и модификации азота:
Свойства азота (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy. ru
ru
| 100 | Общие сведения | |
| 101 | Азот | |
| 102 | Прежнее название | |
| 103 | Латинское название | Nitrogenium |
| 104 | Английское название | Nitrogen |
| 105 | Символ | N |
| 106 | Атомный номер (номер в таблице) | 7 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Даниэль Резерфорд, Великобритания, 1772 г. |
| 110 | Год открытия | 1772 г. |
| 111 | Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| 112 | Происхождение | |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации: – α-азот с простой кубической кристаллической решёткой, – β-азот с гексагональной плотноупакованной кристаллической решёткой, – γ-азот, – «чёрный» азот |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 75,5 % |
| 119 | Содержание в земной коре (по массе) | 0,002 % |
| 120 | Содержание в морях и океанах (по массе) | 0,00005 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,1 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | 0,14 % |
| 124 | Содержание в организме человека (по массе) | 2,6 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 14,00643-14,00728 а. |
| 202 | Электронная конфигурация | 1s2 2s2 2p3 |
| 203 | Электронная оболочка | K2 L5 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 56 пм |
| 205 | Эмпирический радиус атома* | 65 пм |
| 206 | Ковалентный радиус* | 71 пм |
| 207 | Радиус иона (кристаллический) | N3- 132 (4) пм, N3+ 30 (6) пм, N5+ 27 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 155 пм |
| 209 | Электроны, Протоны, Нейтроны | 7 электронов, 7 протонов, 7 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 15-ая группа (по старой классификации – главная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3 , -2, -1, 0, +1, +2, +3 , +4, +5 |
Азот. Химия азота и его соединений
Химия азота и его соединений
1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III) азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000оС или действие электрического разряда) азот реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.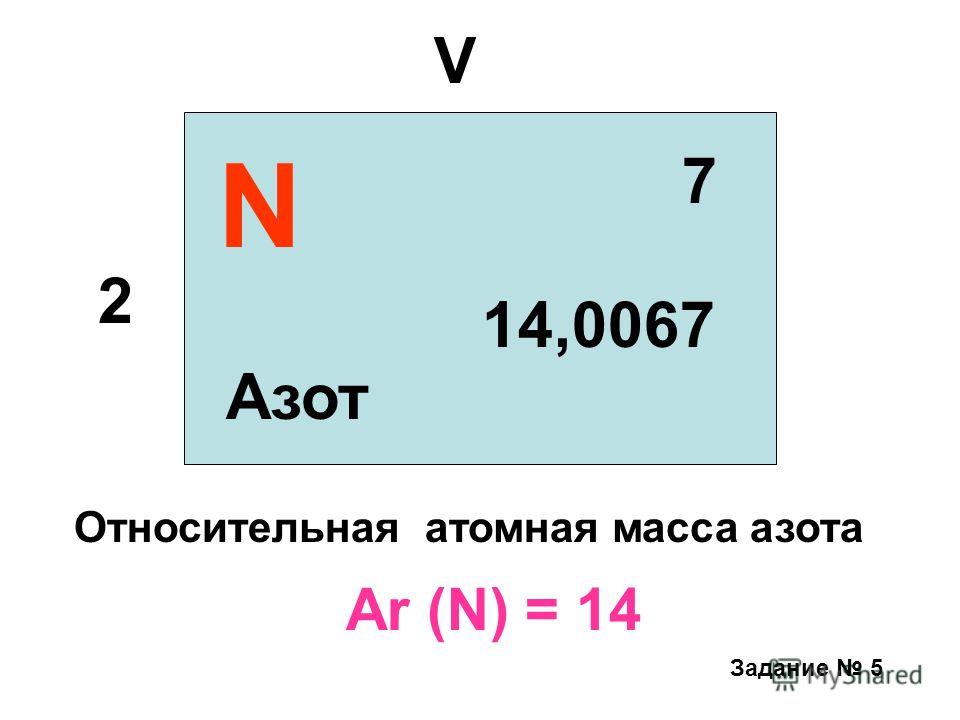 е. протекает с выделением теплоты.
е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида.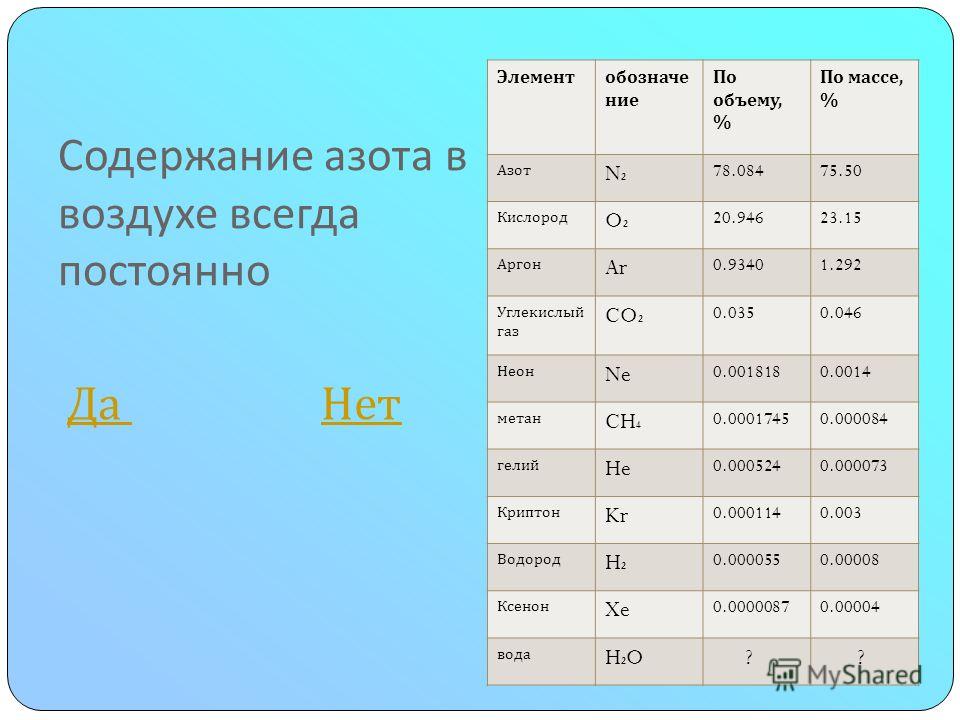 Валентный угол H-N-H составляет 107,3о:
Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
При нагревании выделяется кислород:
4NO2 + 2H2O → 4HNO3 + O2
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5– оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, т
Азот, аммиак, физические свойства — Знаешь как
Содержание статьи
К элементам группы азота относятся азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi. Эти элементы располагаются в главной подгруппе V группы периодической системы. Как все элементы одной и той же подгруппы, они имеют довольно большое химическое сходство. Несколько отличается от остальных азот. О причине этого различия будет сказано ниже. Сходство химических свойств этих элементов объясняется сходством строения внешнего электронного слоя. Все они имеют на внешнем слое 5 валентных электронов (табл. 14).
Число электронов на энергетических уровнях | ||||||||
По мере уменьшения радиуса атома снижается величина электроотрицательности, возрастает металличность свойств, снижается окислительная способность.
■ 1 . Начертите в тетради следующую таблицу. (См. Ответ)
Заряд ядра Число электронных слоев Возрастание атомного радиуса (указать стрелкой) Уменьшение электроотрицательное (указать стрелкой) Уменьшение окислительной способности Усиление металличности свойств | |||||
Химический знак азота N, формула N2, атомный вес 14,0067, молекулярный вес 28,0134. Электронная конфигурация атома азота 1s22s22p3. Распределение электронов по орбиталям внешнего слоя:
На внешнем электронном слое у азота располагаются 3 неспаренных р-электрона. При образовании неполярной молекулы азота между атомами азота образуются 3 общие электронные пары за счет перекрывания р-орбиталей обоих атомов. Таким образом, в свободном состоянии азот трехвалентен.
Степени окисления у азота довольно разнообразны: от —3 до +5.
Азот немного легче воздуха. В земной коре азота 0,03% . В воздухе на долю азота приходится 78% по объему или 75,5% по весу. Поскольку азот из воздуха расходуется незначительно, запасы азота в атмосфере остаются постоянными.
Азот входит как обязательная часть в состав белков, являющихся основой жизни на земле. Отсюда и значение азота, который необходим для жизни животных и растений.
Азот — вещество весьма пассивное, вступает в реакции с трудом, поэтому связывать азот атмосферы очень сложно. Растения азот атмосферы не усваивают. Они могут поглощать его только в связанном состоянии, а от количества азота в почве зависит урожай сельскохозяйственных культур. Особенно необходим азот растениям, у которых ценится зеленая масса. Связывать азот могут почвенные бактерии; некоторые из них находятся в почве в клубеньках корней бобовых культур. Для активной деятельности таких бактерий необходимо присутствие молибдена и железа в виде так называемых микроэлементов. Эти элементы, а также соединения хрома, вольфрама, титана, ванадия, алюминия удалось использовать для связывания азота с органическими веществами. Поскольку азот в составе зеленой массы растений постоянно вывозится с полей, почва обедняется азотом. Необходимо пополнять запасы азота почвы с помощью минеральных удобрений, например калийной селитры KNO3, натриевой селитры NaNO3 и т. д.
Азот — газ, не имеющий ни цвета, ни запаха. Он переходит в жидкость при температуре —195,8°, а при —210° затвердевает. В жидком виде азот также бесцветен. В воде азот почти нерастворим.
■ 2. Изобразите строение атома и электронную конфигурацию электронных слоев атома азота. В чем сходство и различие строения атома азота и атомов кислорода и фтора?
3. Изобразите, как возникают между атомами в молекуле азота 3 общих электронные пары.
4. Какого типа кристаллическая решетка у азота? На основании каких физических свойств азота можно об этом судить? (См. Ответ)
Азот химически весьма инертен. При обычной температуре соединяется только с литием:
6LI + N2 = 2Li3N
С некоторыми другими металлами из наиболее активных азот может соединяться лишь при нагревании, образуя нитриды, в которых всегда проявляет отрицательную степень окисления.
При очень жестких условиях азот соединяется с водородом, образуя аммиак:
N2 + ЗН2 ⇄ 2Nh4
При сильных электрических разрядах азот соединяется с кислородом, образуя окись азота:
N2 + О2 = 2NO
В свою очередь окись азота легко окисляется кислородом воздуха и превращается в двуокись азота:
2NO + О2 = 2NO2
В технике азот получают из жидкого воздуха, а в лаборатории — разложением нитрита аммония:
Nh5NO2 = N2 + 2Н2О
Однако сухой нитрит аммония разлагать опасно — может произойти взрыв. Для реакции используют нитрит аммония в момент его образования из сухого хлорида аммония и насыщенного раствора нитрита натрия при нагревании (рис. 57). Вначале постепенно, посредством обменной реакции, образуется нитрит аммония:
Nh5Cl + NaNO2 = NaCl + Nh5NO2
Затем происходит разложение нитрита аммония по приведенному выше уравнению.
Азот применяется в производстве аммиака, а также в некоторых процессах для создания инертной среды. Иногда азот используют для наполнения электроламп. Некоторые химические реактивы, которые из-за легкости окисления нельзя получать на воздухе, получают в атмосфере азота. Так же поступают иногда при работе с легко воспламеняющимися веществами. Азот используют для синтеза аммиака.
■ 5. Почему можно говорить о сравнительной химической пассивности азота? (См. Ответ)
в. Напишите уравнения реакций, подтверждающих химические свойства азота.
7. Докажите расчетом, что азот немного легче воздуха.
8. Определите, какова плотность азота по водороду.
9. Абсолютная плотность азота 1,25 г/л. Докажите расчетом, что
молекула азота состоит из двух атомов.
10. Запишите в тетрадь способы получения азота.
11. Где азот находит применение и на каких его свойствах это применение основано? (См. Ответ)
Молекула аммиака Nh4 представляет собой ярко выраженный диполь. Строение молекулы аммиака рассмотрено в гл. I, § 6. Молекулярный вес аммиака 17. Следовательно, он намного легче воздуха. Аммиак кипит при —33,4°, а затвердевает при —77,8°.
Аммиак обладает чрезвычайно высокой растворимостью в воде. При 0° в 1 объеме воды растворяется 1200 объемов аммиака, а при обычных условиях (20°) — 700 объемов аммиака в . 1 объеме воды. Высокая растворимость аммиака обусловлена тем, что аммиак вступает с водой в химическое соединение.
Аммиак очень ядовит. При отравлениях аммиаком страдают слизистые оболочки глаз и дыхательных путей, так как аммиак растворяется в их влаге. Вдыхание большого количества аммиака может привести к воспалению легких. Лучшим противоядием против аммиака является вода. При отравлениях следует обильно промывать глаза, рот и нос водой и вдыхать водяной пар. Максимально допустимая концентрация аммиака в воздухе 0,02 мг/л.
■ 12. Можно ли с помощью прибора для растворения хлористого водорода в воде (рис. 27) наблюдать растворение аммиака? (См. Ответ)
13. Каково физиологическое действие аммиака и меры первой помощи при отравлениях им?
14. Объясните полярный характер молекулы аммиака с точки зрения его структуры. (См. Ответ)
Химические свойства аммиака
Степень окисления азота в аммиаке N-3, т. е. предполагается максимальное завершение внешнего электронного слоя атома азота до прочного октета. В связи с этим аммиак может вести себя в окислительно-восстановительных реакциях только как восстановитель. Доказательством восстановительных свойств аммиака является его взаимодействие с кислородом, которое можно проводить двояким образом.
Аммиак горит в кислороде. Это легко наблюдать на опыте в приборе, изображенном на рис. 58. В горелку, представляющую собой широкую стеклянную трубку, подведены две газоотводные трубки. По одной трубке поступает аммиак из колбы, где кипит его насыщенный раствор, а по другой трубке — кислород из газометра. Если поджечь аммиак на выходе из трубки, то он сгорает зеленоватым пламенем. Горение протекает по уравнению:
4Nh4 + 3О2 = 2N2 + 6Н2O + Q
Реакция экзотермическая.
Вместе с тем аммиак может спокойно окисляться в присутствии платинового катализатора:
4Nh4 + 5O2 = 4NO + 6Н2О
Этот процесс служит основой для получения синтетической азотной кислоты.
В обоих случаях аммиак ведет себя как восстановитель, а степень окисления азота меняется с N-3 до N0 и до N+2.
• Составьте для приведенных выше уравнений электронный баланс и проверьте правильность расстановки в них коэффициентов.
Восстановительные свойства аммиака проявляются также при возможном восстановлении им окислов металлов:
ЗСuО + 2Nh4 = N2 + 3Сu + 3Н2O
нагревание
■ 15. Напишите в тетради уравнения реакций, в которых аммиак проявляет восстановительные свойства, и докажите это, составив электронный баланс. (См. Ответ)
Для чего аммиак
Большое значение имеют соединения солей азота. Аммиак используется в основном в химической промышленности для получения других соединений азота. Соли аммония применяются в сельском хозяйстве как удобрения, в основном это нитрат аммония, но иногда также для удобрения полей используют аммиачную воду NH4OH (нашатырный спирт).
В военном деле нитрат аммония используется как взрывчатое вещество, а также добавляют его к тринитроглицерину (динамит) для уменьшения свойств его врываться.
В химической промышленности кроме взрывчатых веществ аммиак используют для получения нитро красок, нитро эмалей но в последнее время нитро краски заменяют менее токсичными материалами.
Особого внимания заслуживает вопрос о взаимодействии аммиака с водой. Как известно, молекулы воды полярны, электронная плотность сильно смещена к кислороду так, что атом водорода практически лишен электронов и представляет собой протон.
Молекула аммиака тоже полярна. Имеющиеся 3 водородных атома присоединены за счет образования общих электронных пар из р-электронов атома азота и s-электронов атома водорода (sp-связь). Электроны сильно смещены к атому азота как более электроотрицательному; вокруг него создается область повышенной электронной плотности. Кроме того, у атома азота на внешнем слое имеются два валентных s-электрона, которые могут быть использованы на образование химической связи. Все это создает условия для присоединения к молекуле аммиака положительно заряженного иона водорода. А поскольку у иона водорода полностью отсутствуют электроны, необходимые для образования химической связи, эта связь образуется за счет двух электронов азота, которые носят название «неподеленной электронной пары». Возникает атомная группировка с такой электронной структурой:
Возникает особый вид химической связи — донорно-акцепторная связь, где донором называется атом, предоставляющий в общее распоряжение свою электронную пару (в данном случае азот). Другой атом является акцептором (в данном случае атом водорода).
■ 16. Какие типы химической связи атомов в молекулах вам известны? (См. Ответ)
17. Чем отличается донорно-акцепторная связь от ковалентной?
18. Какой атом называется донором, какой — акцептором?
19. Что такое неподеленная электронная пара? (См. Ответ)
Таким образом, возникает особая атомная группировка — группа аммония, которая в целом имеет положительный заряд из-за присоединения к нейтральной молекуле аммиака положительного иона водорода. Формула группы аммония: NH4+.
Процесс растворения аммиака в воде выражается следующим уравнением:
Nh4 + Н+ + ОН— ⇄ NH+ + ОН—
Так как аммиак в растворе связывает ион водорода из воды и освобождает тем самым ион ОН—, это придает раствору щелочную реакцию. Вещество с формулой Nh5OH носит название гидроокиси аммония и рассматривается как слабое основание. Аммонийная группа всегда функционирует как одновалентный катион:
Nh5OH ⇄ NH4+ + ОН—
Концентрированный (25%) раствор аммиака называется просто аммиаком. Слабый водный раствор аммиака (3— 6%) называется нашатырным спиртом. Образование группы аммония NH4+ возможно не только в водной среде, но и в кислоте:
Nh4 + Н+ + Cl— = NH4+ + Сl—
Эта реакция может быть осуществлена в растворе, а также на воздухе между аммиаком и газообразным хлористым водородом.
Если смочить одну стеклянную палочку аммиаком, а другую концентрированной соляной кислотой и поднести эти палочки друг к другу (рис. 59), можно заметить образование белого дымка, представляющего собой мельчайшие кристаллики хлорида аммония.
Гидроокись аммония вступает с кислотами в реакцию нейтрализации:
Nh5OH + HNO3 = Nh5NO3 + h3O
Для аммиака очень , характерны реакции присоединения к различным солям, благодаря чему образуются аммиакаты:
CuSO4 + 4Nh4 = CuSO4 · 4Nh4
СаСl2 + 8Nh4 = CaCl2 · 8Nh4
AgCl + 2Nh4 = AgCl · 2Nh4
Они очень напоминают кристаллогидраты.
■ 20. Каковы формула и заряд иона аммония? (См. Ответ)
21. Какова степень окисления азота в ионе аммония?
22. Какие реакции аммиака с другими веществами приводят к образованию катиона аммония?
23. Напишите уравнения реакций аммиака с серной и фосфорной кислотами в молекулярной и ионной форме?
24. 200 г 25% аммиака прокипятили. При этом-20 г аммиака улетучилось. Какой стала концентрация раствора? Сколько соляной кислоты потребуется для его нейтрализации? (См. Ответ)
Рис. 59. Взаимодействие аммиака с хлористым водородом на воздухе.
1—палочка, смоченная концентрированным раствором аммиака; 2 — палочка смоченная концентрированным раствором соляной кислоты; 3 —белый дым состоящий из твердых частиц хлорида аммония.
Получение аммиака в технике и в лаборатории осуществляется по разному. В лаборатории аммиак получают при нагревании нашатыря (хлорид аммония) и натронной извести (рис. 60) по уравнению:
2Nh5Cl + Са(ОН)2 = СаСl2 + 2Nh5OH
Следует отметить, что все детали прибора, служащие для лабораторного получения аммиака, должны быть абсолютно сухими. Если пробирку с собранным аммиаком опрокинуть в воду, то можно сразу заметить, как вода входит в пробирку, занимая в ней тот объем, который занимал аммиак, подобно тому как это происходило с хлористым водородом. Но в случае с аммиаком раствор будет иметь ярко выраженную щелочную реакцию, что можно определить индикатором. Так как аммиак легче воздуха, его следует, собирать в пробирку, опрокинутую в верх дном.
В технике аммиак получают синтезом из азота и водорода по уравнению:
N2 + 3Н2 = 2Nh4 + + 22 ккал
В бывшем СССР производство синтетического аммиака началось в 1928 г.
Как уже упоминалось ранее, процесс соединения азота с водородом является равновесным каталитическим процессом. Катализатором служит металлическое железо с незначительными добавками соединений калия и алюминия. Из уравнения видно, что для смещения равновесия вправо целесообразно увеличивать давление. Однако увеличение давления может осуществляться лишь в определенных пределах, иначе это сильно удорожает производство. Как известно, другим фактором, влияющим на равновесие, является температура. В данном случае для смещения равновесия вправо смесь газов следует охлаждать, но тогда сильно снижается скорость реакции и уменьшается активность катализатора.
Таким образом, температуру приходится поддерживать на определенном уровне. Влияние третьего фактора — изменения концентрации — также может быть использовано: если постоянно отводить образующийся аммиак, т. е. снижать его концентрацию, то равновесие сместится вправо. Как видно из предыдущего описания, достаточно полный и экономически выгодный синтез может быть осуществлен при наилучшем сочетании всех трех условий.
Процесс ведут обычно в колоннах синтеза под давлением от 300 до 1000 атм и при температуре 400—500°. В процессе синтеза из смеси постоянно отводят аммиак, переводя его в жидкое состояние, а не прореагировавшую смесь азота и водорода вновь направляют в колонну синтеза.
Статья на тему Азот
история открытия, нахождение в природе, биохимический цикл азота.
История открытия азота.
В 1772 г. Д. Резерфорд установил, что воздух, оставшийся под колпаком, где жила мышь, после сжигания в нем фосфора не поддерживает горения и дыхания. Этот газ он назвал «ядовитым воздухом». В этом же году Д. Пристли, получив «ядовитый воздух» иным путем, назвал его «флогистированным воздухом». В 1773 г. К. Шееле, шведский аптекарь из города Штральзунда, установил, что воздух состоит из двух газов, и назвал газ, не поддерживающий горения и дыхания, «дурным или испорченным воздухом». В 1776 г. известный французский ученый А. Лавуазье, подробно исследуя «ядовитый», «флогистированный» и «дурной» воздух, установил тождество между ними. И лет спустя, будучи членом комиссии по выработке новой химической номенклатуры, он предложил назвать эту часть воздуха азотом (от греческих слов «а» — означающего отрицание, и «zoos» — жизнь). Латинское название азота происходит от слова «нитрогениум», что значит «рождающий селитру» («селитрообразователь»). Этот термин введен в науку в 1790 г. Ж. Шапталом.
Нахождение в природе.
Азот вслед за водородом, гелием и кислородом является четвертым по распространенности элементом Солнечной системы. Азот обнаружен в спектрах звезд, в том числе в фотосфере Солнца, в метеоритах, кометах, солнечном ветре и в межзвездных облаках газа. Молекулярный азот наблюдается в атмосферах Венеры и Марса, а аммиак характерен для Юпитера и Сатурна. Во всех космических объектах азот встречается только в восстановленном состоянии.
В земной коре по распространенности азот занимает 20-е место. Подавляющая его часть сосредоточена в следующих основных резервуарах: атмосфере (3,86*1015 т), литосфере (1,7*1015 т), гидросфере (2,2 *1013 т) и биосфере (~ 1010 т). В атмосфере свободный азот в виде молекулярного N2 составляет 78,09% по объему (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и оксидов.
В литосфере среднее содержание азота составляет 6*10-3 вес. %. Основная масса азота в силикатах находится в химически связанном состоянии в виде NH4+, изоморфно замещающего ион калия в силикатной решетке. Кроме того, в природе встречаются и азотные минералы: нашатырь (NH4C1), выделяющийся из вулканов в довольно больших количествах, баддингтонит (NH4AlSi3O8- *0,5 Н2O) единственный найденный аммониевый алюмосиликат с цеолитной водой. В самых приповерхностных областях литосферы обнаружен ряд минералов, состоящих в основном из нитратных солей. Среди них широко известная селитра (NaNO3), крупные скопления которой характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитра была главным источником связанного азота. (Сейчас основное значение имеет промышленный синтез аммиака из азота воздуха и водорода.) По сравнению с силикатными минералами ископаемое органическое вещество существенно обогащено азотом. Нефть содержит от 0,01 до 2% азота, а каменный уголь — от 0,2 до 3%. Как правило, повышенное содержание азота имеют алмазы (до 0,2%).
В гидросфере среднее содержание азота составляет 1,6- *10-3 вес. %. Основную часть этого азота составляет молекулярный азот, растворенный в воде; химически связанный азот, которого примерно в 25 раз меньше, представлен нитратной и органической формами. В меньших количествах в воде содержится аммиачный и нитритный азот. Концентрация связанного азота в океане примерно в 104 раз меньше, чем в почвах, пригодных для сельскохозяйственного производства.
Хотя название азота означает «не поддерживающий жизни», на самом деле это необходимый для жизнедеятельности элемент. В растительных организмах его содержится в среднем 3%, в живых организмах до 10% от сухого веса. Азот накапливается в почвах (в среднем 0,2 вес.%). В белке животных и человека среднее содержание азота составляет 16%.
Между атмосферой, литосферой и биосферой происходит непрерывный обмен, с которым связана и смена химических форм азота. Этот обмен и определяет круговорот азота в природе. Обмен азота между атмосферой и биосферой получил название биохимического цикла азота. Основным процессом движения азота в биосфере является его переход из одной химической формы в другую в замкнутом цикле. Постоянная смена химических форм азота является источником жизни для многих организмов начиная от микроорганизмов и кончая высокоорганизованными формами жизни. Накопленные в почве запасы связанного азота служат источником питания высших растений, откуда связанный азот может поступать и в организмы животных. Растения и животные, отмирая, дают начало органическому азоту, находящемуся главным образом в аминокислотах. В процессе аммонификации органических остатков азот органических соединений переходит в аммонийную (аммиачную) форму. Последняя с помощью микроорганизмов переходит в нитритную форму. При этом выделяется около 70 ккал/молъ. Другая группа микроорганизмов завершает окисление аммиака до нитрата. Полученный в процессе нитрификации нитрат усваивается растениями, и цикл движения азота в биосфере замыкается.
Главными неорганическими соединениями азота в почвах являются нитрат, аммоний и в редко встречающихся в природных условиях нитрит. Поведение первых двух компонентов в почве совершенно различно. Если нитрат является легкоподвижным соединением, не сорбируется минералами почвы и остается в растворенном в воде состоянии, то аммоний легко хемосорбируется глинистыми минералами, хотя это не мешает ему в определенных условиях легко окисляться до нитрата. Такое различие в подвижности нитрата и аммония предопределяет источники азотного питания растений. С энергетических позиций аммонийная форма азота более предпочтительна, так как валентность азота в ней одинакова с валентностью азота в аминокислотах.
Нитратная форма служит основным источником азотного питания растительности в силу своей подвижности, несмотря на необходимость траты дополнительной энергии, связанной с восстановлением нитрата растением.
Неиспользованные живым веществом запасы химически связанного азота под действием микроорганизмов непрерывно преобразовываются в формы, доступные для азотного питания растений. Так, фиксированный глинистыми минералами аммоний окисляется до нитратов. В определенных условиях при отсутствии свободного кислорода и наличии неиспользованного живым веществом нитрата может происходить обусловленное процессом денитрификации восстановление азота до молекулярного с уходом последнего в атмосферу.
Количества азота, выведенные денитрифицирующими бактериями из биосферы, компенсируются процессами фиксации азота из атмосферы азотфиксирующими бактериями. Последние подразделяются на две группы: живущие самостоятельно и живущие в симбиозе с высшими растениями или с насекомыми. Первая группа бактерий фиксирует примерно 10 кг/га. Симбионты высших растений фиксируют значительно большие количества азота. Так, симбионты бобовых культур фиксируют до 350 кг/га. С осадками выпадает азота порядка нескольких килограммов на гектар.
В балансе фиксируемого азота все большее значение приобретает искусственно синтезированный аммиак, причем его количество удваивается каждые 6 лет. Уже в ближайшее время это может вызвать дисбаланс между процессами фиксации и денитрификации в биосфере.
Следует отметить подцикл круговорота аммиака и окислов азота через атмосферу, особенно если учесть, что этот подцикл регулирует масштабы развития биосферы. Источниками атмосферного аммиака служат биохимические процессы в почве и, в первую очередь, аммонификация. Окисляясь, аммиак дает основную массу окислов азота в атмосфере. Получающаяся в процессе денитрификации закись азота ответственна за содержание окислов азота в стратосфере, которые каталитически разрушают озон, защищающий живое вещество биосферы от губительного действия жесткого ультрафиолетового излучения. Таким образом в природе установились определенные пределы развития биосферы.
Деятельность человека грозит нарушить установившееся равновесие. Так, подсчет показал, что количества окиси азота, выделившиеся при планируемых полетах сверхзвуковых самолетов в стратосфере, будут сравнимы с поступлениями ее из природных источников.Таким образом, завершается цикл движения молекулярного азота через биосферу. В этом геохимическом цикле само существование азотной атмосферы Земли определяется скоростями процессов фиксации и денитрификации. При резком разбалансе этих скоростей азотная атмосфера Земли может исчезнуть всего за несколько десятков миллионов лет.
Помимо атмосферы, биосфера определяет существование и другого крупного резервуара азота в земной коре — литосферы, так как именно взаимодействие живого вещества с молекулярным азотом играет главную роль в процессе круговорота поверхностного азота через земную кору. Небольшая часть накопленного в биосфере связанного азота вместе с осадками увлекается вглубь земной коры. В резко восстановительных условиях из осадочных пород исчезает нитратная форма азота. С увеличением температуры и давления и выходом за границы биосферы реакции превращения органического вещества становятся односторонними и сдвигаются в сторону разрушения органической формы азота. Основной формой связанного азота становится ион аммония. С увеличением степени метаморфизма осадочных пород начинает разрушаться и уходить из пород и аммонийный азот. На высоких ступенях метаморфизма этот процесс практически заканчивается, а с ним заканчивается цикл обращения поверхностного азота в земной коре. Время жизни азота в этом цикле составляет около 1 млрд. лет.
Изотопы азота.
Азот — единственный элемент на Земле, у которого наиболее распространенными являются ядра изотопа 14N нечетно-нечетного типа (7 протонов, 7 нейтронов). Содержание 14N и 15N в воздухе составляет 99,634 и 0,366% соответственно.
В верхних слоях атмосферы под действием нейтронов космического излучения 14N превращается в радиоактивный изотоп 14С, на чем основана геохронологическая датировка геологических образцов, содержащих «древний» углерод.
В настоящее время возможно получение химических соединений азота, искусственно обогащенных тяжелым изотопом 15N до 99,9 атомн.%. Обогащенные по 15N образцы используются при исследованиях в биохимии, биологии, медицине, химии и физической химии, физике, в сельском хозяйстве, в технологии и химическом машиностроении, в аналитической химии и т. д.
Источник: www.chemanalytica.ru
www.chemanalytica.ru лаборатория химического анализа воды г.Москва.
Таблица объема и веса баллонов с техническими газами
Благодаря нижеприведенной таблице вы сможете узнать, сколько килограмм весит азот, пропан, аргона, гелий, углекислота, ацетилен или кислород в стандартных баллонах емкостью 40 литров.
Благодаря нижеприведенной таблице вы сможете узнать, сколько килограмм весит азот, пропан, аргона, гелий, углекислота, ацетилен или кислород в стандартных баллонах емкостью 40 литров.
Это позволит более точно расчитать необходимые ресурсы для покупки технических газов и оценить необходимость доставки.
| Кислород технический | 40 л | 6,3 куб.м | 8,3 кг |
| Азот технический ГОСТ 9293-74 | 40 л | 5,7 куб.м | 7,5 кг |
| Аргон газообразный высокой чистоты (99,998%) | 40 л | 6,3 куб.м | 7,5 кг |
Углекислота ГОСТ 8050-85 | 40 л | 6,0 куб.м | 20-24 кг |
| 10 л | 1,6 куб.м | 6 кг | |
| 7 л | 1,1 куб.м | 4,2 кг | |
| Пропан ГОСТ 20448-90 | 50 л | 9,5 куб.м | 21,5 кг |
| Ацетилен технический ГОСТ 5457-7 | 40 л | 5,3 куб.м | 5 кг |
| Гелий технический | 40 л | 5,7 куб.м | 1 кг |
Азот — Мегаэнциклопедия Кирилла и Мефодия — статья
Азо́т (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14, 0067. В свободном виде — газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов14N (содержание в смеси 99, 635% по массе) и 15N. Конфигурация внешнего электронного слоя 2s22р3. Радиус нейтрального атома азота 0, 074 нм, радиус ионов: N3- — 0, 132, N3+ — 0, 030 и N5+ — 0, 027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14, 53, 29, 60, 47, 45, 77, 47 и 97, 89 эВ. По шкале Полинга электроотрицательность азота 3, 05.Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем).В природе свободный (молекулярный) азот входит в состав атмосферного воздуха (в воздухе 78, 09% по объему и 75, 6% по массе азота), а в связанном виде — в состав двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) — и ряда других соединений. По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0, 0019% земной коры по массе. Несмотря на свое название, азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ. Некоторые, так называемые азотфиксирующие, микроорганизмы способны усваивать молекулярный азот воздуха, переводя его в соединения, доступные для использования другими организмами (см. Азотфиксация). Превращения соединений азота в живых клетках — важнейшая часть обмена веществ у всех организмов.В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (−195, 8 °C), чем у другого компонента воздуха — кислорода (−182, 9 °C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара.В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать твердый нитрит аммония:
NH4NO2 = N2 + 2H2O.
Плотность газообразного азота при 0 °C 1, 25046 г/дм3, жидкого азота (при температуре кипения) — 0, 808 кг/дм3. Газообразный азот при нормальном давлении при температуре –195, 8 °C переходит в бесцветную жидкость, а при температуре –210, 0 °C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже –237, 54 °C устойчива форма с кубической решеткой, выше — с гексагональной.
Критическая температура азота –146, 95 °C, критическое давление 3, 9МПа, тройная точка лежит при температуре –210, 0 °C и давлении 125, 03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость.
Теплота испарения жидкого азота 199, 3 кДж/кг (при температуре кипения), теплота плавления азота 25, 5 кДж/кг (при температуре –210 °C).
Энергия связи атомов в молекуле N2 очень велика и составляет 941, 6 кДж/моль. Расстояние между центрами атомов в молекуле 0, 110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие σ- и π-орбитали. Молекула азота немагнитна (диамагнитна).
Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от –3 до +5). С водородом образует аммиак NH3. Косвенным путем (не из простых веществ) получают гидразин N2H4 и азотистоводородную кислоту HN3. Соли этой кислоты — азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов.Известно несколько оксидов азота. С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN.
В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.- Справочник азотчика. М., 1969.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. М., 1988. Т. 1.
- Некрасов Б. В. Основы общей химии. М., 1973.
- Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982.
атомный вес азота | Комиссия по изотопному содержанию и атомному весу
| Изотоп | Атомная масса (Да) | Изотопное содержание (количественная доля) |
|---|---|---|
| 14 N | 14,003 074004 (2) | [0,995 78, 0,996000 63] | 15 N | 15,000 108 899 (4) | [0,003 37, 0,004 22] |
Основным эталонным материалом для измерения относительного содержания изотопов азота является атмосферный N 2 , который является однородным в отношении аналитических неопределенностей и которому присвоен δ 15 N воздух значение 0 ‰.Измерения относительного изотопного отношения азота обычно имеют погрешности порядка 0,1 ‰, что значительно меньше, чем заявленная погрешность откалиброванного «лучшего измерения» (1.1 ‰). Вариации изотопного состава азота в химических реагентах и природных земных системы, как известно, превышают 200 ‰, что намного больше, чем неопределенность из-за относительной или «абсолютные» измерения изотопного отношения. Следовательно, точность и точность стандартных атомных Вес азота почти полностью ограничен реальными вариациями, отсюда и обозначение «r».
Измеримые вариации содержания изотопов (и атомного веса) азота обнаруживаются в большинстве азотных соединения. Подавляющее большинство химических реагентов, промышленных удобрений и экологических образцы имеют значения δ 15 N от -15 до +20 ‰, что соответствует x ( 15 N) = 0,003 61 до 0,003 74 и A r (N) = 14,006 67–14,006 80. Изотопное фракционирование вызвано физическими, химическими и биологическими процессы.Некоторые из наиболее распространенных эффектов в естественной среде вызваны микробиологическими факторами. реакции окисления и восстановления и испарением аммиака или азотной кислоты.
Наиболее 15 N-обогащенных проявлений, зарегистрированных в природе, включают растворенный нитрат, который частично подвергся микробной уменьшение (денитрификация) в подземных водах (например, δ 15 N = +103 ‰, x ( 15 N) = 0,004 039, и A r (Н) = 14.007 10) и нитратов в антарктическом льду, которые могли быть фракционированы испарением HNO 3 с δ 15 N = 150 ‰, x ( 15 N) = 0,004 210 и A r (N) = 14,007 27.
Наиболее 15 обедненных азотом веществ из природных земных сред включают закись азота из подземных вод, подвергающихся микробной денитрификации ( δ 15 N = -55 ‰). Еще более низкие значения были зарегистрированы для NOx, выходящий из установки по производству азотной кислоты ( δ 15 N = -150 ‰, x ( 15 N) = 0.003 115, и A r (N) = 14,006 18), и для имеющегося в продаже реагента нитрита калия ( δ 15 N = -80 ‰, x ( 15 N) = 0,003 371 и A r (Н) = 14,006 43).
Аннотация «g» отражает тот факт, что a количество образцов, как известно, имеют атомный вес за пределами погрешностей стандартных атомных вес азота. Многие тысячи изотопных анализов азота были выполнены с 1950-х годов; тем не менее, можно ожидать больше случаев экстремальных значений по мере расширения работы в области гидрологии загрязнителей, биология и химия атмосферы.
ИСТОЧНИКИ Атомный вес элементов: Обзор 2000 г. Джона Р. де Лаэтера и др. Pure Appl. Chem. 2003 (75) 683-800Атомные веса элементов 2009 М.Э.Визер и Т.Б. Коплен. Pure Appl. Chem. 2011 (83) 359-396
CIAAW
Азот
A r (N) = [14,006 43, 14,007 28] с 2009 г.
Название происходит от латинского nitrum и греческого nitron для «природной соды» и генов для «формирование».Азот был открыт шотландским врачом и химиком Дэниелом Резерфордом в 1772 году.
Природные вариации изотопного состава азота
Изотопные стандартные образцы азота.
азота | Определение, символ, использование, свойства, атомный номер и факты
Азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы Менделеева. Это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в атмосфере Земли и является составной частью всего живого.
азот Encyclopdia Britannica, Inc.Британская викторина
118 Названия и символы Периодической таблицы викторины
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 7 |
|---|---|
| атомный вес | 14.0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| температура кипения 900 ° C (−320,4 ° F) | |
| плотность (1 атм, 0 ° C) | 1,2506 г / л |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 3 |
История
Около четырех пятых атмосферы Земли составляет азот, который был выделен и признан специфическим веществом во время ранних исследований воздуха.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» — это, конечно, кислород, а «грязный воздух» — азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле дается заслуга в открытии кислорода.Более поздние работы показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочное представление о горении, которое стало популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) побудила Лавуазье назвать его азотом , по-прежнему французским эквивалентом азота .
Возникновение и распределение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время гроз и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и Чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал — гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде — в виде аммония (NH 4 + ), нитрита (NO 2 —) и нитрата (NO 3 ). — ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание — предполагаемое общее содержание во Вселенной — составляет от трех до семи атомов на атом кремния, что считается стандартом.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Промышленное производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших количествах путем сжигания углерода или углеводородов в воздухе и отделения образующихся диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции с образованием азота включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; за исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и поэтому существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя химически активного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. В качестве инертного газа азот используется для производства вспененного или вспененного каучука, пластиков и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
Ключ к росту мышц
Любой бодибилдер с элементарным пониманием этого вида спорта знает, что ключ к набору мышц — это потребление белка. Конечно, тренировки, отдых и другие питательные вещества усиливают анаболизм и рост, но белок (являющийся ключевым питательным веществом для увеличения размера тела) абсолютно необходим, когда дело доходит до того, чтобы набрать вес — 60-70% белка тела содержится в мышцах.
Фактически, белок является ключевым питательным веществом для «строительства» множества тканей организма, многие из которых поддерживают рост мышц (ферменты, кожа, волосы, ногти, кости и соединительная ткань состоят из белка). Белок составляет 15-20% массы тела и, таким образом, после воды является вторым по содержанию веществом в организме.
Неизбежный факт остается фактом: белок, и только белок, является сырьем, из которого строятся мышцы и многие другие ткани тела. Сами белки состоят из аминокислот, которых 20, как незаменимых, так и заменимых.
Несущественные аминокислоты могут вырабатываться печенью. Тем не менее, незаменимые аминокислоты должны поступать с пищей, прежде чем можно будет синтезировать какие-либо мышцы. Следовательно, правильное соотношение незаменимых и заменимых аминокислот должно быть доступно в достаточных количествах, прежде чем можно будет произвести любую мышцу.
Незаменимые аминокислоты:
- Гистидин
- Изолейцин
- лейцин
- Валин
- Лизин
- метионин
- Фенилаланин
- Треонин
- Триптофан
Незаменимые аминокислоты:
Чтобы получить правильное соотношение незаменимых и заменимых аминокислот, необходимо употреблять в пищу полноценные источники белка, такие как яйца, мясо и молоко.Как уже говорилось, белок критически важен для роста мышц, однако (на более базовом уровне) это стандартные аминокислоты, которые должны присутствовать в правильных пропорциях для обеспечения оптимальной анаболической среды.
Употребление в пищу достаточного количества полноценных белков — лучший способ достичь этого, но как узнать, способствует ли их диета росту мышц, учитывая такие сложные факторы, как индивидуальная изменчивость (скорость обработки белка) и отдых (в это время происходит синтез белка) , часто сводят на нет предполагаемое оптимальное потребление белка.
Источники полноценных белков:
- Яичные белки
- Грудка индейки
- Рыба
- Моллюски (креветки, омары, крабы, моллюски и т. Д.)
- Куриная грудка
- Нежирное красное мясо (верхняя часть, нежирная вырезка и паштет)
- Нежирные или нежирные молочные продукты
- Протеиновые порошки (например, сывороточный протеин)
Азотный баланс
Хорошая новость для тех, кто не уверен в том, получают ли они достаточное количество протеина, заключается в том, что статус протеина можно определить с помощью анализа азота.Что такое азот? Азот — это соединение, уникальное для белков, которое может напрямую определять статус аминокислот (белков). Все макроэлементы (белки, углеводы и жиры) содержат углерод, водород и кислород.
Из них только белок содержит дополнительную молекулу азота. Таким образом, выделение азота (то есть количество белка, выводимого из организма) можно измерить, чтобы определить количество белка, присутствующего в организме, и учитывая, что до 70% белка содержится в мышечной ткани, это дает отличный показатель потенциал наращивания мышечной массы тела.
Если организм выделяет больше азота, чем потребляется, это посылает предупреждающий сигнал о том, что следует немедленно увеличить полное потребление белка, чтобы компенсировать этот дефицит азота.
Фактически, азотное тестирование — это наиболее широко распространенный лабораторный тест, используемый для определения анаболического статуса организма — он показывает азотный баланс организма или степень, в которой организм поддерживает достаточный белковый баланс.
Есть три основных состояния баланса азота
- Положительно: Это оптимальное состояние для роста мышц, когда потребление азота превышает выход азота.По сути, это показывает, что организм достаточно восстановился после последней тренировки. Чем больше азотный баланс, тем быстрее восстанавливается тренировка. Это анаболическое состояние организма.
- Отрицательно: Это наихудшее состояние, в котором может оказаться бодибилдер — потеря азота больше, чем потребление азота. Азот забирается не только из мышц, где он необходим для роста, но и из жизненно важных органов, где может произойти серьезное повреждение. Конечно, отрицательный баланс азота также разрушает мышцы и, следовательно, считается катаболическим состоянием.
- Равновесие: Это состояние должно быть тем, чего культурист мог бы достичь при самом минимуме — когда потребление и потеря азота равны. Тренер в этом состоянии не регрессирует и не набирает сколько-нибудь заметных мышц.
Как измеряется азот
В научной практике изначально азотный баланс проверялся путем тщательного измерения содержания азота в пищевых продуктах. Затем это содержание сравнивается с количеством выделяемого азота.
Полученное значение представляет собой текущий азотный баланс этого тела. Более простой, более распространенный и точный метод включает измерение потерь азота мочевины с мочой, так как 90% азота теряется с мочой через почки.
Какой бы метод ни использовался, по существу статус азота определяется путем измерения количества азота в рационе за вычетом количества, выделяемого за 24-часовой период.
Как может возникать отрицательный баланс азота: на что обращать внимание
Как упоминалось ранее, потребление белка имеет решающее значение для улучшения азотного баланса.Отрицательный баланс азота может быть результатом употребления недостаточного количества белков с высокой биологической ценностью, белков низкого качества (например, мяса на обед, жирного мяса и овощей) или источников белка, не имеющих оптимального баланса незаменимых аминокислот.
На более серьезном уровне, продолжающийся отрицательный баланс азота приведет к тому, что организм будет потреблять продукты собственной крови для поддержки внутренних органов.
Сильная нехватка белка означает меньшее количество антител, необходимых для борьбы с инфекцией — это может привести к бактериальным инфекциям.Вздутие живота (наблюдаемое во многих странах третьего мира) в конечном итоге является результатом бактериальных инфекций, вызванных отрицательным азотным дисбалансом, и вскоре после этого наступает смерть.
Важность белков в этом случае подчеркивается тем фактом, что независимо от того, сколько питательных веществ потреблено в этот момент, смерть наступит, если белок не будет доставлен.
Недостаточное потребление углеводов и жиров. Чтобы поддерживать синтез белка, для получения энергии должны быть доступны жиры и углеводы хорошего качества.Если человек потребляет в основном белок, не учитывая важность других макроэлементов, организм может метаболизировать белок для получения энергии, тем самым снижая баланс азота — ценные аминокислоты будут доставлены в жизненно важные органы, тем самым лишив мышцы того, что им нужно для роста. .
Перетренированность: тренировка включает разрушение мышечной ткани. Белок и отдых помогают регенерировать эти ткани. Слишком много тренировок в сочетании с недостаточным потреблением белка ускорит отрицательный баланс азота.
После тренировки мышцы впитывают питательные вещества (в том числе белок), как губка. Если тренировки проводятся часто, эти питательные вещества могут в конечном итоге не поддерживать непрерывный рост.
Как добиться положительного баланса азота
Правило 1
Основное правило при стремлении увеличить азотный баланс — есть достаточное количество полноценных белков.
Действительно, для поддержания положительного баланса азота необходимо постоянно поддерживать избыток калорийности белка.Рекомендуется есть около шести приемов пищи (каждое с интервалом в два-три часа), каждое из которых содержит около 30-40 граммов белка в день.
Источники белка, перечисленные в этой статье, являются наиболее полными источниками, и их следует употреблять в каждый из этих приемов пищи. Действительно, идея состоит в том, чтобы постоянно увеличивать усвоение аминокислот мышцами. Имея это в виду, можно следовать некоторым ключевым указателям:
- Чтобы предотвратить распад мышечного белка во время тренировки, увеличьте количество инсулина (анаболический гормон, который увеличивает поглощение аминокислот и глюкозы мышцами), потребляя жидкую пищу, содержащую белок и углеводы, за час до тренировки.
- Сразу после тренировки употребляйте тот же протеиновый / углеводный напиток, чтобы насытить мышцы аминокислотами и улучшить синтез протеина.
- Непосредственно перед сном выпейте напиток, содержащий как сыворотку, так и протеин с медленным высвобождением, такой как мицеллярный казеин, чтобы восстановить силы мышц во время этого катаболического периода (голодания).
Правило 2
Достаточно отдохнуть.
Давать мышцам отдых после интенсивных тренировок необходимо для синтеза белка.Если тренировки проводятся слишком часто, избыток белка может быть использован для подпитки тренировочных усилий, а не для поддержания положительного баланса азота.
Помните, что если у человека отрицательный азотный баланс, все тренировки следует прекратить и значительно увеличить потребление белка. Если тренировки продолжаются, мышцы могут и дальше разрушаться.
Правило 3
Тренируйтесь анаболическим способом.
Идея тренировок с целью максимизировать положительный азотный баланс состоит в том, чтобы стимулировать наибольшее количество волокон с наименьшим разрушением мышц.
По окончании тренировки мышцы должны находиться в анаболическом состоянии, так как это ускорит положительный азотный баланс. Длительные сеансы обычно приводят к отрицательному истощению мышц, и в результате тело остается в катаболическом состоянии. В анаболические тренировки входят:
- Тренировка, когда организм достаточно отдохнул после последней тренировки — другими словами, при положительном балансе азота.
- Тренировки должны быть короткими и интенсивными — продолжительность тренировки от 30 до 45 минут, по два-три упражнения на каждую часть тела.
- Тренируйте тело снова, только когда оно отдохнуло.
Дориан Йейтс, кровь и кишки, и стили тяжелых тренировок Майка Ментцера, как правило, копировали этот анаболический метод, и, если результаты этих парней хоть как-то подходят, они, безусловно, достигли положительного баланса азота.
Общее правило, с точки зрения потребления белка для увеличения размера, в течение некоторого времени составляло один грамм белка на фунт веса тела. Конечно, рекомендуемая суточная (RDA) для населения в целом составляет 0.8 граммов на килограмм веса — это далеко не предел для бодибилдеров и других силовых атлетов.
Исследование азотного баланса бодибилдеров продемонстрировало повышенную потребность в белке по сравнению с контрольной группой и оценило суточную норму потребления для бодибилдеров в 1,7 г / кг в целом.
В другом исследовании впечатляющий прирост силы на 5% и размера на 6% был замечен за несколько месяцев силовых тренировок у тяжелоатлетов мирового класса, когда они увеличили свой диетический белок с 1,8 до 3,5 г / кг веса тела в день.
Оба этих исследования подчеркивают большую потребность силовых атлетов в более высоком потреблении белка. Для среднего, непрофессионального культуриста, лучше проявить осторожность и потреблять больше, чем рекомендовано один грамм на фунт, чтобы обеспечить максимальное удержание азота.
Заключение
Фундаментальным условием любой программы бодибилдинга является достаточное потребление полноценных белков. Положительный баланс азота является точным показателем того, что человек потребляет достаточное количество белка.
Действительно, поддержание насыщения мышц азотом, учитывая, что это прямая мера белкового статуса, возможно, является самой важной переменной, которую может оценить бодибилдер. Следуйте рекомендациям в этой статье, чтобы компенсировать ужасный отрицательный азотный баланс и расти.
Артикул:
- Фриц Б. (1991). Баланс: что такое рост. Мышцы и фитнес. Декабрь 1991 г.
- Лимон, Питер: «Нужно ли спортсменам больше белков и аминокислот в рационе?» Международный журнал спортивного питания, S 39-61, 1995
- Тарнопольский М. Оценка потребности в белке тренированных силовых атлетов.»Журнал прикладной физиологии, VOl 73, № 5, pgs 1986-1995, 1993 »
Эффективность использования азота в рисе
1. Введение
По прогнозам, население мира достигнет 9 миллиардов, а запасы продовольствия увеличатся на 70–100% к 2050 году [1, 2]. Учитывая ограниченные возможности для расширения пахотных земель, требуется устойчивое повышение урожайности на существующих землях для удовлетворения растущего спроса на продукты питания [3]. Рис — одна из основных продовольственных культур примерно для половины населения мира.Следовательно, производство риса необходимо значительно увеличить, чтобы удовлетворить потребности растущего населения мира. Тем не менее, мы сталкиваемся с проблемами увеличения производства риса под давлением уменьшения площади пахотных земель, глобального изменения климата, усиления стихийных бедствий и частого появления болезней и вредителей [4]. Азот (N) — один из важнейших макроэлементов, необходимых для роста и развития растений. Доступность почвенного азота обычно ограничивает урожайность растений в большинстве сельскохозяйственных систем [5].Таким образом, внесение азотных удобрений стало важной и рентабельной стратегией повышения урожайности сельскохозяйственных культур в интенсивных сельскохозяйственных системах по всему миру [6]. Однако традиционное добавление азотных удобрений для повышения урожайности, возможно, достигло плато. Чрезмерное внесение азотных удобрений может не привести к повышению урожайности, но приведет к серьезным экологическим проблемам [7, 8]. С 1960 по 2012 год мировое потребление азотных удобрений увеличилось на 800%, а годовое потребление азота в Китае увеличилось с 8 до 35% от мирового потребления азота [4].Хотя с 1980 по 2010 год урожай зерновых увеличился на 65%, потребление химических удобрений увеличилось на 512% [9]. Высокий уровень внесения азотных удобрений приводит к низкой эффективности использования азота (ЭИА) из-за быстрых потерь азота в результате испарения аммиака, денитрификации, поверхностного стока и выщелачивания в системе водоснабжения почвы и затопления. Как следствие, возникли серьезные экологические проблемы (например, закисление почвы, загрязнение воздуха, эвтрофикация воды) [10, 11, 12]. Для достижения еще более высокой урожайности и высокого ЭИА в условиях хорошо удобрений срочно необходимы новые решения для повышения урожайности при сохранении или, предпочтительно, снижении вносимого азота [13].
В этой главе мы изложили определение NUE, генов, связанных с NUE, а также влияние факторов на экспрессию этих генов, уделяя особое внимание исследованиям риса. Основываясь на текущих знаниях, мы предложили некоторые возможные стратегии повышения ЭИА путем селекции, молекулярных манипуляций с выбором генов-кандидатов и разработки ряда оптимизированных практик управления урожаем для улучшения ЭИА.
2. Определение эффективности использования азота
NUE по своей природе сложен и определяется взаимодействием множества генов с факторами окружающей среды.Ряд различных определений и расчетов NUE включают использование N, содержание N и доступность N как компоненты уравнения NUE (Таблица 1) [13, 14]. В общем, ЭИА растений включает два ключевых компонента: эффективность поглощения N (NUpE), которая представляет собой эффективность поглощения / поглощения поставляемого N, и эффективность использования N (NUtE), которая представляет собой эффективность ассимиляции и ремобилизации азота растений с целью в конечном итоге производить зерно [13, 14]. Простейшее определение ЭИА растений — это урожай зерна на единицу поставленного азота, а также интеграция NUpE и NUtE.Другим методом описания NUE является индекс использования (UI), который означает, что абсолютное количество биомассы, произведенной на единицу N. NUE также можно описать как NUEg, что представляет собой производство зерна на единицу доступного N, и HI, что означает зерно. производство общей биомассы растений. Однако культурное растение может производить большое количество биомассы на единицу N (высокий UI) без преобразования приобретенного N в производство семян и, следовательно, иметь низкие NUEg и HI. Существуют и другие расчеты ЭИА с учетом различных агрономических и физиологических вариаций, описанные в других источниках [14, 15, 16].Таким образом, улучшение NUE может быть достигнуто за счет улучшения NUpE, NUtE или обоих. Однако из-за колебаний в ризосфере, на которые влияют микроорганизмы, корневые экссудаты и потеря летучих газообразных N из почвы / растительного покрова, трудно количественно определить «реальное» количество азотных удобрений, доступных или фактически полученных растениями. .
| Аббревиатура | Срок | Определения |
|---|---|---|
| NUE | Эффективность использования | NUpE × NUtE = доходность / количество доступных NU |
| NUp / Nav (почва + удобрение) = получено N / N доступно | ||
| NUtE | Эффективность использования N | Урожайность / NUp (усвоение азота растения для производства зерна) |
| NUEg | N Эффективность использования зерна | Производство зерна / доступное Нет |
| ANR | Видимая степень извлечения азота | Чистое увеличение общего поглощения азота растением с внесением азотных удобрений и без них / общее количество удобрений N |
| AE | Эффективность агрономического N | Чистая повышенная урожайность растения с внесением азотных удобрений и без них / общее количество удобрений N |
| NpU E | Физиологическая эффективность использования азота | Чистый повышенный урожай / нетто повышенное поглощение азота с внесением удобрений и без него N |
| NTE | Эффективность транспортировки азота | Общее количество азота, перенесенного в надземные части / общее количество азота на всем предприятии |
| UI | Индекс использования | Общая биомасса растений / общее количество растений N |
| FUE | Эффективность использования удобрений | (внесено NUp / N) × 100 |
| HI | Индекс урожая | Зерно вес (вес вегетативных органов + вес зерна) |
| NHI | Индекс сбора азота | Накопление азота в зерне / общее накопление азота в надземной биомассе (например,g., зерно + солома) |
| NRE | Эффективность ремобилизации азота | Ремобилизация азота из исходных или стареющих листьев / тонких листьев или развивающихся зерен (семян) |
Таблица 1.
Некоторые определения NUE в основном используется в отношении азота.
3. Гены, ответственные за эффективность использования азота
Как правило, ЭИА можно разделить на две части: эффективность ассимиляции, участвующая в поглощении и ассимиляции азота, и эффективность использования, участвующая в ремобилизации азота.Понимание механизмов, регулирующих эти процессы, имеет решающее значение для улучшения ЭИА сельскохозяйственных культур. В почве неорганический азот доступен для растений в виде нитрата (NO 3 –) на аэробных возвышенностях и аммония (NH 4 + ) на затопленных заболоченных территориях или в кислых почвах. Корни риса в рисовых почвах выделяют кислород через свою аэренхиму, вызывают быструю нитрификацию на своей поверхности и, таким образом, поглощают N в виде NO 3 – со скоростью, сравнимой с поглощением NH 4 + [17, 18] .Были представлены прямые молекулярные доказательства поглощения NO 3 — рисом [19]. Поглощение NH 4 + или NO 3 — корнями обычно приводит к подкислению или ощелачиванию ризосферы, что, в свою очередь, изменяет доступность азота в почве [14]. Для многих растений часть NO 3 —, захваченная переносчиками нитратов (NAR2 / NRT), ассимилируется в корнях, другая большая часть транспортируется к побегам, где восстанавливается до аммония с помощью ряда ферментов (рис. 1).NH 4 + , полученный из NO 3 — или непосредственно из NH 4 + , поглощение переносчиками аммония (AMT) ассимилируется в аминокислоты через глутаминсинтетазу (GS) / глутамин-2. цикл -оксоглутарат аминотрансферазы (GOGAT), а затем экспортируется в органы-приемники [14]. Следовательно, регулирование функции генов в процессах метаболизма N, включая поглощение, ассимиляцию, компартментацию, транслокацию и ремобилизацию N, может иметь важное значение для улучшения NUE.
Рисунок 1.
Схематическое изображение охарактеризованных и прогнозируемых функций переносчиков нитрата риса семейств NRT и NPF, переносчиков аммония семейств AMT и белков ассимиляции азота GS и GOGAT.
3.1. Получение азота
Из-за неоднородности и динамических колебаний концентраций нитратов и аммония, которые варьируются от менее 100 мкМ до более 10 мМ в почвенных растворах, растения разработали переносчики как нитрата, так и аммония.Эти транспортеры подразделяются на высокоаффинную транспортную систему (HATS) и низкоаффинную транспортную систему (LATS) [20]. При низких концентрациях азота (<1 мМ) HATS обеспечивает большую часть поглощения N, тогда как при высоких концентрациях N (> 1 мМ) LATS играет роль в поглощении N [21, 22]. Каждая система транспорта нитратов с высоким и низким сродством состоит из конститутивных и индуцируемых нитратами компонентов (cHATS и iHATS) соответственно [20, 23]. На данный момент идентифицировано четыре семейства нитратных транспортеров / каналов: нитратный транспортер 1 / семейство пептидных транспортеров (NPF, также известное как семейство NRT1 / PTR), семейство нитратных транспортеров 2 (NRT2), семейство хлоридных каналов (CLC), и гомологи, ассоциированные с медленными анионными каналами (SLAC / SLAH) [24].
В рисе были идентифицированы два семейства транспортеров NPF и NRT2 (или NAR2 / NRT2) для поглощения и транслокации нитратов (таблица 2 и рисунок 1) [14, 25, 26]. По крайней мере, 80 генов принадлежат к семейству NPF в геноме риса [27]. Большинство охарактеризованных на данный момент членов семейства NPF являются транспортерами нитратов с низким сродством, за исключением того, что OsNPF6.5 (NRT1.1b) проявляет активность транспорта нитратов с двойным сродством, связанную с усилением поглощения нитратов и транспорта от корней к побегам [28]. OsNPF6.5, рассматриваемый как предполагаемый продукт сплайсинга мРНК OsNPF8.9 (NRT1 / NRT1.1 / NRT1.1a), оказывает значительное влияние как на NUE, так и на урожайность [26, 27, 28, 29]. OsNPF8.9, в основном экспрессируемый в корневом эпидермисе и волосах, был клонирован для поглощения азота [30]. Было продемонстрировано, что OsNPF4.1 (SP1) действует в удлинении метелки риса [31], а OsNPF8.20 (OsPTR9) действует в поглощении аммония, способствует формированию боковых корней и повышению урожайности зерна [32]. Однако их субстраты до сих пор неизвестны. Восемь переносчиков пептидов, OsPTR1 (OsNPF8.2), OsPTR2 (OsNPF2.2), OsPTR3 (OsNPF5.5), OsPTR4 (OsNPF7.1), OsPTR5 (OsNPF7.4), OsPTR6 (OsNPF7.3), OsPTR7 (OsNPF8.1) и OsPTR8 (OsNPF8.5), были исследованы в мутантный штамм дрожжей ptr2, и их характер экспрессии оценивали на растениях. Только OsNPF7.3 транспортирует Gly-His и Gly-His-Gly, демонстрируя селективность субстрата для ди- / трипептидов. Однако остальные семь белков не переносили пять протестированных ди- / трипептидов [33]. Повышенная экспрессия OsNPF7.3 способствовала росту риса за счет увеличения экспрессии транспортера аммония и активности глутаминсинтетазы [34].Недавно были идентифицированы OsNPF2.4 [35] и OsNPF2.2 [36], участвующие в транспорте нитратов на большие расстояния от корней к побегам. Нокаут OsNPF2.4 нарушал восходящий транспорт нитрата, связанный с калием (K), и перераспределение нитратов от старых листьев к другим органам [35]. OsNPF2.2 может выгружать нитраты из ксилемы, влияя на транспорт нитратов от корня к побегам и развитие растений [36]. Кроме того, локализованный в тонопласте низкоаффинный нитратный транспортер OsNPF7.2 был охарактеризован как играющий ключевую роль во внутриклеточном распределении нитратов в корнях [37].На сегодняшний день в рисе идентифицировано пять генов NRT2 ( OsNRT2.1 / 2.2 / 2.3a / 2.3b / 2.4 ) и два гена NAR2 ( OsNAR2.1 / 2.2 ), кодирующих компоненты HATS, каждый из которых показывает различные паттерны экспрессии и регуляции (таблица 2) [19, 38]. Среди пяти генов OsNRT2s , OsNRT2.1 и OsNRT2.2 имеют идентичную последовательность кодирующей области с разными 5′- и 3′-нетранскрибируемыми областями [38, 39, 40]. OsNRT2.3a и OsNRT2.3b получены в результате альтернативного сплайсинга OsNRT2.3 [38]. OsNRT2.3a в основном экспрессируется в паренхиме ксилемы корня, участвуя в транспорте нитратов на большие расстояния от корня к побегу при низких концентрациях нитратов [41]. OsNRT2.3b в основном экспрессируется во флоэме побега, чувствительной к pH. Повышенная экспрессия OsNRT2.3b увеличивала поглощение N, Fe и P и улучшала урожай зерна и NUE [42]. OsNAR2.1 , OsNRT2.1 и OsNRT2.2 обильно экспрессировались в первичных и боковых корнях. Сверхэкспрессия гена OsNRT2.1 сама по себе не увеличивала поглощение нитратов рисом [43] из-за того, что активность поглощения нитратов у OsNRT2.1 , OsNRT2.2 и OsNRT2.3a требует белка-партнера , ОсНАР2.1 [19, 38, 44]. Транскрипты OsNAR2.2 и OsNRT2.4 обнаружены в корнях и побегах, накопление которых индуцировано нитратами [38, 39, 40].Однако их функции остаются неизвестными.
| Регистрационный номер | Ген | Регламент | Экспрессионный паттерн | Субстраты | Ссылки | |
|---|---|---|---|---|---|---|
| AF140606 | OsNPF8.9 | Неизвестно | , конститутивно выражено в корнях | НЕТ [29, 30] | ||
| AK066920 | OsNPF6.5 | NO 3 — | Корневые волосы, эпидермис и сосудистые ткани | NO 3 — | [28, 29] | |
| AK099321.1 | OsNPF2.4 | NO 3 — | Эпидермис корня, паренхима ксилемы и сопутствующие клетки флоэмы, клетки флоэмы листа | NO 3 — | [35] | |
| AK068351 | OsNPF.2 | NO 3 — , засуха, соль | Клетки паренхимы вокруг ксилемы | NO 3 — | [36] | |
| XM_015767550 | OsNPF7.2 | NO 3 —Корневая склеренхима, клетки коры и стелы | NO 3 — | [37] | ||
| AK101480 | OsNPF7.3 | NO 3 — | Корень, семена | Gly-His Gly-His-Gly | [33, 34] | |
| AK064899 | OsNPF8.20 | N, светлый | Листья, метелки, молодые кончики корней, клетки корковых волокон боковых корней, стебли | Неизвестно | [32] | |
| AK100802 | OsNPF4.1 | Неизвестно | Флоэма ветвей молодых метелок | Неизвестно | [31] | |
| AK100112 | ОсНПФ8.2 | Засуха, соленая, холодная | Семена, лист, метелка | Неизвестно | [33] | |
| AK101055 | ОсНПФ5.5 | Неизвестно | Семена, лист | Неизвестно | [33] | |
| AK101099 | OsNPF7.1 | Неизвестно | Определяющее выражение | Неизвестно | [33] | |
| [33] | ||||||
| ОсНПФ7.4 | Засуха, соленость | Корень, метелка, узел | Неизвестно | [33] | ||
| AK070036 | ОсНПФ8.1 | Засуха, соленая | Побег, лист, метелка, семена | Неизвестно | [33] | |
| AK072691 | OsNPF8.5 | Засуха, соль | Определяющее выражение | Неизвестно | [33] | |
| AB008519 | OsNRT2.1 | NO 3 — , светлый, сахароза | Верхушка корня, меристема | NO 3 — | [38, 39, 40] | |
| AK109733 | OsNRT2.2 | NO 3 — , светлый, сахароза | Верхушка корня, меристема | NO 3 — | [38, 39, 40] | |
| AK109776 | OsNRT2.3a | NO 3 — , светлый, сахароза | Корневая стела | NO 3 — | [38, 41] | |
| AK072215 | OsNRT2.3b | Light , сахароза, pH | Флоэма побегов | NO 3 — | [38, 42] | |
| NM_193361 | OsNRT2.4 | NO 3 — , светлая, сахароза, pH, NAA | Корень, побеги | Неизвестно | [38, 39, 40] | |
| NM_001053852.2 | OsNAR2.1 | NO 3 — , светлый, сахароза | Клетки эпидермиса корня | Неизвестно | [19, 38, 39, 40] | |
| AK109571 | OsNAR2. 2 | Свет, сахароза | Корень, побег | Нет | [19, 38, 39] | |
| AF289477 | OsAMT1; 1 | NH 4 + , циркадный ритм | Конститутивное выражение | NH 4 + | [46, 48, 50, 52] | |
| AF289478 | OsAMT1; 2 | NH 4 + | Центральный цилиндр и ячейка корня поверхность кончиков корней | NH 4 + | [46, 50] | |
| AF289479 | OsAMT1; 3 | Репрессированный, циркадный ритм | Экзодерма корня, скле клетки ренхимы, энтодермы и перицикла первичного корня | NH 4 + | [46, 47, 50, 53] | |
| AB051864 | OsAMT2; 1 | Неизвестно | Конститутивная экспрессия | NH 4 + | [46] | |
| NM 1 | OsAMT2; 2 | NO 3 — , NH 4 + | Неизвестно | Неизвестно | [46, 55] | |
| NM_001051237 | OsAMT2; 3 | Неизвестно | Неизвестно | Неизвестно | [46] | |
| AB083582 | OsAMT3 | Roots , выстрелыNH 4 + | [46] | |||
| AC104487 | OsAMT3; 2 | Неизвестно | Неизвестно | Неизвестно | [46] | |
| AP004775 | OsAMT3; 3 | Неизвестно | Неизвестно | Неизвестно | [46] | |
| AC0 | OsAMT4 | OsAMT4Неизвестно | [46] | |||
| AB037664 | OsGS1; 1 | NH 4 + | Листья | NH 4 + , Glu | [58, 59] | |
| AB180688 | OsGS1; 2 | NH 4 + | Корни | NH 4 + , Glu | [58, 59, 64] | |
| AB180689 | OsGS1; 3 | Неизвестно | Колоски | NH 4 + , Glu | [58, 59] | |
| X14246 | OsGS2 | Неизвестно | Листья | NH 4 + , Glu | [58, 60] | |
| AB024716 | OsFd-GOGAT | Light | Стреляет | Gln -OG | [60, 61] | |
| AB008845 | OsNADH-GOGAT1 | NH 4 + , Gln | Развивающиеся ткани: кончик корня, преждевременная пластинка листа, колоск на ранней стадии созревание | Gln, 2-OG | [60, 61] | |
| AB274818 | OsNADH-GOGAT2 | NH 4 + | Зрелая листовая пластинка и влагалище: сопутствующие клетки флоэмы и клетки паренхимы | Gln, 2-OG | [60, 61, 68] |
Таблица 2.
Обзор литературы по тканевой экспрессии и регуляции генов, ответственных за NUE.
Поглощение аммония в основном опосредуется белками суперсемейства транспортных белков аммиака (AMT) / транспортирует метиламмоний (MEP) / резус (RH) [45]. Существуют неясности относительно точных химических веществ, переносимых AMT, которые могут быть в форме гидрофобного Nh4 или заряженного аммония [14, 45]. Активность членов AMT может играть более важную роль в NUpE у риса, предпочитающего аммоний, чем у культур, потребляющих нитраты.В рисе имеется не менее десяти предполагаемых OsAMT -подобных генов, сгруппированных в четыре подсемейства (т. Е. ., по три каждого для OsAMT1 , OsAMT2 и OsAMT3 соответственно и один для OsAMT4 ). (Таблица 2) [46]. До сих пор исследования регуляции экспрессии генов AMT в рисе в основном сосредоточены на семействе генов OsAMT1 , которые демонстрируют различные пространственно-временные паттерны экспрессии в ответ на изменения уровней N или дневной освещенности (Таблица 2) [47, 48]. OsAMT1; 1 конститутивно экспрессируется в корнях и побегах риса, демонстрируя регуляцию положительной обратной связи эндогенным глутамином [49]. Сообщалось, что OsAMT1; 1 , демонстрируя более высокий уровень экспрессии в корнях при поступлении аммония, вносит вклад в поглощение NH 4 + и играет важную роль в гомеостазе NK [48, 50, 51, 52]. OsAMT1; 2 показал специфичную для корней экспрессию, индуцируется аммонием и может функционировать как ассимилятор азота [49, 53].Корневоспецифическая и подавляющая азот экспрессия для OsAMT1; 3 может функционировать как датчик азота [49, 53]. Сверхэкспрессия OsAMT1; 3 демонстрирует значительное снижение роста, но с плохой способностью к поглощению азота, что сопровождается более высоким соотношением C / N в листьях [54]. OsAMT2; 1 обнаружил конститутивную экспрессию как в корнях, так и в побегах, а OsAMT3; 1 показал очень слабую экспрессию в корнях и побегах [46]. OsAMT2; 2 равномерно экспрессируется в корнях и побегах и индуцируется азотом [55].
3.2. Ассимиляция азота
После поглощения корнями нитрат ассимилируется в корнях, а другая большая часть транспортируется к побегам, где сначала восстанавливается до нитрита, катализируемого нитратредуктазой (NR) в цитоплазме, а затем до аммония путем нитритредуктаза (NiR) в пластидах. Аммоний, полученный из нитрата или непосредственно в результате поглощения аммония AMT, в конечном итоге ассимилируется в аминокислоты через цикл GS / GOGAT (рис. 1) [14, 22]. GOGAT катализирует перенос амидной группы глутамина (Gln), образованной GS, на 2-оксоглутарат (2-OG) с образованием двух молекул глутамата (Glu).Одна из молекул Gln может использоваться как субстрат для реакции GS, а другая может использоваться для многих синтетических реакций [56, 57].
Рис обладает тремя гомологичными, но разными генами цитозольной глутамин синтетазы (т.е. OsGS1; 1 , OsGS1; 2 и OsGS1; 3 ) и одним хлоропластным геном ( OsGS2 ). OsGS1; 1 и OsGS1; 2 оба показали высокое субстратное сродство к аммонию и индуцировались аммонием в центральном цилиндре зоны удлинения риса [58]. OsGS1; 1 экспрессировался конститутивно с более высоким профилем экспрессии в листовой пластинке и участвовал в нормальном росте риса и наполнении зерна [59, 60]. OsGS1; 1 также действует в координации глобальной метаболической сети в растениях риса, выращенных с использованием аммония в качестве источника азота [60], и важен для ремобилизации азота во время естественного старения [61, 62]. OsGS1; 2 конститутивно экспрессируется в поверхностных клетках корней, ответственных за первичную ассимиляцию аммония, и нокаут OsGS1; 2 показал серьезное снижение числа активных побегов [63].Однако Ohashi et al. считали, что уменьшение количества побегов является специфическим для NH 4 + событием, и разрастание подмышечных зачатков было сильно подавлено, вызванное нарушением метаболизма у мутантов OsGS1; 2 [64]. OsGS1; 3 экспрессируется исключительно в колоске [59], указывая на то, что он, вероятно, важен для созревания и / или прорастания зерна. Белок субъединицы OsGS2 присутствовал в листьях, но практически не обнаруживался в корнях [58]. Существует также небольшое семейство генов GOGAT: один ферредоксин (Fd) -зависимый тип и два НАДН-зависимых типа [65]. OsFd-GOGAT очень распространен в клетках мезофилла и других хлоропластных клетках, регулируемых светом [56], и играет важную роль в реассимиляции аммония, образующегося при фотодыхании в хлоропластах [65]. Недавно сообщалось об участии в ассимиляции азота, балансе C / N [66], старении листьев и ремобилизации азота [67]. OsNADH-GOGAT1 в основном экспрессируется в поверхностных клетках корней риса NH 4 + -зависимым образом и важен для первичной ассимиляции аммония в корнях на стадии проростков и развития числа активных побегов до сбора урожая [62 , 65]. OsNADH-GOGAT2 в основном экспрессируется в тканях сосудов зрелых листовых пластинок и играет важную роль в процессе выработки глутамина в стареющих листьях для ремобилизации азота листа через флоэму к метелке во время естественного старения. OsNADH-GOGAT2 мутанты имели заметное снижение количества колосков на метелку [62, 68].
Хотя эти наблюдаемые фенотипы и фенотипы, наблюдаемые для ферментов GS, были идентифицированы, взаимодействие между изоферментами GOGAT и изоферментами GS, их влияние на NUE, а также посттранскрипционную регуляцию этих ферментов требует дальнейшего изучения.
3.3. Ремобилизация и реассимиляция азота
Во время вегетативной стадии листья являются стоком для азота; позже, во время старения, этот N ремобилизуется для повторного использования в развивающихся семенах, в основном в виде аминокислот (Рисунок 1) [69]. До 95% протеина семян получают из аминокислот, которые экспортируются в семена после разложения существующих протеинов в листьях [14], а остальная часть пополняется из почвы и удобрений с поздним внесением удобрений [70]. Gln и аспарагин (Asn) являются основными формами общих аминокислот во флоэме и ксилемном соке растений риса [14, 71].Повышение концентрации как Asn, так и Gln во время старения в соке флоэмы предполагает их ключевую роль в обеспечении доступности азота для ремобилизации из стареющих листьев. Некоторые изоформы GS1, НАДН-глутаматдегидрогеназа (GDH) и аспарагинсинтетаза (AS) сильно активируются во время ремобилизации азота [72]. Природа переносчиков аминокислот, принадлежащих к сложным мультигенным семействам, плохо изучена в загрузке флоэмы для перераспределения азота во время старения [69].
Важность активности GS / GOGAT в ремобилизации, реассимиляции, скорости роста, урожайности и наполнении зерна N подчеркивалась ранее.OsGS1; 1 и OsNADH-GOGAT2 важны для ремобилизации азота во время естественного старения [62]. GS1; 2 также важен в развитии активных побегов за счет ассимиляции NH 4 + , образующихся в процессе синтеза лигнина [64]. Считается, что вместе с GS, AS играет решающую роль в первичном метаболизме N, катализируя образование Asn и Glu из Gln и аспартата [14, 64]. Идентифицированы два гена (т.е. OsAS1 и OsAS2 ), кодирующие AS в рисе. OsAS1 в основном экспрессируется на поверхности корня (эпидермис, экзодерма и склеренхима) NH 4 + -зависимым образом, что очень похоже на OsGS1; 2 и NADH-GOGAT1 в корнях риса. Таким образом, AS1, по-видимому, связан с первичной ассимиляцией NH 4 + в корнях риса. OsAS2 , обнаруженный в клетках-компаньонах и паренхиме флоэмы [71, 73], в изобилии присутствует в листовых пластинках и чехлах вместе с белком GS1; 1 [61].Это предполагает, что AS2 в листьях риса, вероятно, важен для переноса аспарагина на большие расстояния из листьев риса во время естественного старения. Кроме того, митохондриальный GDH играет главную роль в реассимиляции фотодыхательного аммиака и может альтернативно включать аммоний в Glu в ответ на высокие уровни аммония при стрессе [72]. Хотя в рисе присутствует большое количество аминокислотных пермеаз (ААР) [74, 75], функционально не охарактеризовано ни одного транспортера, за исключением OsAAP6, , который в основном экспрессируется в семенах по содержанию белка зерна [76].Недавно транспортная функция четырех генов ААР риса ( OsAAP1 , OsAAP3 , OsAAP7 и OsAAP16 ) была проанализирована путем экспрессии в ооцитах Xenopus laevis , электрофизиологии и клеточной локализации. OsAAP1 , OsAAP7 и OsAAP16 функционировали как общие AAP и могли хорошо транспортировать все аминокислоты, кроме аспартата и β-аланина. В то время как OsAAP3 обладал отчетливой субстратной специфичностью, хорошо переносящей основные аминокислоты лизин и аргинин, но селекцию которых происходило в отношении ароматических аминокислот [77].
4. Повышение эффективности использования азота
Как упоминалось выше, молекулярные исследования предоставили общую проверку физиологической концептуальной основы ЭИА риса. Однако, помимо генетики, необходимо учитывать и другие факторы, такие как взаимодействие между потреблением N и доступностью воды, взаимодействие между использованием N и углеродным метаболизмом, а также взаимодействие между различными макроэлементами и микронутриентами [13]. Понимание механизмов, регулирующих движение азота в рисе, имеет решающее значение для улучшения ЭИА.Улучшения в NUE являются результатом NUpE, NUtE или обоих. Мы описываем подходы к увеличению NUE с особым вниманием к генетике и управлению сельским хозяйством.
4.1. Увеличение емкости поглощения
Повышение емкости поглощения азота может быть достигнуто за счет улучшения переносчиков азота, более эффективного регулирования транспортных систем или лучшего хранения и ассимиляции. Простым примером улучшения NUpE могло бы быть увеличение поглощения за счет сверхэкспрессии более эффективных транспортеров или всех транспортеров с использованием трансгенных методов [28, 42, 48, 78].Однако только увеличить поглощающую способность корней непросто из-за жесткой регуляции поглощения N, избыток N поглощается в соответствии с требованиями, повышающими N-статус растений, что, в свою очередь, приводит к регулированию обратной связи и снижению способности поглощения [20].
Физиологические особенности, которые также могут влиять на NUpE, включая архитектуру корня и любые другие характеристики, играют ключевую роль в извлечении доступного азота из почвы [13, 79]. Способность корня к поглощению зависит от степени распространения корня и его площади поглощения, которая определяется сложной морфологией корня.Типичный пример — нацеливание на гены, связанные с морфологией корня, с помощью подхода картирования, при котором признаки идентифицируются посредством генетических скрещиваний с использованием различных популяций, а затем локусы количественных признаков (QTL) могут быть клонированы посредством позиционного клонирования [79, 80, 81]. На сегодняшний день были проведены исследования для определения морфологических особенностей корня, таких как масса и глубина корня, длина оси корня и боковое ветвление, связанных с NUE [82, 83, 84].
Однако поглощение аммония или нитратов корнями риса обычно приводит к подкислению или защелачиванию ризосферы, что, в свою очередь, изменяет доступность азота в почве для растений.В ризосфере корни риса также могут выделять кислород и экссудаты, которые сильно влияют на локальный окислительно-восстановительный потенциал, а также на плотность и активность микробных популяций, которые, в свою очередь, могут взаимно преобразовывать формы азота в почве, в том числе полученные из удобрений [14]. Таким образом, доступность азота в почве, сильно колеблющаяся как в пространстве, так и во времени, влияет на морфологию корней, что может способствовать эффективному поглощению азота растениями [14]. Исследования с рисом подтвердили, что по сравнению с единственным питанием NH 4 + смесь NH 4 + и NO 3 — способствовала росту корней, а также абсорбции и ассимиляции азота [85, 86].В ходе управления сельским хозяйством, тип удобрения (например, удобрения с контролируемым высвобождением азота, новые потенциальные источники азота), методы внесения азотных удобрений (например, система управления питательными веществами 4R: правильный источник, правильная норма, правильное время и правильное размещение) , типы почвы, обработка почвы, плотность посадки, система возделывания культур и наличие микроорганизмов регулируются таким образом, чтобы избежать потерь азота, увеличивая эффективность использования азота удобрениями [87, 88].
Вода — еще один ключевой фактор, определяющий урожайность и ЭИА.Без достаточного количества воды растения не могут извлекать питательные вещества из почвы. Урожайность ограничивается наличием влаги, а не наличием азота, особенно кукурузы [89]. В отличие от высокогорных культур, чередование увлажнения и сушки (AWD, затопление почвы с последующим высыханием перед повторным затоплением) для уменьшения общего количества воды для орошения риса было разработано в течение ряда десятилетий. Ряд исследований показал, что AWD увеличивает урожай зерна по сравнению с непрерывным заводнением (CF) [90, 91].
На основе текущих знаний ученые разработали ряд оптимизированных методов управления культурами, таких как управление питательными веществами для конкретных участков (SSNM) [92], управление азотом в реальном времени (RTNM) [93] и предварительная интегрированная точность. система обработки риса (PRM), сочетающая SSNM с чередованием сушки и увлажняющего орошения и оптимизированной плотности пересадки [94]. Для достижения производственных целей при минимальном риске загрязнения окружающей среды разрешены только интегрированные стратегии управления N.Источники N и время применения определяют наиболее подходящий метод для нанесения. Интерес к внедрению новых знаний о методах внесения заключается в разработке датчиков для диагностики состояния N сельскохозяйственных культур в режиме реального времени на больших территориях и систем поддержки принятия решений, чтобы помочь определить рекомендации по азотным удобрениям [88].
4.2. Повышение эффективности использования
Ряд физиологических характеристик может влиять на NUtE в сельскохозяйственных культурах, включая влияние N на распределение углеводов, хранение N и ремобилизацию N из стареющих тканей, и они были подразделены на ряд компонентов исследователями [95, 96].
Повышение способности использования азота может быть достигнуто за счет сверхэкспрессии генов-кандидатов в путях, связанных с ассимиляцией, транслокацией, ремобилизацией и реассимиляцией N. Как упоминалось выше, изменения в экспрессии и активности GS и GOGAT будут влиять на ассимиляцию, рециркуляцию, реассимиляцию азота, баланс C / N и старение в рисе, потенциально влияя на наполнение зерна, урожайность и ЭИА [62, 64, 66]. Идентификация генов-кандидатов, косегрегированных с NUE при генетическом скрещивании, является еще одним эффективным методом.Было проведено одно из первых исследований QTL с анализом NUE риса [97]. Они посмотрели на QTL, связанные с NUE, и определили, косегрегированы ли они с GS1 и NADH-GOGAT. Анализ выявил семь локусов, которые совмещались с активностью GS1, и шесть локусов, которые сочетались с активностью NADH-GOGAT. Ряд QTL для агрономических признаков, связанных с использованием азота и урожайностью, был нанесен на карту в хромосомных областях, содержащих GS2, в рисе [97, 98], предполагая, что геномный регион, окружающий GS2, может быть ценным для селекции риса с улучшенными агрономическими показателями и NUE.Однако на сегодняшний день никому не удалось ввести ген GS в фон, неэффективный в отношении NUE, и показать либо повышенный NUE, либо урожайность.
Метаболизм C и N у растений тесно связан друг с другом. Для ассимиляции азота необходим углеродный метаболизм, чтобы обеспечить аденозинтрифосфат (АТФ), восстановители и углеродный скелет посредством фотосинтеза, фотодыхания и дыхания. Большие количества N используются в фотосинтезе, особенно во время рибулозо-1,5-бисфосфаткарбоксилазы-оксигеназы (Rubisco) и светособирающих комплексов для поддержки светозависимого использования CO 2 , неорганического N и воды для производства сахаров, аминокислоты и органические кислоты [99].Фотодыхание, побочная реакция фотосинтеза, имеет решающее значение для реассимиляции азота, которая катализируется Рубиско. Во время фотодыхания NH 4 + образуется в процессе синтеза метилентетрагидрофолата из глицина [100]. Дыхание — третий фундаментальный процесс энергетического обмена в темноте и в нефотосинтетических тканях, а также на свету. В дыхательных путях C-скелеты для ассимиляции N генерируются в различных секторах, таких как окислительный пентозофосфатный путь (OPPP), гликолиз и цикл TCA [101].Работа цикла TCA в освещенных листьях имеет решающее значение для обеспечения 2-OG, который необходим для производства глутамата и глутамина [101, 102, 103]. Доказано, что синтез 2-OG индуцируется активностью фосфоенолпируваткарбоксилазы (PEPC), цитрат-синтазы, изоцитратдегидрогеназы и аконитазы, в то время как последующее превращение 2-OG в фумарат может подавляться на свету [101] .
Таким образом, использование генов-кандидатов, участвующих в метаболизме C / N, является еще одним подходом к улучшению NUE.На сегодняшний день идентифицированы два ключевых гена, способствующих ЭИА риса. Известно, что хлоропластные белки составляют примерно 80% хранимого азота в тканях листа, при этом на Rubisco приходится до 50% и 20% хранимого азота в растениях C 3 и C 4 соответственно [104]. Таким образом, Rubisco представляет собой отличную молекулу для хранения азота, и его аутофагическая деградация в листьях риса может способствовать эффективной и быстрой ремобилизации азота, облегчая деградацию белка для мобилизации азота в стареющих листьях [70].Рубиско также участвует в фотодыхательных потерях, которые могут достигать 20% от общей фиксации углерода в растениях C 3 , а также высвобождает аммиак, который необходим для реассимиляции [105]. Однако, когда были проанализированы растения риса, сверхэкспрессирующие ген Rubisco (rbcS), уровень Rubisco-N до листьев-N увеличился, но не было изменений в скорости фотосинтеза [106]. PEPC является компонентом первичного метаболизма в растениях и играет нефотосинтетическую роль, так как одним из его продуктов является OAA, компонент цикла TCA [107].Эксперименты по нокдауну RNAi хлоропластной изоформы в рисе показали, что PEPC играет важную роль в ассимиляции N, особенно когда основным источником N является NH 4 + [108].
Рост и урожайность растений риса заметно зависят от повышения концентрации CO 2 и температуры [109, 110]. Многочисленные исследования показали, что увеличение CO 2 обычно стимулирует фотосинтез, снижает устьичную проводимость и изменяет условия ризосферы растений, что приводит к увеличению биомассы и урожайности сельскохозяйственных культур [111, 112, 113], тогда как повышение температуры ускоряет фенологическое развитие сельскохозяйственных культур и сокращает период налива зерновых культур, что приводит к снижению урожайности зерна и снижению урожайности во многих регионах мира [114, 115].Более того, высокая температура, если она наблюдается на критических стадиях развития сельскохозяйственных культур (таких как стадии мейоза и цветения), снижает плодовитость колосков [115]. Из-за повышенного содержания CO 2 при будущем изменении климата, связанном с повышением температуры воздуха, было опубликовано множество исследований реакции растений на взаимодействие CO 2 и температуры [109, 110, 116]. Увеличение CO 2 не смогло компенсировать негативное влияние повышения температуры на биомассу и урожай риса [109, 110].Таким образом, для получения преимуществ урожайности в будущем потребуется отбор зародышевой плазмы, устойчивой к высоким температурам.
5. Выводы
ЭИА растений — это комплексный признак, определяемый локусами количественных признаков и находящийся под влиянием изменений окружающей среды, и представляет собой интеграцию NUpE и NUtE. Существует сложная регуляция поглощения, ассимиляции и ремобилизации азота.
Улучшенное ЭИА может быть достигнуто путем генетической модификации растений и интегрированных методов управления сельским хозяйством. Первый — самый эффективный биотехнологический метод увеличения ЭИА.Это может быть достигнуто за счет сверхэкспрессии транспортеров нитрата и аммония, ответственных за поглощение азота корнями, и за счет манипулирования ключевыми генами, контролирующими баланс метаболизма азота и углерода.
Разработка комплексной исследовательской программы, объединяющей подходы, в основном основанные на физиологии всего растения, количественной генетике, прямой и обратной генетике, а также агрономические подходы для улучшения ЭИА, является основной целью в будущем.
азота — Викисловарь
Этимология Редактировать
Из французского нитрогена (придуманного Жан-Антуаном Шапталем), соответствующего нитро- + -ген .См. нитра .
Произношение Править
- (США) enPR: nī′trəjən, IPA (ключ) : /ˈnaɪ.tɹə.dʒən/, [ˈnɐɪtʰɹədʒən]
- Расстановка переносов: ni‧tro‧gen
Существительное Редактировать
азот ( счетные и бесчисленные , множественные азота )
- (неисчислимо) Химический элемент (символ N) с атомным номером 7 и атомной массой 14.0067. Это газ без цвета и запаха.
- 2006 , Майкл Поллан, Дилемма всеядного , The Penguin Press, → ISBN , стр. 42:
Вся жизнь зависит от азота ; это строительный блок, из которого природа собирает аминокислоты, белки и нуклеиновые кислоты; генетическая информация, которая упорядочивает и поддерживает жизнь, написана азотными чернилами .
- 2006 , Майкл Поллан, Дилемма всеядного , The Penguin Press, → ISBN , стр. 42:
- (бесчисленное количество) Молекулярный азот (N 2 ), бесцветный газ без запаха при комнатной температуре.
- ,
- , , 1997, , A. J. Taylor; Д.С. Мотрам, редакторы, Наука о вкусах: последние разработки [1] , Elsevier, → ISBN , стр. 63:
Летучие вещества kecap manis и его сырья экстрагировали с использованием аппарата Likens-Nickerson с диэтиловый эфир в качестве экстракционного растворителя. Затем экстракты сушили безводным сульфатом натрия, концентрировали с использованием роторного испарителя с последующей промывкой с использованием азота до тех пор, пока объем не стал примерно 0.
- , , 1997, , A. J. Taylor; Д.С. Мотрам, редакторы, Наука о вкусах: последние разработки [1] , Elsevier, → ISBN , стр. 63:

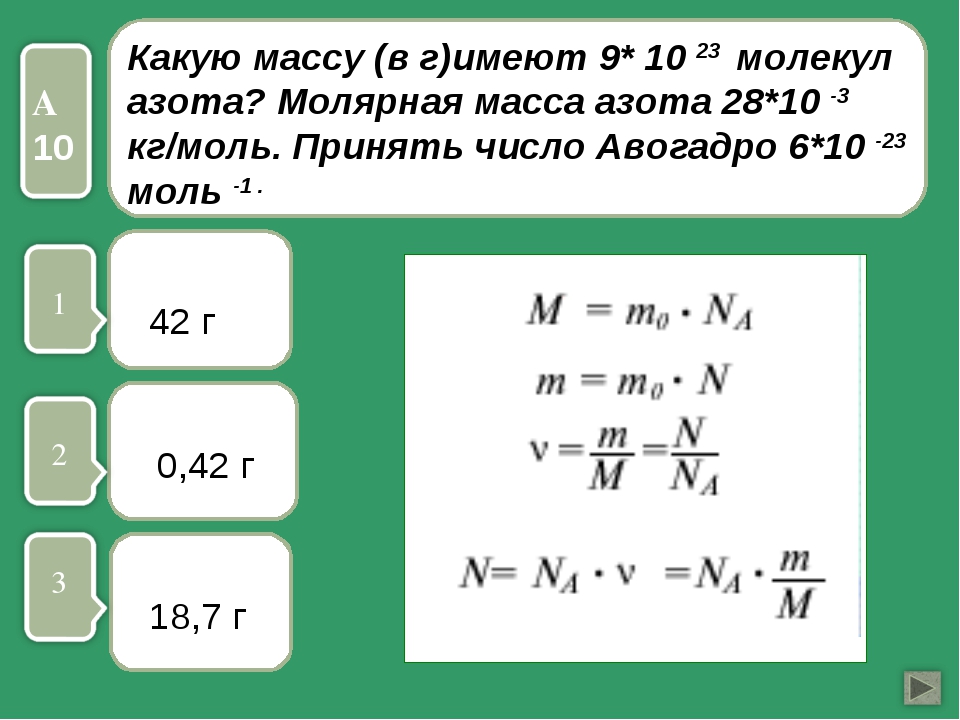 Химия азота и его соединений
Химия азота и его соединений