Азот и его характеристики
Общая характеристика азота
Большая часть азота находится в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений – белков – азот входит в состав всех живых организмов.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
В виде простого вещества азот – это бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Атомная и молекулярная масса азота
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается A
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула азота двухатомна – N2. Относительная молекулярная масса молекулы азота будет равна:
Mr(N2) = 14,0064× 2 ≈ 28.
Изотопы азота
Существует четырнадцать искусственных изотопов азота с массовыми числами от 10-ти до 13-ти и от 16-ти до 25-ти, из которых наиболее стабильным является изотоп 13Nс периодом полураспада равным 10 минут.
Ионы азота
На внешнем энергетическом уровне атома азота имеется пять электронов, которые являются валентными:
1s22s22p
Схема строения атома азота представлена ниже:
В результате химического взаимодействия азот может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
N0 –5e → N2+;
N0-4e → N4+;
N0-3e → N3+;
N0-2e → N2+;
N0-1e → N1+;
N0+1e → N1-;
N0+2e → N2-;
N0+3e → N3-.
Молекула и атом азота
Молекула азота состоит из двух атомов – N2. Приведем некоторые свойства, характеризующие атом и молекулу азота:
|
Энергия ионизации атома, эВ |
14,53 |
|
Сродство атома к электрону, эВ |
0,27 |
|
Относительная электроотрицательность |
|
|
Радиус атома, нм |
0,071 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
945 |
Примеры решения задач
Молярная масса азота (N), формула и примеры
Молярная масса азота
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Относительная атомная масса атомарного азота равна 14,0067 а.е.м. Его относительная молекулярная масса будет равна 14,0064, а молярная масса:
M(N) = Mr (N) × 1 моль = 14,0067 г/моль.
Известно, что молекула азота двухатомна – N2, тогда, относительная атомная масса молекулы азота будет равна:
Ar(N2) = 14,0067 × 2 = 28,0134 а.е.м.
Относительная молекулярная масса молекулы азота будет равна 28,0134, а молярная масса:
M(N2) = Mr (N2) × 1 моль = 28,0134 г/моль или просто 28 г/моль.
Азот представляет собой бесцветный газ, не обладающий ни запахом, ни вкусом (схема строения атома представлена на рис. 1), плохо растворимый в воде и других растворителях с очень низкими значениями температур плавления (-210oC) и кипения (-195,8oC).
Рис. 1. Строение атома азота.
Известно, что в природе азот может находиться в виде двух изотопов 14N (99,635%) и 15N (0,365%). Эти изотопы характеризуются различным содержанием нейтронов в ядре атома, а значит и молярной массой. В первом случае она будет равна 14 г/моль, а во втором – 15 г/моль.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Примеры решения задач
Азот — Циклопедия
Азот
Химический элемент
| Символ, номер | N, 7 |
| Атомная масса | 14,00643 а.е.м. |
| Электронная конфигурация | [He] 2s2 2p3 |
| Электроотрицательность | 3,04 по шкале Поллинга |
| Степени окисления | 5; 4; 3; 2; 1; 0; −1; −2; −3 |
| Плотность | 0,001251 г/см³ (при н.у.) |
| Температура плавления | -209,86 °C |
| Температура кипения | -195,75 °C |
| Структура кристаллической решетки | кубическая |
| Теплопроводность | (300 K) 0,026 Вт/(м·К) |
Азот — весьма инертный химический элемент.
[править] История открытия
В работе «Химический трактат о воздухе и огне» шведский химик К. Шееле описал получение и свойства «огненного воздуха» и отметил, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» — кислорода и «флогистованого» — азота. Однако приоритет открытия кислорода принадлежит Джозефу Пристли, потому что труд Шееле был опубликован только в 1777 году.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
[править] Происхождение названия
Название «азот» (от греч. ἀζωτος — безжизненный, (на других языках: лат. Nitrogenium — то, что порождает селитру) предложено в 1787 Антуан Лавуазье, который в то время в составе группы других французских ученых разрабатывал принципы химической номенклатуры.
[править] Распространение в природе
Круговорот азота в природеОбщее содержание азота в земной коре составляет 1 · 10−2 % по массе. Основная его масса находится в воздухе. Сухой воздух содержит в среднем 78,09 % по объему (или 75,6 % по массе) свободного азота, соответствует общей массе 4 • 1015 т.[1] В отношении малых количествах свободный азот находится в растворенном состоянии в водах океанов. В виде соединений с другими элементами (связанный азот) входит в состав всех растительных и животных организмов. Мощные месторождения азота в виде так называемой чилийской селитры известны лишь в Чили (Южная Америка). Кроме того, небольшие количества азота содержатся в почве, главным образом в виде органических соединений и солей азотной кислоты.
Азот имеет два стабильных изотопа: 14N (99,63 %) и 15N (0,37 %). Искусственно получено 4 радиоактивных изотопа азота с массовыми числами 12, 13, 16, 17.
[править] Химические свойства
Азот входит в главной подгруппы пятой группы периодической системы Менделеева. Порядковый номер его 7. Атомы азота имеют во внешней электронной оболочке пять электронов. Поэтому они могут присоединять три электрона, которых им не хватает для образования полностью заполненной восемью электронами оболочки, и восстанавливаться до ионов N 3 или терять пять валентных электронов, превращаясь в положительно заряженные ионы и проявляя при этом свою максимальную положительную валентность. Атомы азота также могут терять и меньшее количество электронов, проявляя при этом положительную валентность 1+, 2+, 3+ и 4+.
Молекулы азота двухатомные, оба атома прочно связаны между собой тремя общими электронными парами.
Чтобы разложить молекулу азота на атомы, надо потратить значительное количество энергии. Поэтому азот при обычных условиях химически довольно пассивный.
При высоких температурах, когда молекулы азота разлагаются и он переходит в атомарное состояние, он сравнительно легко вступает в реакции с металлами (особенно с активными), образуя так называемые нитриды. При высокой температуре, высоком давлении и наличии катализатора оксид соединяется с водородом с образованием аммиака. При температуре электрической искры (свыше 3000 °C) азот реагирует с кислородом, образуя неустойчивый при высокой температуре монооксид азота NO по реакции:
В природе эта реакция происходит при грозовых разрядах.
[править] Другие свойства
В обычных условиях азот физиологически инертен, но при вдыхании сжатого воздуха наступает состояние, называемое азотным наркозом, подобное алкогольному опьянению. Эти случаи могут быть при условии водолазных работ на глубине нескольких десятков метров. Для предупреждения возникновения данного состояния порой пользуются искусственными газовыми смесями, в которых азот заменен гелием или иным инертным газом. При резком и значительном снижении парциального давления азота, растворимость его в крови и тканях настолько уменьшается, что часть его выделяется в виде пузырьков, является одной из причин возникновения кессонной болезни, которая наблюдается у водолазов при быстром их поднятии на поверхность и у пилотов при больших скоростях взлета самолета, а также при входе в верхние слои атмосферы.
В смеси с кислородом азот используется как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Используется для ингаляционного наркоза.
Получение азота разложением нитрита аммонияВ лабораторных условиях чистый азот обычно получают путем разложения при нагревании раствора нитрита аммония по реакции:
Еще один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре 700 °C:
- 2NH3 + 3CuO → N2↑ + 3H2O + 3Cu.
Аммиак берут из насыщенного раствора при нагревании, количество CuO в 2 раза больше расчетного. Непосредственно перед применением азот очищают от примесей кислорода и аммиака пропусканием над медью и ее оксидом (II), затем сушат концентрированной серной кислотой и сухой щелочью. Процесс достаточно медленный, но газ получается довольно чистый.
В промышленности азот в больших количествах добывают из воздуха с помощью азотных станций.
Жидкий азотЖидкий азот применяется как хладагент и для криотерапии.
Промышленное применение газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасный, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличение выработки месторождений. В горном деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия кислорода. Если в процессе, традиционно проходит с использованием воздуха, окисления или гниения являются негативными факторами — азот может успешно заменить воздух.
Большая часть получаемого в технике азота используется для производства аммиака.
В последнее время значительное распространение получило использование азота для создания инертной среды при проведении некоторых химических реакций, при перекачке горючих жидкостей и т. д.
Поскольку азот имеет низкую температуру кипения (77,4 К), то сжиженный азот является одним из главных криогенных жидостей.
Азот присутствует во многих взрывчатых веществах. Их свойства объясняются тем, что образование молекулы азота приводит к установлению очень прочной тройной связи, при этом высвобождается большое количество энергии.
- ↑ Кравчук П. А. Рекорды природы. — Любешов: Эрудит, 1993, 216 с.
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Украинская советская энциклопедия. В 12-ти томах / Под ред. М. Желаемая. — 2-е изд. — К. : Гол. редакция УРЕ, 1974—1985.
- Ф. А. Деркач «Химия» Л. 1968
- Малая горная энциклопедия . В 3-х т. / Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004.
АЗОТ | Энциклопедия Кругосвет
Содержание статьиАЗОТ, N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом), и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого, известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3–), нитриты (NO2–), цианиды (CN–), нитриды (N3–) и азиды (N3–).
Историческая справка.
Опыты А.Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает «безжизненный». В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух». Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру».
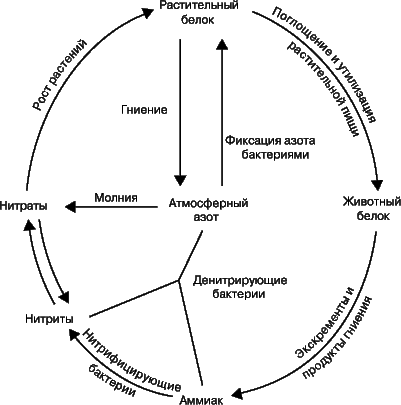
Фиксация азота и азотный цикл.
Термин «фиксация азота» означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
Строение ядра и электронных оболочек.
В природе существуют два стабильных изотопа азота: с массовым числом 14 (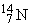 содержит 7 протонов и 7 нейтронов) и с массовым числом 15 (
содержит 7 протонов и 7 нейтронов) и с массовым числом 15 ( содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота
содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота 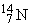 таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
Молекулярный азот.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь:N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 Å. Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2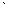 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение.
Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы.
Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы.
Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
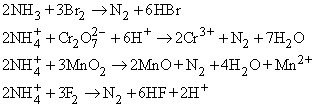
Очень удобен процесс окисления иона аммония нитрит-ионом:
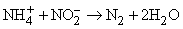
Известны и другие способы – разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:
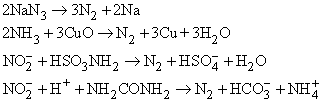
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:
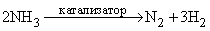
Физические свойства.
Некоторые физические свойства азота приведены в табл. 1.
| Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА | |
| Плотность, г/см3 | 0,808 (жидк.) |
| Температура плавления, °С | –209,96 |
| Температура кипения, °С | –195,8 |
| Критическая температура, °С | –147,1 |
| Критическое давление, атма | 33,5 |
| Критическая плотность, г/см3а | 0,311 |
| Удельная теплоемкость, Дж/(мольЧК) | 14,56 (15° С) |
| Электроотрицательность по Полингу | 3 |
| Ковалентный радиус, | 0,74 |
| Кристаллический радиус, | 1,4 (M3–) |
| Потенциал ионизации, Вб | |
| первый | 14,54 |
| второй | 29,60 |
| а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы. б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота. | |
Химические свойства.
Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 – стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2H4 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
| Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ | |
| Степень окисления | Примеры соединений |
| –III | Аммиак NH3, ион аммония NH4+, нитриды M3N2 |
| –II | Гидразин N2H4 |
| –I | Гидроксиламин NH2OH |
| I | Гипонитрит натрия Na2N2O2, оксид азота(I) N2O |
| II | Оксид азота(II) NO |
| III | Оксид азота(III) N2O3, нитрит натрия NaNO2 |
| IV | Оксид азота(IV) NO2, димер N2O4 |
| V | Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) |
Нитриды.
Соединения азота с более электроположительными элементами, металлами и неметаллами – нитриды – похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M–N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды.
Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3–. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя NH3 и гидроксиды металлов.
Ковалентные нитриды.
Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN – высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи.
Переходные элементы в реакции с NH3 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов – Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота.
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак Nh4.
Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
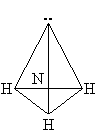
Строение молекулы.
Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака.
Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
| Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ | ||
| Свойство | Аммиак | Вода |
| Плотность, г/см3 | 0,65 (–10° С) | 1,00 (4,0° С) |
| Температура плавления, °С | –77,7 | 0 |
| Температура кипения, °С | –33,35 | 100 |
| Критическая температура, °С | 132 | 374 |
| Критическое давление, атм | 112 | 218 |
| Энтальпия испарения, Дж/г | 1368 (–33° С) | 2264 (100° С) |
| Энтальпия плавления, Дж/г | 351 (–77° С) | 334 (0° С) |
| Удельная электропроводность | 5Ч10–11 (–33° С) | 4Ч10–8 (18° С) |
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель.
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
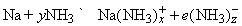
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
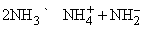
аналогично процессу, протекающему в воде:
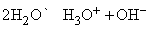
Некоторые химические свойства обеих систем сопоставлены в табл. 4.
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой.
Получение аммиака.
Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
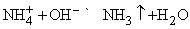
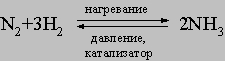
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
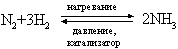
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака.
Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение NH3ЧH2O, которое часто ошибочно считают гидроксидом аммония NH4OH; в действительности существование NH4OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из NH3, H2O и и малых концентраций ионов NH4+ и OH–, образующихся при диссоциации
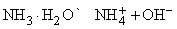
Основной характер аммиака объясняется наличием неподеленной электронной пары азота:NH3. Поэтому NH3 – это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:
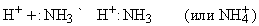
Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с NH3 с образованием координационного соединения. Например:
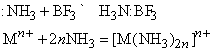
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония NH4NO3, хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина NH2CONH2, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
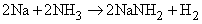
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
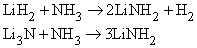
Амиды щелочных металлов (например, NaNH2) реагируют с N2O при нагревании, образуя азиды:
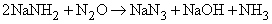
Газообразный NH3 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и H2:
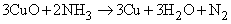
Атомы водорода в молекуле NH3 могут замещаться на галоген. Иод реагирует с концентрированным раствором NH3, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции NH3 c Cl2 образуются хлорамины NCl3, NHCl2 и NH2Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
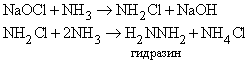
Гидразин.
Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2H4ЧH2O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода H2O2. Чистый безводный гидразин – бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
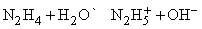
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [NH2NH2H]+X–. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты.
Оксиды азота.
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I)
N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
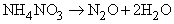
Молекула имеет линейное строение
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II)
NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
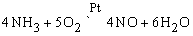
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
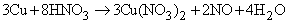
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO  N2O2.
N2O2.
Оксид азота(III)
N2O3 (триоксид азота) – ангидрид азотистой кислоты: N2O3 + H2O  2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV)
NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
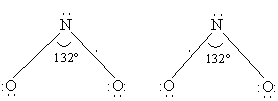
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
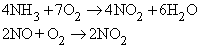
а также по реакциям:
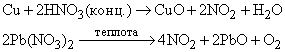
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V)
N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
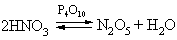
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
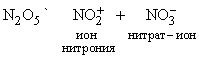
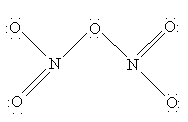
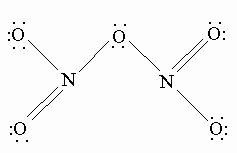
N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Оксокислоты азота.
Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота
H2N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX  2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота
HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
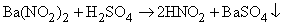
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей.
Азотная кислота
HNO3 – один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
Азот жидкий и газ: характеристика, формула, плотность, масса, температура, применение. Закись азота.
- Азот
- химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа. Бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула — N. В обычных условиях молекула азота двухатомная — N2.
История открытия азота
До сих пор ведутся споры о том, кто был первооткрывателем. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи — получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный газом, гаснет, а живое существо в атмосфере этого газа быстро гибнет. Кстати, увидеть опыт с горячей лучинкой можно в видео.
В тоже время британский физик Генри Кавендшин (Henry Cavendish) проводя подобный опыт получил N2назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) — «испорченный воздух».
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт — цианамид кальция и об этом уже писали в статье о получении ацетилена из карбида кальция.
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
- Жидкий азот
- бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз.
- Закись азота
- бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им — веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота — окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
NH4NO3 = N2O + 2H2O
- Газообразный азот
- относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом — литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например — сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.
Также газ азот используют для сварки аустенитных нержавеющих сталей — исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2 увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание метала сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Коэффициенты перевода объема и массы N2 при Т=15°C и Р=0,1 МПа
Масса, кг | Объем | |
|---|---|---|
Газ, м3 | Жидкость, л | |
| 1,170 | 1 | 1,447 |
| 0,809 | 0,691 | 1 |
| 1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы N2 при Т=0°C и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,251 | 1 | 1,548 |
| 0,809 | 0,646 | 1 |
| 1 | 0,799 | 1,237 |
Азот в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°C, Р=0,1 МПа |
|---|---|---|---|
| N2 | 40 | 7,37 | 6,3 |
Благодаря информации в таблице можно дать ответы на вопросы, которые часто задают сварщики:
- Сколько литров в баллоне азота?
Ответ: 40 литров - Сколько азота в баллоне 40л?
Ответ: 6,3 м3 или 7,37 кг - Сколько весит баллон с азотом 40 литров
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
7,37 — кг масса N2 в баллоне;
Итого: 58,5 + 7,37 = 65,87 кг вес баллона с азотом.
Давление азота в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
-40 | 11,2 |
-30 | 11,9 |
-20 | 12,6 |
-10 | 13,4 |
0 | 14,0 |
+10 | 14,7 |
+20 | 15,3 |
+30 | 15,9 |
Азот — урок. Химия, 8–9 класс.
Химический элемент
Азот — химический элемент № \(7\). Он расположен в VА группе Периодической системы химических элементов.
N7+7)2e)5e
На внешнем слое атома азота содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом азоту характерна степень окисления \(–3\), а при взаимодействии с более электроотрицательными кислородом и фтором он проявляет положительные степени окисления от \(+1\) до \(+5\).
Азот в виде простого вещества содержится в воздухе. Его объёмная доля составляет \(78\) %. В земной коре соединения азота встречаются редко. Известно месторождение нитрата натрия NaNO3 (чилийская селитра).
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Простое вещество
Молекулы простого вещества состоят из двух атомов, связанных прочной тройной связью:
N:::N…., N≡N.
При обычных условиях азот — бесцветный газ без запаха и вкуса, малорастворимый в воде.
Не ядовит.
Азот химически малоактивен из-за прочной тройной связи и в химические реакции вступает только при высоких температурах.
При комнатной температуре он реагирует только с литием с образованием нитрида лития:
6Li0+N20=2Li+13N−3.
При нагревании образует нитриды и с некоторыми другими металлами:
3Ca+N2=tCa3N2.
С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора. В реакции образуется аммиак:
N20+3h30⇄t,p,k2N−3h4+1.
В реакциях с металлами и водородом азот проявляет окислительные свойства.
Восстановительные свойства азота проявляются в реакции с кислородом:
N20+O20⇄t2N+2O−2.
Реакция возможна только при очень высокой температуре (\(3000\) °С) и частично протекает в атмосфере во время грозы. Образуется оксид азота(\(II\)).
Применение и получение
Большое количество азота используется для получения аммиака и азотных удобрений.
Применяется он для создания инертной среды при проведении химических реакций. Жидкий азот находит применение в медицине, используется для охлаждения в химических и физических исследованиях.
Чистый азот получают из воздуха.
АЗОТ — это… Что такое АЗОТ?
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:

Физические свойства. Некоторые физические свойства азота приведены в табл. 1.
Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Плотность, г/см3 0,808 (жидк.) Температура плавления, ° С -209,96 Температура кипения, ° С -195,8 Критическая температура, ° С -147,1 Критическое давление, атма 33,5 Критическая плотность, г/см3 а 0,311 Удельная теплоемкость, Дж/(мольЧК) 14,56 (15° С) Электроотрицательность по Полингу 3 Ковалентный радиус, 0,74 Кристаллический радиус, 1,4 (M3-) Потенциал ионизации, Вб
первый 14,54 второй 29,60
а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы.
б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота.
Химические свойства. Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 — стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2h5 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ
Степень окисления Примеры соединений
-III Аммиак Nh4, ион аммония Nh5+, нитриды M3N2 -II Гидразин N2h5 -I Гидроксиламин Nh3OH I Гипонитрит натрия Na2N2O2, оксид азота(I) N2O II Оксид азота(II) NO III Оксид азота(III) N2O3, нитрит натрия NaNO2 IV Оксид азота(IV) NO2, димер N2O4 V Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) Нитриды. Соединения азота с более электроположительными элементами, металлами и неметаллами — нитриды, — похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M-N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды. Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3-. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя Nh4 и гидроксиды металлов.
Ковалентные нитриды. Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN — высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи. Переходные элементы в реакции с Nh4 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов — Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота. Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода — аммиак Nh4 и гидразин N2h5. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак Nh4. Аммиак — один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
Строение молекулы. Молекула Nh4 имеет почти пирамидальное строение. Угол связи H-N-H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
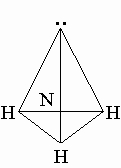
Cвойства аммиака. Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель. Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
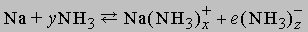
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация

аналогично процессу, протекающему в воде
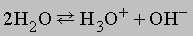
Некоторые химические свойства обеих систем сопоставлены в табл. 4. Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой. Получение аммиака. Газообразный Nh4 выделяется из солей аммония при действии сильного основания, например, NaOH:
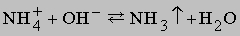
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака. Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение Nh4Чh3O, которое часто ошибочно считают гидроксидом аммония Nh5OH; в действительности существование Nh5OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из Nh4, h3O и малых концентраций ионов Nh5+ и OH-, образующихся при диссоциации
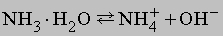
Основной характер аммиака объясняется наличием неподеленной электронной пары азота :Nh4. Поэтому Nh4 — это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:

Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с Nh4 с образованием координационного соединения. Например:
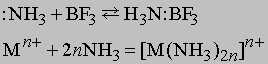
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония Nh5NO3, хлорид аммония Nh5Cl, сульфат аммония (Nh5)2SO4, фосфат аммония (Nh5)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина Nh3CONh3, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
Амиды щелочных металлов (например, NaNh3) реагируют с N2O при нагревании, образуя азиды:
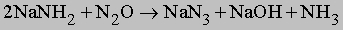
Газообразный Nh4 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и h3:
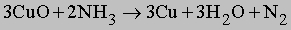
Атомы водорода в молекуле Nh4 могут замещаться на галоген. Иод реагирует с концентрированным раствором Nh4, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции Nh4 c Cl2 образуются хлорамины NCl3, NHCl2 и Nh3Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
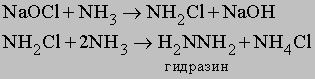
Гидразин. Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2h5Чh3O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода h3O2. Чистый безводный гидразин — бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
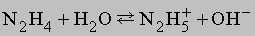
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [[Nh3Nh3H]]+X-. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты. Оксиды азота. В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4). Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
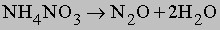
Молекула имеет линейное строение
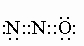
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине. Оксид азота(II) NO — бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
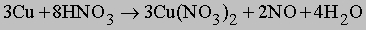
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например, в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2. Оксид азота(III) N2O3 (триоксид азота) — ангидрид азотистой кислоты: N2O3 + h3O 2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (-20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. -102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2. Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
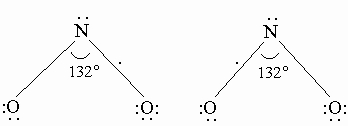
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
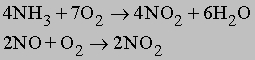
а также по реакциям:
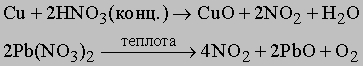
При комнатной температуре NO2 — газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при -9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4. NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + h3O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта — азотной кислоты. Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) — белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
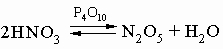
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
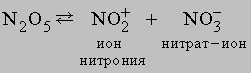
N2O5 — хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Оксокислоты азота. Для азота известны три оксокислоты: гипоазотистая h3N2O2, азотистая HNO2 и азотная HNO3. Гипоазотистая кислота h3N2O2 — очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла — гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + h3N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H-O-N=N-O-H.
Азотистая кислота HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
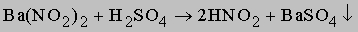
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H-O-N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты. Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты — нитриты — хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей. Азотная кислота HNO3 — один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Справочник азотчика. М., 1969 Некрасов Б.В. Основы общей химии. М., 1973 Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982
Энциклопедия Кольера. — Открытое общество. 2000.
Синонимы:- УГЛЕРОД
- КИСЛОРОД
Смотреть что такое «АЗОТ» в других словарях:
АЗОТ — (N) химический элемент, газ, без цвета, вкуса и запаха; составляет 4/5 (79 %) воздуха; уд. вес 0,972; атомный вес 14; сгущается в жидкость при 140 °С. и давлении 200 атмосфер; составная часть многих растительных и животных веществ. Словарь… … Словарь иностранных слов русского языка
АЗОТ — АЗОТ, хим. элемент, симв. N (франц. AZ), порядковый номер 7, ат. в. 14,008; точка кипения 195,7°; 1 л А. при 0° и 760 мм давл. весит 1,2508 г [лат. Nitrogenium («порождающий селитру»), нем. Stickstoff («удушающее… … Большая медицинская энциклопедия
АЗОТ — (лат. Nitrogenium) N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a отрицательная приставка и zoe жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2 атомных… … Большой Энциклопедический словарь
азот — а м. azote m. <араб. 1787. Лексис.1. алхим. Первая материя металлов металлическая ртуть. Сл. 18. Пустился он <парацельс> на конец по свету, предлагая всем за весьма умеренную цену свой Лауданум и свой Азот, для изцеления всех возможных… … Исторический словарь галлицизмов русского языка
АЗОТ — (Nitrogenium), N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067; газ, tкип 195,80 шС. Азот основной компонент воздуха (78,09% по объему), входит в состав всех живых организмов (в организме человека… … Современная энциклопедия
Азот — (Nitrogenium), N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067; газ, tкип 195,80 °С. Азот основной компонент воздуха (78,09% по объему), входит в состав всех живых организмов (в организме человека… … Иллюстрированный энциклопедический словарь
Азот — (хим. знак N, атомный вес 14) один из химических элементов;бесцветный газ, не имеющий ни запаха, ни вкуса; очень мало растворим вводе. Удельный вес его 0.972. Пикте в Женеве и Кальете в Париже удалосьсгустить азот, подвергая его высокому давлению … Энциклопедия Брокгауза и Ефрона
Азот — N (лат. Nitrogenium * a. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), хим. элемент V группы периодич. системы Mенделеева, ат.н. 7, ат. м. 14,0067. Oткрыт в 1772 англ. исследователем Д. Pезерфордом. При обычных условиях A.… … Геологическая энциклопедия
АЗОТ — муж., хим. основание, главная стихия селитры; селитротвор, селитрород, селитряк; он же главная, по количеству, составная часть нашего воздуха (азота 79 объемов, кислорода 21). Азотистый, азотный, азотовый, азот в себе содержащий. Химики различают … Толковый словарь Даля
азот — органоген, нитроген Словарь русских синонимов. азот сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
Азот — это газ, который гасит пламя, так как не горит и не поддерживает горения. Его получают фракционной перегонкой жидкого воздуха, хранят под давлением в стальных баллонах. Азот применяют, в основном, для производства аммиака и цианамида кальция, а… … Официальная терминология
Книги
- Тесты по химии Азот и фосфор Углерод и кремний Металлы 9 класс К учебнику Г Е Рудзитиса Ф Г Фельдмана Химия 9 класс, Боровских Т.. Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения). Пособие включает тесты, охватывающие темы учебника Г. Е. Рудзитиса, Ф. Г.… Подробнее Купить за 115 руб
- Тесты по химии. Азот и фосфор. Углерод и кремний. Металлы. 9 класс. К учебнику Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия. 9 класс, Боровских Татьяна Анатольевна. Данное пособие полностью соответствует новому образовательному стандарту (второго поколения). Пособие, включающее тренировочные и контрольные тесты, является необходимым современным… Подробнее Купить за 111 грн (только Украина)
- Тесты по химии. Азот и фосфор. Углерод и кремний. Металлы. 9 класс. К учебнику Г. Е. Рудзитиса. ФГОС, Боровских Татьяна Анатольевна. Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения). Пособие включает тесты, охватывающие 3 темыучебника Г. Е. Рудзитиса, Ф. Г.… Подробнее Купить за 104 руб
Атомный вес азота — Большая химическая энциклопедия
| Рисунок 10.3-40. Рейтинг стратегии разрыва связей углерод-гетероатом проиллюстрирован. Обратите внимание на атом азота третичной аминогруппы. Он окружен тремя стратегическими связями с разными ценностями. Низкое значение 9 для одной из этих связей возникает из-за того, что эта связь ведет к хиральному центру. Поскольку его формирование требует стереотипной реакции, стратегический вес этой облигации был обесценен.В отличие от этого, значение связи, соединяющей экзоциклический остаток, было увеличено до 85, что можно сравнить с его основным значением как аминной связи. |  |
Когда номинальная молекулярная масса соединения, содержащего только C, H, O и N, нечетная, количество атомов азота должно быть нечетным. [Pg.814]
Кольцевые атомы азота могут образовывать водородные связи, и если азол содержит группу NH, происходит ассоциация. Имидазол (84) показывает криоскопическую молекулярную массу в бензоле в 20 раз больше ожидаемой. Его температура кипения составляет 256 ° C, что выше, чем у 1-метилимидазола (198 ° C). [Стр.50]
Азот имеет два стабильных изотопа N (относительная атомная масса 14.003 07, численность 99,634%) и (15,000 11, 0,366%) их относительная численность (272 1) практически неизменна в земных источниках и соответствует атомной массе 14,00674 (7). Оба изотопа имеют ядерный спин и могут использоваться в экспериментах с ЯМР. хотя … [Pg.411]
Важной группой антиметаболитов являются азааналоги пиримидиновых и пуриновых оснований, которые теоретически получают заменой метиновой группы пиримидинового или пуринового ядра атомом азота. Эта замена представляет собой относительно небольшое изменение структуры этих веществ, так как не изменяет функциональные группы, практически сохраняет молекулярную массу и дает почти изостерические соединения.Замена метина … [Pg.190]
Азотное правило масс-спектрометрии гласит, что соединение с нечетным числом атомов азота имеет нечетную молекулярную массу. Таким образом, присутствие азота в молекуле определяется простым наблюдением за ее масс-спектром. Молекулярный ион с нечетным номером обычно означает, что неизвестный … [Pg.954]
Правило азота (Раздел 24.10) Соединение с нечетным числом атомов азота имеет молекулярную массу с нечетным номером. [Pg.1246]
Неудивительно, что Менделеев (1895, стр.543) сам был более предан Рэлею, и газ Рамзи должен был каким-то образом вписываться в таблицу, а атомный вес 40 означал, что он не подходил — его предпочтительная гипотеза заключалась в том, что газ состоит из трехатомного азота, N3, с гипотезой шестиатомного элемента второе место. [Стр.82]
Спектр положительных ионов Cl, использующий аммиак в качестве газа-реагента, аналита, содержащего углерод, водород, кислород и два атома азота, имеет молекулярные частицы при m / z 222. Какова молекулярная масса вовлеченного соединения… [Стр.54]
Это либо (M + 1) +, либо (M — -18) + ион, в зависимости от относительного протонного сродства аналита и аммиака. Следовательно, молекулярная масса составляет 221 или 204 Да. Поскольку молекула содержит четное число атомов азота, она должна иметь четный молекулярный вес. Следовательно, молекулярная форма должна быть (M — -18) +, поэтому молекулярная масса составляет 204 Да. [Стр.294]
Органические полимеры, заявленные в патентной литературе как эффективные стабилизаторы набухающей глины и минеральных мелких частиц, можно разделить на четыре класса.Полимеры класса 1 содержат четвертичный атом азота как часть основной цепи полимера (6-10). Полимеры этого класса включают поли (диметиламин-со-эпихлоргидрин, сокращенно поли (DMA-со-EP1) и поли (N, N, N, N, -тетраметил-1,4-1,4-диаминобутан-со). -1,4-дихлорбутан), сокращенно поли (TMDAB-co-DCB). Эти низкие молекулярные массы неудивительны, поскольку это конденсационные полимеры. Приведенные молекулярные массы находятся в диапазоне от 800 до 800 000 дальтон. [Pg.211]
Третий Класс полимеров содержит один или несколько атомов азота на боковой цепи в повторяющейся полимерной единице (13,14).Азот может быть четвертичным, а может и не быть. Помимо того, что эти полимеры являются стабилизаторами набухающей глины, они также стабилизируют не набухающие мелкие частицы минералов. Доступны ограниченные данные о молекулярной массе, но для различных полимеров указаны значения молекулярной массы от 50 000 до 1 × 10 дальтон. [Pg.211]
Результаты показывают, что эффективность полимеров на основе солей четвертичного аммония в стабилизации набухающих глин и мелких минеральных частиц зависит от химической структуры мономера и молекулярной массы полимера.По-видимому, длинные гибкие боковые цепи, содержащие четвертичные атомы азота, необходимы для того, чтобы эти полимеры функционировали в качестве стабилизаторов мелких минеральных частиц. [Pg.225]
Каждый элемент имеет атомный вес, приблизительно (но не точно) равный общему количеству протонов и нейтронов, присутствующих в каждом из его атомов. Атомные веса не совсем равны этой сумме, потому что, помимо других причин, не все атомы определенного элемента имеют одинаковое количество нейтронов.Большинство элементов имеют один или несколько изотопов, что означает атомы с одинаковым числом протонов, но разным числом нейтронов. Например, элемент азот имеет два естественных изотопа, 14N, который имеет 7 протонов и 7 нейтронов, и 15N, который содержит 7 … [Pg.21]
.
атомный вес | Определение, единицы и таблица
Атомный вес , также называемый , относительная атомная масса , отношение средней массы атомов химического элемента к некоторому стандарту. С 1961 года стандартной единицей атомной массы является одна двенадцатая массы атома изотопа углерода-12. Изотоп — это один из двух или более видов атомов одного и того же химического элемента, которые имеют разные атомные массовые числа (протоны + нейтроны). Атомный вес гелия составляет 4,002602, среднее значение, которое отражает типичное соотношение естественного содержания его изотопов.Атомный вес измеряется в атомных единицах массы (а.е.м.), также называемых дальтонами. См. Ниже для списка химических элементов и их атомных весов.
Понятие атомного веса является фундаментальным в химии, потому что большинство химических реакций протекает в соответствии с простыми числовыми соотношениями между атомами. Поскольку почти всегда невозможно напрямую подсчитать задействованные атомы, химики измеряют реагенты и продукты путем взвешивания и делают свои выводы путем расчетов с использованием атомных весов.Поиски определения атомного веса элементов занимали величайших химиков 19 и начала 20 веков. Их тщательная экспериментальная работа стала ключом к химической науке и технологиям.
Надежные значения атомных весов служат важной цели совершенно иным образом, когда химические товары покупаются и продаются на основе содержания одного или нескольких указанных компонентов. Примерами являются руды дорогих металлов, таких как хром или тантал, и промышленная кальцинированная сода.Содержание указанного компонента необходимо определять количественным анализом. Расчетная стоимость материала зависит от атомных весов, использованных в расчетах.
Первоначальным стандартом атомной массы, установленным в 19 веке, был водород со значением 1. Примерно с 1900 по 1961 год кислород использовался в качестве эталона с заданным значением 16. Единица атомной массы таким образом была определена как 1 / 16 масса атома кислорода.В 1929 году было обнаружено, что природный кислород содержит небольшое количество двух изотопов, немного тяжелее самого распространенного, и что число 16 представляет собой средневзвешенное значение трех изотопных форм кислорода, встречающихся в природе. Эта ситуация считалась нежелательной по нескольким причинам, и, поскольку можно определить относительные массы атомов отдельных изотопных частиц, вскоре была установлена вторая шкала с 16 как значение основного изотопа кислорода, а не значение натуральная смесь.Эта вторая шкала, которую предпочитают физики, стала известна как физическая шкала, а более ранняя шкала продолжала использоваться в качестве химической шкалы, которую предпочитали химики, которые обычно работали с природными смесями изотопов, а не с чистыми изотопами.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасХотя эти две шкалы различались лишь незначительно, соотношение между ними не могло быть точно зафиксировано из-за незначительных вариаций изотопного состава природного кислорода из разных источников.Было также сочтено нежелательным иметь две разные, но тесно связанные шкалы, относящиеся к одним и тем же величинам. По обеим этим причинам химики и физики установили новую шкалу в 1961 году. Эта шкала, основанная на углероде-12, потребовала лишь минимальных изменений значений, которые использовались для химических атомных весов.
Поскольку образцы элементов, встречающихся в природе, содержат смеси изотопов с разным атомным весом, Международный союз теоретической и прикладной химии (IUPAC) начал публиковать атомные веса с неопределенностями.Первым элементом, который получил неопределенность в своем атомном весе, была сера в 1951 году. К 2007 году 18 элементов имели связанные неопределенности, а в 2009 году ИЮПАК начал публиковать диапазоны для атомного веса некоторых элементов. Например, атомный вес углерода задается как [12.0096, 12.0116].
В таблице приводится список химических элементов и их атомный вес.
| элемент | символ | атомный номер | атомный вес | |
|---|---|---|---|---|
| Элементы с атомным весом, указанным в квадратных скобках, имеют атомный вес, указанный в диапазоне.В элементах с атомным весом в скобках указан вес изотопа с наибольшим периодом полураспада. | ||||
| Источники: Комиссия по изотопному содержанию и атомным весам, «Атомные веса элементов 2015»; и Национальный центр ядерных данных, Брукхейвенская национальная лаборатория, NuDat 2.6. | ||||
| водород | H | 1 | [1.00784, 1.00811] | |
| гелий | He | 2 | 4.002602 | |
| литий | Li | 3 | [6,938, 6,997] | |
| бериллий | Be | 4 | 9.0121831 | |
| бор | B | 5 | [10,806, 10,821] | |
| углерод | С | 6 | [12.0096, 12.0116] | |
| азот | N | 7 | [14.00643, 14.00728] | |
| кислород | O | 8 | [15,99903, 15,99977] | |
| фтор | F | 9 | 18.998403163 | |
| неон | Ne | 10 | 20,1797 | |
| натрия | Na | 11 | 22.98976928 | |
| магний | мг | 12 | [24.304, 24.307] | |
| алюминий (алюминий) | Al | 13 | 26.9815385 | |
| кремний | Si | 14 | [28,084, 28,086] | |
| фосфор | -P | 15 | 30.973761998 | |
| сера (сера) | S | 16 | [32,059, 32,076] | |
| хлор | Класс | 17 | [35,446, 35,457] | |
| аргон | Ar | 18 | 39.948 | |
| калий | К | 19 | 39.0983 | |
| кальций | Ca | 20 | 40.078 | |
| скандий | SC | 21 | 44.955908 | |
| титан | Ti | 22 | 47,867 | |
| ванадий | В | 23 | 50.9415 | |
| хром | Cr | 24 | 51.9961 | |
| марганец | Mn | 25 | 54.938044 | |
| утюг | Fe | 26 | 55,845 | |
| кобальт | Co | 27 | 58.933194 | |
| никель | Ni | 28 | 58.6934 | |
| медь | Cu | 29 | 63,546 | |
| цинк | Zn | 30 | 65.38 | |
| галлий | Ga | 31 | 69,723 | |
| германий | Ge | 32 | 72,630 | |
| мышьяк | As | 33 | 74.921595 | |
| селен | SE | 34 | 78.971 | |
| бром | руб. | 35 | [79,901, 79,907] | |
| криптон | Кр | 36 | 83.798 | |
| рубидий | руб. | 37 | 85,4678 | |
| стронций | Sr | 38 | 87,62 | |
| иттрий | Я | 39 | 88, | |
| цирконий | Zr | 40 | 91,224 | |
| ниобий | Nb | 41 | 92. | |
| молибден | Пн | 42 | 95.95 | |
| технеций | TC | 43 | (97) | |
| рутений | Ру | 44 | 101,07 | |
| родий | Rh | 45 | 102, | |
| палладий | Pd | 46 | 106,42 | |
| серебро | Ag | 47 | 107,8682 | |
| кадмий | Кд | 48 | 112.414 | |
| индий | В | 49 | 114,818 | |
| банка | Sn | 50 | 118,710 | |
| сурьма | Сб | 51 | 121.760 | |
| теллур | Te | 52 | 127,60 | |
| йод | I | 53 | 126. | |
| ксенон | Xe | 54 | 131.293 | |
| цезий (цезий) | CS | 55 | 132. | 196 |
| барий | Ba | 56 | 137,327 | |
| лантан | La | 57 | 138. | |
| церий | CE | 58 | 140.116 | |
| празеодим | Пр | 59 | 140. | |
| неодим | Nd | 60 | 144.242 | |
| прометий | вечера | 61 | (145) | |
| самарий | см | 62 | 150,36 | |
| европий | Eu | 63 | 151.964 | |
| гадолиний | Gd | 64 | 157,25 | |
| тербий | Тб | 65 | 158.92535 | |
| диспрозий | Dy | 66 | 162.500 | |
| гольмий | Ho | 67 | 164.93033 | |
| эрбий | Er | 68 | 167,259 | |
| тулий | ТМ | 69 | 168.93422 | |
| иттербий | Yb | 70 | 173.045 | |
| лютеций | Лю | 71 | 174.9668 | |
| гафний | Hf | 72 | 178.49 | |
| тантал | Ta | 73 | 180.94788 | |
| вольфрам (вольфрам) | Вт | 74 | 183,84 | |
| рений | Re | 75 | 186.207 | |
| осмий | Os | 76 | 190,23 | |
| иридий | Ir | 77 | 192.217 | |
| платина | Pt | 78 | 195.084 | |
| золото | Au | 79 | 196.966569 | |
| ртуть | Hg | 80 | 200,592 | |
| таллий | Tl | 81 | [204,382, 204,385] | |
| свинец | Пб | 82 | 207,2 | |
| висмут | Bi | 83 | 208.98040 | |
| полоний | Po | 84 | (209) | |
| астатин | в | 85 | (210) | |
| радон | Rn | 86 | (222) | |
| франция | Fr | 87 | (223) | |
| радий | Ra | 88 | (226) | |
| актиний | Ac | 89 | (227) | |
| торий | Чт | 90 | 232.0377 | |
| протактиний | Па | 91 | 231.03588 | |
| уран | U | 92 | 238.02891 | |
| нептуний | Np | 93 | (237) | |
| плутоний | Pu | 94 | (244) | |
| америций | Am | 95 | (243) | |
| кюрий | см | 96 | (247) | |
| берклий | Bk | 97 | (247) | |
| калифорний | Cf | 98 | (251) | |
| эйнштейний | Es | 99 | (252) | |
| фермий | Fm | 100 | (257) | |
| менделевий | Md | 101 | (258) | |
| нобелий | Нет | 102 | (259) | |
| лоуренсий | Lr | 103 | (262) | |
| резерфорд | Rf | 104 | (263) | |
| дубний | Db | 105 | (268) | |
| сиборгий | Sg | 106 | (271) | |
| бориум | Bh | 107 | (270) | |
| хассий | HS | 108 | (270) | |
| мейтнерий | Mt | 109 | (278) | |
| дармштадтиум | DS | 110 | (281) | |
| рентген | Rg | 111 | (281) | |
| коперниций | Cn | 112 | (285) | |
| унунтриум | Уут | 113 | (286) | |
| флеровий | эт. | 114 | (289) | |
| унунпентиум | Uup | 115 | (289) | |
| ливерморий | Уровень | 116 | (293) | |
| ununseptium | Uus | 117 | (294) | |
| унуноктиум | Uuo | 118 | (294) | |
Молекулярная масса азота
Молярная масса of N = 14,0067 г / моль
Перевести граммы азота в моль или моль азота в граммы
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Азот | N | 14.0067 | 1 | 100.000% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества.Этот сайт объясняет, как найти молярную массу.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Если формула, используемая при вычислении молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
.WebElements Periodic Table »Азот» Свойства свободных атомов
-

С N O Si -P S -

- Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклиум ☢
- Бериллий
- висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Углерод
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- Фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- Молибден
- Московиум ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- Полоний
- Калий
- Празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентген ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
- Натрий
- Стронций
- Сера
- Сера
- Тантал
- Технеций
- Теллур
- Теннессин
- Тербий
- Таллий
- Торий ☢
- Тулий
- Олово
- Титан
- Вольфрам
- Уран ☢
- Ванадий
- Ксенон
- Иттербий
- Иттрий
- Цинк
- Цирконий