Формула углекислого газа
Для обозначения химических элементов используются символы, образованные от их латинских названий. Формула углекислого газа CO2 указывает на простое соединение, содержащее углерод и кислород. Вещество, характеризующееся универсальными свойствами, используется в разных отраслях, производится в промышленных и кустарных условиях,
Что такое собой представляет
Двуокись углерода имеет другие определения такие как, угольный ангидрид, сухой лед — бесцветный газ. Соединение характеризуется кисловатым вкусом, который наблюдается при наличии большой концентрации. В естественных условиях при атмосферном давлении углекислота находится в газообразном состоянии.

Источники образования двуокиси углерода включают в себя:
- дыхание животных и растений;
- деятельность вулканов;
- разложение органических веществ.
В виде соединений вещество находится в полезных ископаемых — угле, нефти, известняке, торфе. При критической температуре -31,3 ºC вещество легко сжижается, а при охлаждении превращается в массу, по внешнему виду напоминающую снег. Соединение плавится при давлении в 5 атмосфер. Жидкая углекислота не проводит электрический ток.
Сухой лед и жидкий угольный ангидрид характеризуются широким спектром применения, но эти формы легко распадаются, имеют низкую устойчивость. Газообразное соединение является важной частью состава атмосферы и Мирового океана.
Как выглядит формула
Химическая формула углеродистого соединения CO2, структурная O=C=O. Кристаллическая решетка углекислоты относится к молекулярному типу. Потенциал ионизации вещества составляет 14,3 В.
Молекула соединения характеризуется ковалентной полярной химической связью. Полярность обеспечивается большим значением электроотрицательности. Молярная масса вещества составляет 44.
Свойства углекислого газа
Углекислый газ не имеет запаха, цвета, вкуса, легко растворяется в воде. Это свойство используется при изготовлении газированных напитков. Физические свойства соединения:
- тяжелее воздуха в 1,5 раза;
- не поддерживает горение;
- плотность — 1,977 г/л;
- кристаллизуется при температуре -78,3ºC;
- сублимируется при -78 ºC;
- сухой лед испаряется при атмосферном давлении;
- в его атмосфере может поддерживаться горение щелочных и щелочноземельных металлов;
- в электрическом разряде светится бело-зеленым цветом;
- образуется при горении и гниении органических веществ.
По химическим характеристикам соединение относится к кислотным оксидам. В результате взаимодействия с водой образуется угольная кислота. Карбонаты и гидрокарбонаты образуются в результате реакции со щелочами.
При растворении в воде образуется смесь угольной кислоты и двуокиси углерода. Качественная реакция на углекислый газ характеризуется помутнением известковой воды. В результате взаимодействия гидроксида кальция образуется осадок — карбонат кальция.
Получение
Технология производства углекислоты отличается разнообразностью. Газ выделяется вместе с дымовыми отходами ТЭЦ и электростанций, при брожении спиртового состава. Абсорбирование газа предусматривает очистку, которая выполняется поэтапно в соответствии с установленными требованиями Государственного стандарта.
Газ на нефтеперерабатывающих предприятиях — путем адсорбции моноэтаноламином и карбонатом калия. Технология сбора углерода предусматривает подачу по трубопроводу веществ, которые насыщаются углекислотой.
При повышенной температуре или низком давлении происходит высвобождение чистого соединения и других продуктов распада. В лабораторных условиях извлечение CO2 возможно в результате реакции кислот и гидрокарбонатов.
Отдельно выделить газ можно на промышленных установках для получения аргона, азота и кислорода. В этом случае углекислота является второстепенным продуктом. Хранится газ под давлением в специальных баллонах, окрашенных в черный цвет с надписью желтыми буквами. Добыча жидкой двуокиси углерода производится из газа путем его дополнительной обработки различными соединениями, предусмотренными технологическим процессом.
Реакция происходит при низком давлении. После очистки газ попадает в компрессор, сжимается и восстанавливается в 2 адсорбера, очищается от второстепенных запахов и переводится в конденсат. Этот метод применяют при спиртовом брожении на пивоварнях.
Угольный ангидрит в твердом агрегатном состоянии (сухой лед) образуется путем обработки жидкости низкой температурой -56ºC. В промышленном производстве только 20% объема исходного вещества переходит в лед, а остальное количество превращается в газ.
Технология изготовления твердой углекислоты предусматривает промывку, сжатие, охлаждение газообразного углерода. После очистки активированным углем жидкость поступает в холодильник, затем направляется на испарение и под пресс.
Применение
Использование материала в различных отраслях связано с химическими и физическими свойствами вещества. Двуокись углерода безопасна для человека в низких концентрациях, является основным компонентом, поддерживающим жизнедеятельность человека. Газ не поддерживает горения, поэтому используется в системах пожаротушения.
При сварке металла предотвращает окисление и защищает от нагрева. Распыление газа в парнике стимулирует развитие растений, повышает урожайность. В медицине газ применяется для создания атмосферы при проведении операций, введении пациента в наркоз. В приборах и оборудовании вещество используется в качестве абразивного материала для прочистки.
В пищевой промышленности углекислота применяют в качестве консерванта при изготовлении напитков. Сухой лед используется в морозильных камерах, предназначенных для транспортировки. В производстве бумаги вещество регулирует водородный показатель целлюлозы или древесной массы.
Химическая промышленность использует угольный ангидрит для нейтрализации щелочей, регулирования температуры в реакциях, синтеза искусственных соединений. В металлургии двуокись углерода применяется для осаждения дыма, регулировки направления потока воды при отводе из шахт.
Компании по производству технических газов предлагают купить углекислоту, произведенную по всем требованиям и хранящуюся согласно ГОСТу. Заказ можно оформить на сайте организации, по телефону. Доставка осуществляется по предусмотренным условиям сотрудничества.
применение, технические характеристики и способы промышленного производства
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Похожие статьи
|
Физические свойства углекислоты Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом. Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты. Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу. Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах. В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе. Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер. Жидкое состояние СО2 носит техническое название «жидкая углекислота» или просто «углекислота». Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482…519 кПа при температуре 0…-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 482…7 383 кПа при температуре 0…+31,0 град.С («углекислота высокого давления»). Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой. Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потребления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках. При небольшом и среднем потреблении углекислоты (высокого давления),т для её хранения и транспортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты. За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет. При значительном потреблении, для хранения и транспортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками. Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, транспортируемые цистерны вместимостью от 3 до 18 т. Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности. Предохранительные клапаны позволяют производить проверку и ремонт без остановки и опорожнения цистерны. При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд». При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%. Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг. Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки. При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины. Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.
Техника безопасности По степени воздействия на организм человека газообразный диоксид углерода относится к 4-му классу опасности по ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Предельно допустимая концентрация в воздухе рабочей зоны не установлена, при оценке этой концентрации следует ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5%. При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника. |
Физические свойства углекислого газа :: HighExpert.RU
Углекислый газ [диоксид углерода] — негорючий бесцветный газ со слабым запахом и кисловатым вкусом, химическая формула CO2, молярная масса 44,01 кг/кмоль. Содержание углекислого газа в атмосферном воздухе составляет около 0,04%. Образуется при горении или гниении органических материалов. Относится к кислотным оксидам, при растворении в воде образует угольную кислоту, которая используется в пищевой промышленности как консервант и разрыхлитель, в химической промышленности для синтеза аммиака. Жидкая углекислота находит применение в системах пожаротушения и огнетушителях. В твёрдом состоянии в виде «сухого льда» [при температуре -73,8oC] применяется в промышленности для технологических процессов сборки неразъемных соединений с натягом [охлаждение охватываемой детали], а также в лабораторных исследованиях в качестве хладагента.
Плотность углекислого газа при нормальном атмосферном давлении 101,325 кПа (1 атм) и различной температуре
| Температура | Плотность углекислого газа, ρ |
| оС | кг/м3 |
| 7 | 1,902 |
| 27 | 1,773 |
| 47 | 1,661 |
| 67 | 1,562 |
| 87 | 1,474 |
| 107 | 1,396 |
| 127 | 1,326 |
| 177 | 1,178 |
| 227 | 1,059 |
Динамическая и кинематическая вязкость углекислого газа при нормальном атмосферном давлении и различной температуре
| Температура | Динамическая вязкость углекислого газа, μ | Кинематическая вязкость углекислого газа, ν |
| оС | (Н • c / м2) x 10-7 | (м2 / с) x 10-6 |
| 7 | 140 | 7,36 |
| 27 | 149 | 8,40 |
| 47 | 156 | 9,39 |
| 67 | 165 | 10,60 |
| 87 | 173 | 11,70 |
| 107 | 181 | 13,00 |
| 127 | 190 | 14,30 |
| 177 | 210 | 17,80 |
| 277 | 231 | 21,80 |
Основные физические свойства углекислого газа при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Теплопроводность, λ | Кинематическая вязкость, ν | Число Прандтля, Pr |
| K | кг/м3 | Дж / (кг • К) | Вт / (м • К) | (м2 / с) x 10-6 | — |
| 280 | 1,902 | 830 | 0,0152 | 7,36 | 0,765 |
| 300 | 1,773 | 851 | 0,0166 | 8,40 | 0,766 |
| 400 | 1,326 | 942 | 0,0243 | 14,30 | 0,737 |
| 500 | 1,059 | 1020 | 0,0325 | 21,80 | 0,725 |
| 600 | 0,883 | 1080 | 0,0407 | 30,60 | 0,717 |
| 700 | 0,756 | 1130 | 0,0481 | 40,30 | 0,717 |
* Табличные данные подготовлены по материалам зарубежных справочников
Формулы физических свойств углекислого газа
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств углекислого газа CO2⋆:
Плотность CO2
⋆ [ кг/м3 ]Теплоёмкость CO2
⋆ [ Дж/(кг • К) ]Теплопроводность CO2
⋆ [ Вт/(м • K) ]Динамическая вязкость CO2
⋆ [ Па • c ]Кинематическая вязкость CO2
⋆ [ м2/с ]Температуропроводность CO2
[ м2/с ]Число Прандтля CO2
[ — ]⋆ Приближённые формулы физических свойств углекислого газа получены авторами настоящего сайта.
Размерность величин: температура — градусы Цельсия. Формула плотности диоксида углерода приведена для атмосферного давления.
Приближённые формулы действительны в диапазоне температур углекислого газа от 5 до 225 oC.
объем, масса и сгорание углекислого газа
Углекислый газ, или диоксид углерода, или CO2 — одно из самых распространенных на Земле газообразных веществ. Он окружает нас в течение всей нашей жизни. Углекислый газ не имеет цвета, вкуса и запаха и никак не ощущается человеком.

 Углекислый газ
Углекислый газОн является важным участником обмена веществ живых организмов. Газ сам по себе не ядовит, но не поддерживает дыхание, поэтому превышение его концентрации ведет к ухудшению снабжения тканей организма кислородом и к удушью. Углекислый газ широко применяется в быту и в промышленности.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.


Диоксид углерода
При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.


Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.


Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Искусственные источники углекислого газа
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания транспортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амазонки.


Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления. Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере. Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства. Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили. Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.


Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.


Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
- для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.


Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.


Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.


Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.


Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:


Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде


Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Углерод. Химия углерода и его соединений
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s  2s
2s  2p
2p 
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s  2s
2s  2p
2p 
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.


Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.


Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n


Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.

В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2

Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2не поддерживает горение. Угарный газ CO горит голубым пламенем.

Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:

Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
2ZnO + C → 2Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами Например: SiC, B4C | Это соединения с металлами, в которых с.о. углерода равна -4 Например: Al4C3, Be2C | Это соединения с металлами, в которых с.о. углерода равна -1 Например: Na2C2, CaC2 | Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли: Например: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 | Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли: Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 | Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 + 4HCl → 2MgCl2 + С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3→ 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:

Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4 + О2 → 2СО + 4Н2
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:

Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):

Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
Способы получения
В лаборатории углекислый газ можно получить разными способами:
1. Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример: гидрокарбонат натрия реагирует с бромоводородной кислотой:
NaHCO3 + HBr → NaBr +H2O +CO2
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
Химические свойства
Углекислый газ — типичный кислотный оксид. За счет углерода со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, углекислый газ взаимодействует с водой. Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
KOH + CO2 → KHCO3
При избытке щелочи образуется средняя соль, карбонат калия:
2KOH + CO2 → K2CO3 + H2O
Помутнение известковой воды — качественная реакция на углекислый газ:
Ca(OH)2 + CO2 → CaCO3 + H2O
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами. При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
Например, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
Na2CO3 + CO2 + H2O → 2NaHCO3
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями.
Например, углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO2 + C → 2CO
Магний горит в атмосфере углекислого газа:
2Мg + CO2 → C + 2MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 → Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
Например, карбонат натрия взаимодействует с соляной кислотой:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- + H2O = HCO3— + OH—
II ступень: HCO3— + H2O = H2CO3 + OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHCO3 → 2Al(OH)3 + 6CO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
Более подробно про гидролиз можно прочитать в соответствующей статье.
Углекислый газ физические и химические свойства — Moy-Instrument.Ru
Растворимость воды в жидкой углекислоте в диапазоне температур от -5,8 до +22,9 град. составляет не более 0,05% по весу.При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника.
Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
Углекислый газ физические и химические свойства
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca ( OH )2 за счёт образования белого осадка – нерастворимой соли CaCO 3 :
Угольная кислота и её соли
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Кислые соли — бикарбонаты, гидрокарбонаты Na HCO3 , Ca ( HCO 3 )2
В природе встречаются :
K 2 CO 3 (поташ, в золе растений)
Na 2 CO 3 – сода, кальцинированная сода
Na 2 CO 3 x 10 H 2 O – кристаллическая сода
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№ 1. Закончите уравнения осуществимых химических реакций:
Основные химические свойства углекислого газа
Прежде чем рассматривать химические свойства углекислого газа, выясним некоторые характеристики данного соединения.
Общие сведения
Углекислый газ является важнейшим компонентом газированной воды. Именно он придает напиткам свежесть, игристость. Данное соединение является кислотным, солеобразующим оксидом. Относительная молекулярная масса углекислого газа составляет 44 г/моль. Этот газ тяжелее воздуха, поэтому скапливается в нижней части помещения. Данное соединение плохо растворяется в воде.
Химические свойства
Рассмотрим химические свойства углекислого газа кратко. При взаимодействии с водой происходит образование слабой угольной кислоты. Она практически сразу после образования диссоциирует на катионы водорода и анионы карбоната или гидрокарбоната. Полученное соединение вступает во взаимодействие с активными металлами, оксидами, а также со щелочами.
Каковы основные химические свойства углекислого газа? Уравнения реакций подтверждают кислотный характер данного соединения. Оксид углерода (4) способен образовывать карбонаты с основными оксидами.
Физические свойства
При нормальных условиях данное соединение находится в газообразном состоянии. При повышении давления можно перевести его до жидкого состояния. Этот газ не имеет цвета, лишен запаха, обладает незначительным кислым вкусом. Сжиженная углекислота является бесцветной, прозрачной, легкоподвижной кислотой, аналогичной по своим внешним параметрам эфиру либо спирту.
Относительная молекулярная масса углекислого газа составляет 44 г/моль. Это практически в 1,5 раза больше, чем у воздуха.
В случае понижения температуры до -78,5 градусов по Цельсию происходит образование сухого льда. Он по своей твердости аналогичен мелу. При испарении данного вещества образуется газообразный оксид углерода (4).
Качественная реакция
Рассматривая химические свойства углекислого газа, необходимо выделить его качественную реакцию. При взаимодействии данного химического вещества с известковой водой (гидроксидом кальция) происходит образование мутного осадка карбоната кальция.
Кавендишу удалось обнаружить такие характерные физические свойства оксида углерода (4), как растворимость в воде, а также высокий удельный вес.
Лавуазье был проведен химический эксперимент, в ходе которого он пытался из оксида винца выделить чистый металл.
Выявленные в результате подобных исследований химические свойства углекислого газа стали подтверждением восстановительных свойств данного соединения. Лавуазье при прокаливании окиси свинца с оксидом углерода (4) сумел получить металл. Для того чтобы удостовериться в том, что второе вещество является оксидом углерода (4), он пропустил через газ известковую воду.
Все химические свойства углекислого газа подтверждают кислотный характер данного соединения. В земной атмосфере данное соединение содержится в достаточном количестве. При систематическом росте в земной атмосфере данного соединения возможно серьезное изменение климата (глобальное потепление).
Именно диоксид углерода играет важную роль в живой природе, ведь данное химическое вещество принимает активное участие в метаболизме живых клеток. Именно это химическое соединение является результатом разнообразных окислительных процессов, связанных с дыханием живых организмов.
Углекислый газ, содержащийся в земной атмосфере, является основным источником углерода для живых растений. В процессе фотосинтеза (на свету) происходит процесс фотосинтеза, который сопровождается образованием глюкозы, выделением в атмосферу кислорода.
Диоксид углерода не обладает токсичными свойствами, он не поддерживает дыхания. При повышенной концентрации данного вещества в атмосфере у человека возникает задержка дыхания, появляются сильные головные боли. В живых организмах углекислый газ имеет важное физиологическое значение, к примеру, он необходим для регуляции сосудистого тонуса.
Особенности получения
В промышленных масштабах углекислоту можно выделять из дымового газа. Кроме того, СО2 является побочным продуктом разложения доломита, известняка. Современные установки для производства углекислого газа предполагают использование водного раствора этанамина, адсорбирующего газ, содержащийся в дымовом газе.
В лаборатории диоксид углерода выделяют при взаимодействии карбонатов или гидрокарбонатов с кислотами.
Применение углекислого газа
Данный кислотный оксид применяется в промышленности в качестве разрыхлителя или консерванта. На упаковке продукции данное соединение указывается в виде Е290. В жидком виде углекислоту используют в огнетушителях для тушения пожаров. Оксид углерода (4) используют для получения газированной воды и лимонадных напитков.
Что такое CO2
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.
Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
Двуокись углерода
2
«Лакмусовая бумага для CO2:» Ученые разрабатывают датчики на бумажной основе для определения двуокиси углерода
2 июня 2020 — Новый датчик для обнаружения углекислого газа может быть изготовлен на простом листе бумаги, согласно …
Ключ к снижению выбросов CO2 — металл
29 сентября 2020 г. — Исследователи производят яблочную кислоту, содержащую 4 атома углерода, путем искусственного фотосинтеза, просто добавляя ионы металлов, таких как алюминий и железо.Это решает проблему с нынешним искусственным …
Удаление «темной стороны» искусственных листьев
31 июля 2019 г. — Хотя искусственные листья обещают избавить атмосферу от углекислого газа — мощного парникового газа, у искусственных листьев есть темная сторона, на которую не обращали внимания в течение …
Химия для устойчивого развития планеты
6 марта 2018 г. — Химики разработали высокоселективный катализатор, способный восстанавливать двуокись углерода до окиси углерода.Окись углерода впоследствии может быть использована для разработки полезных …
Новый метод преобразования двуокиси углерода в метан при низких температурах
27 февраля 2020 г. — Ученые разработали новый метод преобразования диоксида углерода в метан с помощью электрического поля при низких температурах. По сравнению с предыдущими методами, этот новый метод может производить любое количество метана …
CO превращается в CO2 с помощью одного металлического атома
Мар.5, 2018 — Исследователи впервые продемонстрировали, что отдельный атом металла может действовать как катализатор при превращении окиси углерода в двуокись углерода, химической реакции, которая обычно используется в …
Как контролировать поглощение диоксида углерода растениями
21 сентября 2020 г. — Сколько углекислого газа, основного парникового газа, вызывающего глобальное потепление, поглощается растениями на суше? Это обманчиво сложный вопрос, поэтому группа ученых рекомендует объединить два…
Первая полностью перезаряжаемая углекислотная батарея с углеродным нейтралитетом
26 сентября 2019 г. — Исследователи первыми показали, что литий-углекислые батареи могут быть спроектированы для работы на полностью перезаряжаемой основе, и они успешно протестировали литий-углекислотные батареи …
Перемещение искусственных листьев из лаборатории в воздух
12 февраля 2019 г. — Исследователи предложили дизайнерское решение, позволяющее переносить искусственные листья из лаборатории в окружающую среду.Их улучшенный лист, который будет использовать двуокись углерода — мощный парниковый газ …
Дождь важен для воздействия углекислого газа на луга
6 марта 2019 г. — Биомасса растительности на пастбищах увеличивается в ответ на повышение уровня углекислого газа, но меньше, чем ожидалось. Растительность на пастбищах с влажным весенним сезоном имеет наибольшую …
.
Оксиды углерода, кремния, германия, олова и свинца
Оксиды элементов в верхней части группы 4 являются кислыми, но кислотность оксидов падает по мере того, как вы спускаетесь по группе. В нижней части группы оксиды становятся более основными, но при этом полностью не теряют своих кислотных свойств.
Оксид, который может проявлять как кислотные, так и основные свойства, называется амфотерным .
Таким образом, наблюдается тенденция от кислых оксидов в верхней части группы к амфотерным в нижней части.
Оксиды углерода и кремния
Окись углерода
С монооксидом углерода обычно обращаются как с нейтральным оксидом, но на самом деле он очень и очень слабокислый. Он не реагирует с водой, но будет реагировать с горячим концентрированным раствором гидроксида натрия с образованием раствора метаноата натрия.
Тот факт, что окись углерода реагирует с основным гидроксид-ионом, показывает, что он должен быть кислым.
Диоксиды углерода и кремния
Оба они слабокислые.
С водой
Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры.
Двуокись углерода в некоторой степени реагирует с водой с образованием ионов водорода (строго говоря, ионов гидроксония) и ионов гидрокарбоната.
Всего эта реакция:
Раствор двуокиси углерода в воде иногда называют угольной кислотой, но на самом деле только около 0.Фактически прореагировал 1% углекислого газа. Положение равновесия находится намного левее.
С основаниями
Двуокись углерода реагирует с раствором гидроксида натрия на холоде с образованием карбоната натрия или раствора гидрокарбоната натрия — в зависимости от соотношения реагирующих веществ.
Диоксид кремния также реагирует с раствором гидроксида натрия, но только если он горячий и концентрированный. Образуется раствор силиката натрия.
Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием.
Оксиды германия, олова и свинца
Окиси
Все эти оксиды амфотерные — они проявляют как основные, так и кислотные свойства.
Основная природа оксидов
Все эти оксиды реагируют с кислотами с образованием солей.
Например, все они реагируют с концентрированной соляной кислотой. Кратко это можно представить как:
. . . где X может быть Ge и Sn, но, к сожалению, требует небольшой модификации для свинца.
Хлорид свинца (II) практически нерастворим в воде, и вместо получения раствора он образовал бы нерастворимый слой над оксидом свинца (II), если бы вы использовали разбавленную соляную кислоту , что остановило бы реакцию.
Однако в этом примере мы говорим об использовании концентрированной соляной кислоты .
Большой избыток хлорид-ионов в концентрированной кислоте реагирует с хлоридом свинца (II) с образованием растворимых комплексов, таких как PbCl 4 2- . Эти ионные комплексы растворимы в воде, и проблема исчезает.
К сожалению, это означает, что вам нужно больше помнить!
.границ | Электролиз углекислого газа и воды с использованием новых щелочно-стабильных анионных мембран
Введение
За последнее десятилетие все больший интерес был направлен на использование углекислого газа для производства жидкого топлива и химикатов в качестве средства обеспечения устойчивой, углеродно-нейтральной экономики. Эффективное производство энергоемких продуктов на основе углерода из уловленного и антропогенного CO 2 с использованием возобновляемых источников энергии, таких как солнечная энергия, ветер, атомная энергия и гидроэлектроэнергия, обеспечивает основу для поиска экологически безопасного химического сырья, которое не производится из ископаемого топлива ( Halmann, 1993; Aresta, Dibenedetto, 2007; Aresta, 2010; Whipple, Kenis, 2010; Quadrelli et al., 2011; Шанкаранараянан и Шринивасан, 2012; Hu et al., 2013; Masel et al., 2014a, 2016a; Aresta et al., 2016).
Эффективное производство окиси углерода (CO) из CO 2 — одно из ключевых направлений в производстве экологически безопасного химического сырья. Это промышленно ценный химикат, который обычно производится из метана с образованием различных соотношений CO и водорода в смеси, называемого синтез-газом. Синтез-газ используется в производстве топлива, такого как дизельное топливо и бензин, а также других химикатов с помощью химии Фишера-Тропша (F-T) с использованием выбранных катализаторов и рабочих условий (Appel, 2013; Costentin et al., 2014; Masel et al., 2014a, 2016a; Лю и др., 2015).
Производство водорода из возобновляемых источников — еще одна важная область применения возобновляемых источников энергии. Водород используется во многих промышленных процессах и является составной частью концепции «водородной экономики». Это способ хранения и выработки возобновляемой энергии, которую можно использовать в качестве топлива для автомобилей и других приложений (Ursua et al., 2012; Министерство энергетики США (DOE), 2018).
Новые мембраны для щелочно-стабильных анионов
Dioxide Materials (DM) разработала группу новых мембран, функционализированных имидазолом, с использованием основной цепи на основе полистирола, которые удивительно стабильны в сильных щелочных растворах (Masel et al., 2017а, б, в). Эти мембраны теперь доступны исследователям для разработки других технологических приложений. Подробная информация об этих мембранах представлена в следующих разделах.
Sustainion ® Описание преполимерной и анионной мембраны
Анионообменные мембраны Sustanion ® основаны на дешевом и распространенном, но, что более важно, щелочно-стабильном полистироловом каркасе. Синтез полимера и последующее изготовление мембраны подробно описаны в нескольких прошлых публикациях (Masel et al., 2016b, 2017d; Куц и др., 2017; Лю и др., 2017а; Sajjad et al., 2017). Синтез включает двухэтапный процесс (рис. 1) сополимеризации с последующей функционализацией. Мембрана может быть отлита как пленка или как армированная мембрана с использованием различных армирующих материалов. Хлоридную форму мембраны затем обычно превращают в гидроксидную форму с помощью КОН.
Рисунок 1 . Синтетический путь преполимера при изготовлении анионообменных мембран Sustainion ® .
Вкратце, сополимер стирола и винилбензилхлорида получают путем свободнорадикальной аддитивной полимеризации. Затем сополимерный продукт промывают и осаждают этанолом. Затем его фильтруют, сушат и затем функционализируют 1,2,4,5-тетраметилимидазолом в растворителе Dowanol ® PM (1-метокси-2-пропанол). Дивинилбензол также добавляют в качестве сшивающего агента, чтобы улучшить прочность мембраны. Затем литая мембрана активируется в течение 8–16 ч в 1М растворе гидроксида калия для преобразования в форму гидроксида.
Расширение производства мембран
Синтетический способ получения иономера, показанный на рисунке 1, был увеличен до объемов реактора промышленного размера и перенесен в пилотную установку для нанесения покрытий промышленного размера для производства мембран. Производственный цикл мембраны обычно производит от нескольких сотен до тысячи футов мембраны шириной около 24 см. Окончательная ширина и общая длина мембраны могут быть изменены в соответствии с требованиями заказчика.
Свойства анионной мембраны
Анионообменные мембраны обычно поставляются в сухой хлоридной форме, нанесенной на полиэтилентерефталатную (ПЭТ) подкладку.Следовательно, их необходимо преобразовать в форму гидроксида, подвергая их воздействию сильного основания. DM рекомендует вымачивать мембрану в большой ванне с 1М КОН на 24–48 ч, чтобы преобразовать хлоридную форму мембраны в гидроксидную форму. Эта активация также помогает укрепить мембрану за счет сшивки с КОН, как было выявлено в недавнем исследовании ядерной магнитной спектроскопии (ЯМР) (Pellerite et al., 2017). Кроме того, во время этого процесса мембрана набухает и отделяется от полиэтиленовой пленки, которую выбрасывают.
Мембрана имеет ионообменную емкость (IEC) ~ 1,1 ммоль / г, рассчитанную с помощью стандартной методики обратного титрования (Vengatesan et al., 2015). Еще более впечатляющим является удельное сопротивление поверхности (ASR) мембраны. Таблица 1 показывает, что измеренное нормированное сопротивление для Sustanion ® 37–50 в тех же щелочных условиях более чем на порядок ниже, чем у других коммерчески доступных мембран. Анионообменная мембрана показала отличные рабочие характеристики при работе с несколькими ячейками в течение 1 000–3 000 часов и более при электрохимическом испытании ячейки в широком диапазоне pH, что подтверждается опубликованными экспериментальными данными по электролизеру диоксида углерода и щелочной воды (Masel et al., 2016b; Куц и др., 2017; Лю и др., 2017а, б; Sajjad et al., 2017). Некоторые из последних результатов освещены в следующих разделах статьи.

Таблица 1 . Измерения удельного поверхностного сопротивления (ASR) Sustanion ® 37-50 и других коммерческих ионообменных мембран в 1M KOH при 60 ° C.
Анионообменные мембраны Sustainion ® претерпевают умеренное набухание, около 5% в поперечном направлении и около 50% по толщине во время преобразования в форму гидроксида с использованием 1M КОН.Это набухание мембраны или высокое поглощение воды (~ 80%) объясняет низкие значения измерения удельного сопротивления поверхности (ASR) (то есть высокой ионной проводимости), поскольку водопоглощение кажется важным механизмом для переноса гидроксид-ионов. Признавая потребность в более стабильных по размерам и прочных мембранах, DM теперь также производит более прочные усиленные версии анионообменных мембран Sustanion ® , подходящие для использования в более крупных электролизерах и в более требовательных электрохимических приложениях.Армирующая опора делает эти мембраны более прочными как во влажном, так и в сухом состоянии.
Электрохимическое превращение CO 2 в муравьиную кислоту
За последние 30 лет многочисленные исследователи изучали эффективность различных катализаторов при электрохимическом восстановлении конверсии CO 2 в формиат / муравьиную кислоту. В различных статьях представлены превосходные сводные обзоры предыдущих экспериментальных работ (Jitaru, 2007; Rosen et al., 2011; Lu et al., 2014; Qiao et al., 2014; Плетчер, 2015; Du, 2017) и здесь не будет описываться. Совсем недавно ряд исследователей пошли еще дальше, проведя и представив отчеты об исследованиях, предоставляющих данные об эффективности полного электрохимического преобразования клеток CO 2 при получении формиата / муравьиной кислоты (Mahmood et al., 1987; Li and Oloman, 2005, 2006, 2007; Oloman, Li, 2008; Whipple et al., 2010; Agarwal et al., 2011; Alvarez-Guerra et al., 2012, 2014; Kopljar et al., 2014; White et al., 2014; Du et al, 2016; Sen et al., 2016).
DM смог успешно произвести высокие концентрации чистой муравьиной кислоты непосредственно в электрохимической ячейке в результате электрохимического восстановления CO 2 (Kaczur et al., 2017; Yang et al., 2017a, b). Это снижает потребность в кислотном превращении продуктов на основе солей формиата щелочного металла (например, формиата калия), которые обычно производятся с использованием этих альтернативных электрохимических ячеек и конфигураций процесса.
Конструкция ячейки с муравьиной кислотой (FA)
Конфигурация электрохимического элемента с муравьиной кислотой DM основана на конструкции с тремя отсеками, состоящими из анодного отсека, центрального проточного отсека, содержащего катионо-ионообменную среду, в которой продукт муравьиной кислоты собирается и удаляется из электролизера, и катодного отсека, где происходит электрохимическое восстановление CO 2 до формиат-ионов (Kaczur et al., 2017; Ян и др., 2017а, б).
Общая конфигурация электрохимического элемента с муравьиной кислотой показана на рисунке 2A. В анодном отсеке используется титановый анод с покрытием из MMO (смешанный оксид металлов), где деионизированная вода подвергается электролизу с образованием ионов кислорода и водорода (H + ). Катионно-ионная обменная мембрана, примыкающая к анодному отсеку, используется для блокирования транспорта формиат-анионов к аноду, где он окисляется до CO 2 . Образующиеся ионы водорода проходят через катионообменную мембрану в центральную проточную камеру.Катионная мембрана предпочтительной конструкции представляет собой мембрану типа перфторированной сульфоновой кислоты, которая одновременно устойчива к окислению и эффективна в блокировании транспорта формиат-анионов. В анолите используется деионизированный водный анолит, поскольку анод-мембрана имеет контактное устройство с нулевым зазором.
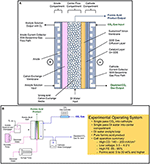
Рисунок 2 . Конструктивная конфигурация электрохимического трехкомпонентного элемента с муравьиной кислотой показана в (A) . Экспериментальная операционная система с муравьиной кислотой и сводная информация о производительности показаны в (B) .
В катодном отсеке CO 2 эффективно восстанавливается при низких перенапряжениях до образования с использованием комбинации наночастиц олова и иономерного катализатора на основе имидазола в структуре углеродного GDE (газодиффузионного электрода). Образующиеся формиат-ионы, а также образующиеся гидроксид- и бикарбонат / карбонат-ионы затем проходят через прилегающую анионообменную мембрану Sustainion ® в центральную проточную камеру.
В центральном отсеке потока используется катионо-ионообменная среда для обеспечения проводимости раствора, необходимой для продукта муравьиной кислоты, который образуется в отсеке.Формиат-ионы, образующиеся в катодном отсеке, проходят через прилегающую анионную мембрану Sustainion ® и объединяются с ионами водорода, транспортирующимися через катионообменную мембрану из анодного отсека, с образованием продукта чистой муравьиной кислоты. Деионизированная вода, дозированная в центральную проточную камеру, используется для сбора и удаления муравьиной кислоты из камеры. Концентрация муравьиной кислоты зависит от скорости потока воды, поступающей в центральный отсек потока, и тока рабочей ячейки, образуя конечный продукт из муравьиной кислоты в концентрациях, которые могут находиться в диапазоне от 2 до 30 мас.%, И при высокой эффективности по Фарадею от 85 до 95%.Любые гидроксид-ионы, попадающие в центральную проточную камеру, реагируют с ионами водорода с образованием воды, а любой перенос бикарбонатных / карбонатных ионов будет реагировать с ионами водорода с образованием CO 2 , выходящего с продуктом муравьиной кислоты в виде газообразного CO 2 . Катионо-ионообменная среда, используемая в конструкции, гранулы водородной катионообменной смолы Amberlite ® IR120, обеспечивала улучшенную ионную проводимость в центральном проточном отсеке, поскольку растворы муравьиной кислоты имеют значительно более низкую проводимость.Катионообменная среда обеспечивала более низкое рабочее напряжение ячейки (Yang et al., 2017a).
Экспериментальная операционная система с муравьиной кислотой
На рис. 2В показана схема экспериментальной операционной системы элемента с муравьиной кислотой, а также краткое описание рабочих характеристик элемента. Ячейка вырабатывала концентрацию муравьиной кислоты от 5 до 30% в зависимости от скорости потока деионизированной воды, подаваемой в центральное отделение за один проход. Диапазон рабочих плотностей тока ячейки FA составляет от 140 до 200 мА · см −2 при соответствующих напряжениях ячейки 3.5 и 4,0 вольт, работающие при комнатной температуре. Эффективность клеток Фарадея варьировалась от 80 до 95% при использовании катионообменной мембраны Nafion ® 324 и анионообменной мембраны Sustainion ® 37-50 в конфигурации ячейки (Yang et al., 2017a).
Клеточная химия с муравьиной кислотой
Ячейка с муравьиной кислотой (FA) имеет сложный набор реакций, которые происходят на аноде, катоде GDE и центральном проточном отсеке, который ограничен катионообменной мембраной на анодной стороне и анионообменной мембраной на катодной стороне. .На рисунке 3 показаны предлагаемые основные и вторичные реакции, а также перенос ионов, которые могут происходить во время работы ячейки.
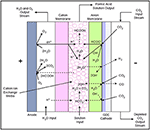
Рисунок 3 . Конфигурация ячейки DM с 3 отсеками для муравьиной кислоты, демонстрирующая предполагаемые реакции и перенос ионов.
Основные реакции клеток с муравьиной кислотой
Электрохимическое восстановление CO 2 происходит в присутствии воды на катоде с образованием формиатных (HCOO — ) и гидроксидных (OH — ) ионов:
CO2 + h3O + 2e− → HCOO− + OH− (1)Одновременно на аноде происходит окисление воды с образованием газообразного кислорода и ионов водорода (H + ).Ионы водорода на самом деле являются катионами гидроксония или оксония (H 3 O + ) в водных растворах, и в этой статье мы используем H + в качестве заменителя ионов гидроксония.
2h3O → 4H ++ 4e− + O2 (2)И формиат-ионы, и ионы гидроксида мигрируют через анионообменную мембрану в центральную проточную камеру, где они объединяются с ионами водорода, образующимися в анодной камере, проходящей через катионную мембрану, с образованием воды и муравьиной кислоты следующим образом:
H ++ OH− → h3O (3) H ++ HCOO− → HCOOH (4)Боковые реакции с муравьиной кислотой в клетке
Побочные реакции, которые могут происходить на катоде и католите, следующие:
CO2 + h3O + 2e− → CO + 2OH− (5) 2h3O + 2e− → h3 + 2OH− (6) CO2 + OH− → HCO3− (7)Анионы бикарбоната (HCO3-), образующиеся в катодном слое, мигрируют через анионообменную мембрану в центральную проточную камеру, реагируя с ионами водорода, поступающими в центральную проточную камеру из анодной камеры через прилегающую катионную мембрану с образованием CO 2 :
H ++ HCO3− → CO2 + h3O (8)Муравьиная кислота будет потеряна, если она пройдет через катионную мембрану в анолитный отсек, а затем окислится на аноде до CO 2 :
HCOOH → CO2 + 2H ++ 2e− (9)Характеристики клеток с муравьиной кислотой
Ссылка (Ян и др., 2017a) предоставляет подробную информацию о характеристиках трехкомпонентной ячейки с муравьиной кислотой. На рисунке 4 показаны рабочие характеристики ячейки с 3 отсеками для муравьиной кислоты 2 размером 5 см, имеющей конфигурацию ячейки с использованием анода из спеченного титана с покрытием IrO 2 в поле потока титана, катионной мембраны Nafion ® 324 и Sustanion ® 37–50 анионообменная мембрана, работающая при плотности тока 140 мА / см 2 . В таблице 2 представлена подробная информация о конфигурации ячейки.Ячейка проработала около 142 ч, давая концентрацию продукта муравьиной кислоты, увеличивающуюся с 8,1 до 9,4% мас., И работала с КПД по Фарадею 80% в начале и при 94% ближе к концу цикла, пока не стало отключение для проверки. Никакого износа компонентов анода / катода ячейки не отмечалось. Ключом к достижению высокой фарадеевской эффективности FA было использование катионной мембраны Nafion ® 324, которая сводила к минимуму перенос ионов формиата / муравьиной кислоты в отсек анолита.
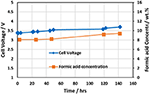
Рисунок 4 . Рабочие характеристики ячейки с муравьиной кислотой для конфигурации ячейки, приведенной в таблице 2, с использованием анода из спеченного волокна из титана с покрытием IrO 2 , катионной мембраны Nafion ® 324 и анионообменной мембраны Sustanion ® 37-50.

Таблица 2 . Ячейка с муравьиной кислотой 142 ч, конфигурация электролизера с увеличенным временем работы.
Расчетная проектная потребляемая мощность элемента с муравьиной кислотой находится в диапазоне 4.3–4,7 кВтч / кг ТВС постоянного тока при этих условиях эксплуатации. Это соответствует эксплуатационным расходам на электроэнергию в размере 214–232 доллара на тонну ТВС при стоимости электроэнергии 0,05 доллара / кВтч.
Масштабирование будущего и применение продуктов с муравьиной кислотой
Мировой рынок муравьиной кислоты и пути коммерческого химического производства, а также некоторые области применения продуктов показаны на Рисунке 5A.
Рисунок 5 . Мировой рынок муравьиной кислоты (2013 г.), показывающий текущий химический коммерческий процесс путем карбонилирования метанола, и некоторые новые применения ЖК показаны в (A) .Устойчивый способ получения муравьиной кислоты с использованием возобновляемых источников энергии и производства продуктов в различных товарных категориях показан в (B) .
Устойчивый способ производства муравьиной кислоты из возобновляемых источников
.Хлориды углерода, кремния и свинца
Тетрахлорметан (тетрахлорметан)
Четыреххлористый углерод не реагирует с водой. Если вы добавите его в воду, он просто образует отдельный слой под слоем воды.
Предположим, что молекула воды вступает в реакцию с четыреххлористым углеродом. Реакция должна начаться с присоединения кислорода молекулы воды к атому углерода через неподеленную пару кислорода. При этом атом хлора отталкивается от углерода.
С этим связаны две проблемы.
Во-первых, хлор настолько громоздкий, а атом углерода настолько мал, что кислород не может легко добраться до атома углерода.
. . . и даже если это так, будет стадия, когда вокруг этого атома углерода будет значительный беспорядок, прежде чем атом хлора полностью оторвется. Между различными неподеленными парами всех атомов, окружающих углерод, будет сильное отталкивание.
Этот беспорядок сделает эту промежуточную стадию (правильно называемую «переходным состоянием») очень нестабильной.Очень нестабильное переходное состояние означает очень высокую энергию активации реакции.
Другая проблема состоит в том, что на углероде нет удобной пустой орбитали, к которой могла бы присоединиться неподеленная пара кислорода.
Если бы он мог присоединить до того, как хлор начнет отделяться , это было бы преимуществом. Образование связи высвобождает энергию, и поэтому эта энергия будет легко доступна для разрыва связи углерод-хлор. Но в случае атома углерода это невозможно.
Тетрахлорид кремния
Иная ситуация с тетрахлоридом кремния.
Атом кремния больше, поэтому у молекулы воды больше места для атаки, и переходное состояние будет менее загроможденным.
Но у кремния есть дополнительное преимущество, заключающееся в том, что существуют пустые трехмерные орбитали, которые могут принимать неподеленную пару от молекулы воды. У углерода нет двумерных орбиталей, потому что их нет.В углеродном футляре нет пустых двухуровневых орбиталей.
Это означает, что кислород может соединиться с кремнием до того, как потребуется разорвать связь кремний-хлор. Это энергетически упрощает весь процесс.
Итак. . . Тетрахлорид кремния бурно реагирует с водой с образованием белого твердого диоксида кремния и паров HCl.
Liquid SiCl 4 дымится во влажном воздухе по этой причине — он реагирует с водяным паром в воздухе.
Тетрахлорид свинца (хлорид свинца (IV))
Реакция хлорида свинца (IV) с водой аналогична реакции тетрахлорида кремния. Вы получите оксид свинца (IV) в виде коричневого твердого вещества и испарения хлористого водорода. (Это также, конечно, будет сбивать с толку из-за разложения хлорида свинца (IV) с образованием хлорида свинца (II) и газообразного хлора — см. Выше).
Хлорид свинца (II)
В отличие от тетрахлоридов хлорид свинца (II) можно рассматривать как ионный.Он плохо растворяется в холодной воде, но лучше растворяется в горячей воде. Если смотреть просто, растворимость в воде включает в себя разрыв ионной решетки и гидратацию ионов свинца (II) и хлорида с образованием Pb 2+ (водн.) и Cl — (водн.) .
.